三黄鸡临床血管瘤病例中分离出A亚群与J亚群禽白血病病毒
王培坤,毕玉彧,秦丽莉,邹广珍,彭 昊,韦 平
(广西大学养禽与禽病学研究所,广西南宁530004)
禽白血病病毒(Avian leukosis virus,ALV)能引起禽的各种造血细胞肿瘤性增生,是鸡群中普遍存在着的一群反转录病毒[1]。其中 A、B、C、D、E、J 6个亚群能够感染鸡,A、J亚群较多在病鸡中分离到,少见B、C、D亚群,E亚群为内源性病毒,不具有致病性特征。J亚群病毒自Payne L N等[2]发现至今,该病在世界各国均有不同程度流行,给世界养禽业造成了严重的经济损失[3]。我国多个省份都有ALV-J分离到的报道[4-8],冷毕丹、张胜斌等[9-10]先后在广西三黄鸡、土鸡等地方品种鸡发现有ALV-J感染。国外报道在其他品系中发现有ALV-B和ALV-J的重组ALV[11],在中国其他品种鸡中也有ALV-A与ALV-J共感染的报道[12],王桂军、彭昊等[13-14]在广西地方品种中发现有 MDV、ALV、REV等病毒的混合感染。而从广西三黄鸡鸡群中分离到ALV-A和ALV-J共感染在国内还属首次。
为了解ALV在广西鸡群中的流行情况,本研究从同1只广西临床血管瘤型禽白血病三黄鸡病鸡分离到了2株毒株,并通过设计亚群特异性引物进行PCR确定分离到的是ALV-A与ALV-J两个毒株,克隆了两个毒株gp85基因,并与国内外分离的毒株进行了比较。
1 材料与方法
1.1 材料
1.1.1 病料及细胞 病料采自广西容县一个出现临床血管瘤型禽白血病的三黄鸡鸡场送检病鸡;DF-1鸡胚成纤维细胞由本实验室保存。
1.1.2 试 剂 pMD18-T vector、大肠埃希菌DH5α、DNA Maker DL15 000、2×TapPCR mix,北京康为世纪公司产品;禽白血病病毒p27抗原试剂检测试剂盒,Idexx公司产品;胎牛血清和DMEM,美国GIBCO公司产品。
1.2 方法
1.2.1 病毒的增殖和前病毒DNA的提取 取发病病鸡的病变肝脏、脚趾血管瘤组织,加入3倍病变组织体积的灭菌生理盐水,研磨成浆冻融3次后离心取上清,经0.22μm过滤器过滤后接种DF-1细胞进行病毒分离,9d后收集培养细胞及上清,按照DNA抽提试剂盒步骤说明提取前病毒DNA,置-20℃保存,作为PCR扩增用模板。
1.2.2 引物设计与合成 参照文献[15-16]分别设计合成A、J亚群特异性鉴定引物,用于扩增ALV-A 950bp以及 ALV-J 545bp特异性片段;A亚群gp85基因、J亚群gp85基因扩增序列引物,用于遗传变异分析。引物由华大基因公司合成。引物序列名称及序列以及目的片段大小见表1。

表1 A、J亚群鉴定以及扩增ALV-A env、ALV-J gp85基因所用引物Table 1 PrimerS for A,J subtype identification and amplification of ALV-A env,ALV-J gp85genes
1.2.3 病原鉴定 DF-1细胞接种病毒后培养9d取上清,用禽白血病病毒p27抗原试剂盒检测禽白血病病毒p27抗原,验证是否分离到禽白血病病毒。另以提取的前病毒DNA为模板,分别用鉴定引物P1/P2、H5/H7进行PCR扩增,反应程序为:95℃5min;94℃30s,50℃45s,72℃1min 30s,35个循环;72℃5min;95℃5min,95 ℃ 30s,56 ℃45s,72℃1min 30s,35个循环;72℃5min。10 g/L琼脂糖凝胶电泳鉴定PCR产物。
1.2.4 gp85基因的扩增和测序 以提取的前病毒DNA为模板,分别用扩增引物P5/P6、P7/P8进行PCR扩增,反应程序分别为:95℃5min;94℃45s,57 ℃ 45s,72 ℃ 1min,35 个 循 环;72 ℃5min。95℃ 5min;94 ℃ 40s,60 ℃ 30s,72 ℃1min,35个循环;72℃10min。10g/L琼脂糖凝胶电泳鉴定PCR产物。按照琼脂糖凝胶回收试剂盒说明书对PCR产物进行回收并与pMD18-T载体16℃连接2h后,将连接产物转化感受态大肠埃希菌DH5α,37℃培养2h后,涂板培养。过夜后挑取单个菌落扩大培养,菌液PCR鉴定阳性后送华大基因公司进行基因氨基酸的测序。
1.2.5 gp85氨基酸序列与其他参考株比较 利用DNA Star.Lasergene.7.1 等软件对测序所得的gp85基因与GenBank中发表的不同亚群ALV的gp85氨基酸序列做同源性比较,根据同源性程度及系统进化树进行同源性比较及遗传变异分析。参考毒株见表2。
2 结果
2.1 禽白血病病毒p27抗原ELISA检测结果
按照IDEXX公司禽白血病p27抗原ELISA检测试剂盒说明书,对接种病料的实验组和对照组DF-1成纤维细胞上清进行ALV-p27抗原检测。结果表明,接种病料的DF-1成纤维细胞上清检测结果为阳性,而对照组为阴性。

表2 用于gp85氨基酸序列比较所用不同亚群ALV的参考株Table 2 Reference ALV strains of different subgroups for comparison of gp85amino acid sequences
2.2 ALV-A、ALV-J特异性片段以及gp85基因扩增结果
以提取的DF-1细胞前病毒DNA模板,以P1/P2、H5/H7为引物,进行PCR扩增,扩增产物经10g/L琼脂糖凝胶电泳分析。结果显示,分别扩增出950bp、545bp的特异性片段(图1),与预期片段大小相符,说明自送检的同一只病鸡同时分离到ALV-A、ALV-J,并命名为 HG01-A,HG01-J。以P3/P4、P5/P6为引物,进行gp85扩增,经10g/L琼脂糖凝胶电泳分析。结果显示分别扩增出2 000bp、924bp的基因片段(图2),与预期片段大小相符。再次说明自送检的同一只病鸡同时分离到ALV-A和ALV-J。

图1 以H5/H7、P1/P2为引物的PCR扩增Fig.1 PCR amplifications with H5/H7,P1/P2primers

图2 gp85,env基因的PCR扩增Fig.2 PCR amplification of gp85and env genes
2.3 gp85基因测序与同源性分析
从ALV-A env基因序列中截取gp85片段命名为 ALV-A gp85,并分别把 ALV-A gp85、ALV-J gp85与GenBank登录的ALV-A亚群7株毒株、ALV-J亚群7株gp85基因同源性分析。结果表明,ALV-A gp85与7株A亚群氨基酸同源性为85.8%~87.5%,与A亚群美国株MQNCSU同源性最高为87.5%,与法国株RSA同源性为86.9%。而ALV-J gp85与7株毒株核酸序列同源性为84.0%~93.8%,其中与广东株XX2-08以及四川株SCSM01同源性最高为93.8%,与原型株同源性为90.2%(图3、图4)。
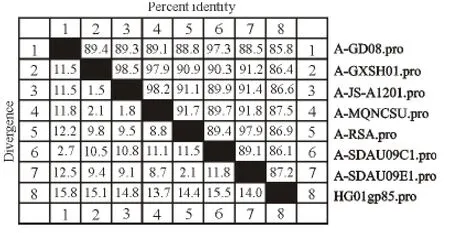
图3 HG01-A gp85基因氨基酸序列同源性比较Fig.3 Comparison of amino acid sequence identity of HG01-A gp85gene

图4 HG01-J gp85基因的氨基酸序列同源性比较Fig.4 Comparison of amino acid sequence identity of HG01-J gp85gene
2.4 序列进化分析
利用 DNA Star Lasergene.7.1软件分析绘制遗传进化树(图5、图6)。系统进化树表明,HG01-A与其他参考株处于不同的进化分支,说明他们之间的亲缘关系较远。HG01-J与四川株SCSM01处于同一个进化分支,说明他们之间的亲缘关系较近,可能由同一株毒株变异而来。

图5 HG01-A gp85基因氨基酸序列系统进化树Fig.5 Phylogenetic tree analysis of amino acid of HG01-A gp85gene

图6 HG01-J gp85基因氨基酸序列系统进化树Fig.6 Phylogenetic tree analysis of amino acid of HG01-J gp85gene
3 讨论
禽白血病病毒(ALV)在鸡群中普遍存在,能引起禽的各种造血细胞肿瘤性增生。作为引发鸡群肿瘤的主要外源性亚群,A、J亚群在全国范围内对养禽业造成了巨大损失[17]。已有报道自来航鸡中发现ALV-B和ALV-J的重组[11];817肉杂鸡肉瘤组织中同时分离出ALV-A、ALV-J亚群禽白血病病毒[12]。随后,陆续有ALV-J与REV、MDV等共感染的报道。随着我国养鸡业呈规模化集约化发展,禽白血病的影响日益严重。
本研究利用DF-1成纤维细胞接种,成功自三黄鸡分离到2株禽白血病病毒,经过ELISA检测细胞培养上清中的p27抗原以及特异性PCR扩增及gp85基因序列分析,确定在广西首次自同一只临床血管瘤型禽白血病的三黄鸡分离到一株ALV-A,1株ALV-J。本文为进一步深入研究ALV-A亚群与ALV-J亚群共感染的机制提供了依据和参考,同时进一步完善了我国地方品种鸡群中禽白血病的流行病学信息。
利用DNA Star软件对 HG01-A gp85、HG01-J gp85基因分析,发现HG01-A gp85基因与国内外已发表的7株ALV-A gp85基因的同源性为86.3%~87.8%,其中与A亚群美国株 MQNCSU同源性最高为87.5%,与A亚型经典株法国株RSA同源性为86.9%。A亚群与参考株同源性存在较大差异,表明HG01-A gp85基因已经发生了较大变异。系统进化树表明HG01-A与其他参考株处于不同的进化分支,说明他们之间的亲缘关系较远。HG01-J gp85基因与7株参考株的同源性为84.0%~93.8%,其中与广东株XX2-08以及四川株SCSM01同源性最高为93.8%,而与ALV-J亚群原型株HPRS103的同源性为90.2%。系统进化树表明HG01-J与广西株SCSM01处于同一个进化分支,说明他们之间的亲缘关系较近。而HG01-A与HG01-J两者是否发生基因重组还需要进一步证实。
HG01-A与HG01-J自同一只病鸡分离到,说明在当地鸡场中禽白血病病毒不是单一亚群存在,禽白血病的各亚群病毒在鸡群内、同一只鸡体内都可存在共感染。共感染加大了ALV的检测难度,同时对养禽业也可能会带来潜在的威胁。重组亚群ALV-J给养禽业带来巨大损失,现在共感染现象越来越频繁,共感染是否会带来新的重组亚群,造成新的威胁,还有待于后续持续观察研究。为了预防不同亚群共感染可能带来的新的亚群病毒,以及新重组病毒可能带来的影响,在我国开展ALV净化工作,并制定更加完善可操作性强的净化控制措施是必要的。
[1]杜 岩,崔治中,秦爱建,等.鸡的J亚群白血病病毒的分离及部分序列比较[J].病毒学报,2000,16(4):341-346.
[2]Payne L N,Brown S R,Bumstead N,et al.A novel subgroup of exogenous avian leukosis virus in chickens[J].J Gene Virol,1991,72:801-807.
[3]贾纯琰,张 莉,李永清,等.J亚群禽白血病病毒gp85基因的克隆与表达[J].动物医学进展,2008,29(5):7-9.
[4]潘孝成,赵瑞宏,胡晓苗,等.黄羽鸡J亚群禽白血病病毒的分离及gp85基因分析[J].动物医学进展,2014,35(2):51-54.
[5]戴 银,赵瑞宏,胡晓苗,等.安徽两个鸡场ALV-J分离株gp85基因的克隆及序列分析[J].动物医学进展,2013,34(12):38-41.
[6]王林山,尹燕博,徐守振,等.鸡J亚群禽白血病病毒与七种常见病毒混合感染的调查[J].动物医学进展,2010,31(11):111-116.
[7]Cui Z,Sun S,Zhang Z,et al.Simultaneous endemic infections with subgroup J avian leukosis virus and reticuloendotheliosis virus in commercial and local breeds of chickens[J].Avian Pathol,2009,38(6):443-448.
[8]童淑梅,杨玉莹,赵振华,等.鸡内源性类J亚群禽白血病病毒gp85基因的序列分析[J].动物医学进展,2007,28(1):17-21.
[9]冷毕丹,吴元俊,秦丽莉,等.广西主要地方优良品种鸡禽白血病的感染情况调查[J].广西畜牧兽医,2013,29(3):148-149.
[10]张胜斌,吴天威,韦 平,等.地方优良鸡种禽白血病病毒感染调查及净化[J].中国家禽,2010,32(12):11-16.
[11]Lupiani B,Pandiri A R,Mays J,et al.Molecular and biological characterization of a naturally occurring recombinant subgroup B avian leukosis virus with a subgroup J-like long terminal repeat[J].Avian Dis,2006,50(4):572-578.
[12]刘绍琼,王 波,张振杰,等.817肉杂鸡肉瘤组织分离出A,J亚型禽白血病病毒[J].畜牧兽医学报,2011,42(3):396-401.
[13]彭 昊,吴元俊,秦丽莉,等.不同品种禽类 ALV和REV感染情况调查[J].畜牧兽医学报,2013,44(12):1989-1993.
[14]王桂军,韦 平.鸡三种肿瘤病在广西的流行病学研究[J].中国家禽,2002,24(10):13-15.
[15]张青禅.A亚群禽白血病病毒不同分离株的基因组和生物学特性比较究[D].山东泰安:山东大学动物科技学院,2010.
[16]Smith E J,Williams S M,Fadly A M.Detection of avian leukosis virus subgroup J using the polymerase chain reaction[J].Avian Dis,1998,42(2):375-380.
[17]陈玉华.危害鸡免疫系统的四种病毒性疾病[J].动物医学进展,2013,34(2):108-113.

