抗帕金森病小分子药物的研究进展*
叶龙,宋磊,杨飞,张伟
(武汉科技大学化学系,武汉 430081)
·药学进展·
抗帕金森病小分子药物的研究进展*
叶龙,宋磊,杨飞,张伟
(武汉科技大学化学系,武汉 430081)
以近年来国内外研究文献为基础,对文献资料进行分析和总结的方法,依据药物的作用机制和疗效特点对目前临床上使用和在研的治疗帕金森病的小分子药物进行综述。研究人员根据不断了解的帕金森病的致病机制和新型靶标开发出许多新型的抗帕金森病候选药物,这些新型活性分子主要有具有神经元保护作用的多巴胺激动药、新型单胺氧化酶B抑制药、肾上腺素受体拮抗药、腺苷A2A受体拮抗药、C-氨基末端激酶抑制药、富亮氨酸重复激酶2抑制药、非甾体类雌激素β受体激动药、谷氨酸拮抗药、5-羟色胺激动药等。这些抗帕金森病新药和候选药物药理学特点表明靶标多元化、适应证广,不良反应小,能替代左旋多巴,可保护神经元细胞已成为重要研发抗帕金森病药物的发展趋势。
小分子药物;作用机制;药效特点;帕金森病
帕金森病(Parkinson's disease,PD)又称震颤麻痹(Paralysis agitans),是严重影响人类健康的第二大神经退行性疾病,人群中该病患病率约为 1.14%,>65岁老年人患病率可升高至2%,目前该病有向较年轻人群发展的趋势[1]。临床上使用和在研究的抗帕金森病药物有多种,研发人员主要针对帕金森病发病机制中起关键作用的不同靶标,研发具有特定作用机制的药物。由于帕金森病是多因素慢性疾病,不仅发病机制复杂,而且病理表现有多样性,针对帕金森病这种特点,市场上出现了多种不同的药物。笔者根据近年来文献报道,对目前临床上使用的药物及其带来的不良反应进行总结,并对在研的治疗帕金森病药物的作用机制和突出疗效特点进行简要介绍。
1 目前临床上使用的抗帕金森病化学药物及其不良反应
见表1。
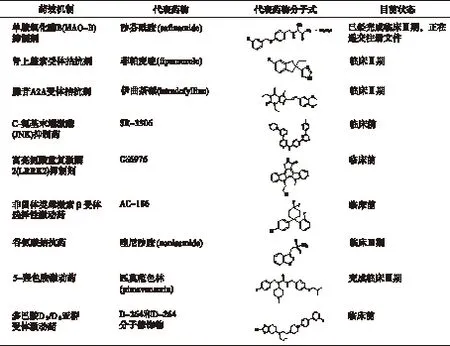
2 处于研发阶段的治疗帕金森病药物
基于目前市场上的多数药物可能有较大的不良反应,对某些帕金森病状,尤其是对晚期帕金森病疗效不理想,帕金森病研究人员正在积极研究对缓解更多病症及对晚期帕金森病有疗效的药物。见表2。
表1 临床上治疗帕金森病的化学药物及其不良反应
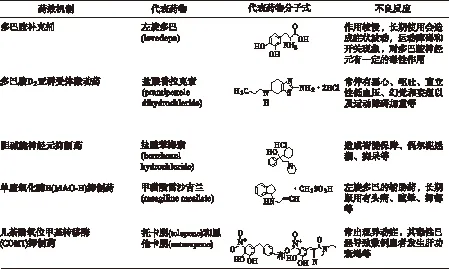
表2 处于研发阶段的治疗帕金森病候选药物
2.1 选择性单胺氧化酶B抑制药 沙芬酰胺(safinamide),化学名为 (S)-2-[4-(3-氟苄氧基)苄胺基]丙酰胺甲磺酸盐,是由Newron 制药公司所研发的抗帕金森病药物。这种药物具有多种作用机制,不仅能可逆性及高选择性抑制单胺氧化酶B(monoamine oxidase-B,MAO-B),而且还可以抑制多巴胺再摄取,调节钙通道,阻断电压依赖的钠通道,从而达到抑制谷氨酸释放。临床Ⅲ期试验中,在早期的帕金森病患者中随机的抽出一部分服用沙芬酰胺,一部分服用安慰药,结果表明沙芬酰胺(50~100 mg·d-1)能够显著改善运动症状、日常生活能力、认知能力[2]。在长期的双盲试验中证明了沙芬酰胺是非常安全的[3],而且在脑组织中的生物利用度很高,能够很好地防止帕金森病患者出现运动障碍,并且拥有良好的耐受性[4]。目前正在递交相关注册申请文件。
2.2 肾上腺素受体拮抗药 在用左旋多巴治疗帕金森病患者时,常会引起左旋多巴异动症,目前这种异动症很难治疗。菲帕麦唑(fipamezole)是一种新的非选择性α-肾上腺素受体拮抗药,对人体所有α-肾上腺素受体都表现出很强的拮抗作用。在一项179例受试者参加的试验中,时间为28 d,菲帕麦唑剂量为90 mg·d-1,研究者发现菲帕麦唑阻断突触前α-肾上腺素受体能有效减少左旋多巴引起的运动波动和异动症[5]。目前该药正处于临床Ⅱ阶段。
2.3 腺苷A2A受体拮抗药 腺苷A2A受体能够介导腺苷在人体很多组织中的相关调节作用,并且在纹状体中的表达水平也很高。腺苷A2A受体的拮抗药能够使纹状体-苍白球中的间接通路的活性降低,从而减轻帕金森病患者症状。伊曲茶碱(istradefylline)是一种新型的腺苷A2A受体拮抗药,可以通过改变神经元的活动达到改善帕金森患者的运动技能,在同样的帕金森病模型中,它与左旋多巴或D1和D2受体激动药联用,可以增强抗帕金森病的作用,尤其是和喹吡罗和左旋多巴联用,在猕猴帕金森病模型中,能够明显延长开期,缩短关期,而且安全性和耐受性良好。它也可以单纯用于治疗早期帕金森病症状,也可以治疗帕金森病患者的精神症状,如抑郁、焦虑等,还能够逆转抗精神病药物所引起的木僵[6]。目前该药正处于临床Ⅱ期阶段。
2.4 c-氨基末端激酶抑制药 目前科学上已经证实了c-氨基末端激酶(c-jun-N-terminal kinase,JNK)在神经元细胞的凋亡机制中具有重要作用。其已成为治疗诸如帕金森病等神经退行性疾病药物高度可行性靶标。2011年MARIE等[7]总结了已有JNK抑制药及其生物活性。见表3。
以JNK3为例,JNK3的异常活化可激活下游信号通路,导致多巴胺能神经元的死亡。抑制JNK3信号通路异常激活可以保护DA能神经元。JNK3激酶的作用机制如图1所示。据Science daily报道,美国佛罗里达州斯克里普斯研究所的科学家们发现了第一个已知可有效保护受帕金森病影响的脑细胞的化合物SR-3306。该新小分子化合物SR-3306可抑制JNK。2011年,CHAMBERS等[8]研究证明了SR-3306已经在细胞培养和动物模型中均可很好地阻止神经元破坏的进程,能够保护神经元细胞,有应用于治疗帕金森病的前景。目前尚处于临床前研究。
2.5 富亮氨酸重复激酶2抑制药 美国 CLINIC M的研究人员和欧洲研究小组人员对几个北美和欧洲家族的研究中发现:富亮氨酸重复激酶2(leucine-rich repeat kinase 2,LRRK2)基因的一个异常突变可以导致帕金森病。国内外关于LRRK2的致病机制研究主要集中于线粒体损伤机制、神经毒性机制和氧化应激等方面,这些都与LRRK2编码的功能性蛋白有着密切的关系。LRRK2的基因突变(图2)非常有可能引起它所编码的LRRK2蛋白功能改变,由于LRRK2在许多种神经细胞间信号传导过程中能够起到重要的整合作用,所以LRRK2基因结构的相关突变及有可能会干扰这些相关信号的正确传导,从而导致帕金森病及其他一些神经退行性疾病的发生。2012年KRAMER等[9]报道了目前研究的作用于LRRK2的抑制药,包括Staurosporine and Derivatives、Maleimide derivatives、5-Iodotubericidin、Sorafenib和Indolinone Dervivatives等,通过抑制LRRK2而达到治疗帕金森病的目的。目前尚处于临床前研究。
2.6 非甾体类雌激素β受体选择性激动药 2013年由MCFARLAND等[10]阐述了选择性非甾体类雌激素β受体激动药比目前使用的非选择性雌激素荷尔蒙替代治疗达到激活estrogen receptor β和estrogen receptor α更加的安全。在黑质纹状体系统,雌激素通过经典的ER途径及非受体途径发挥其对多巴胺能神经元的保护作用,达到治疗帕金森病的目的。并通过选择性非甾体类雌激素β受体激动药AC-186在帕金森病诱发的大鼠模型的结果,说明了选择性非甾体类雌激素β受体激动药的安全性很好这一优点。目前尚处于临床前研究。
2.7 谷氨酸拮抗药 唑尼沙胺(zonisamide)在临床Ⅲ期实验中,对使用左旋多巴反应不佳的帕金森病患者,主要是使用左旋多巴会有一个上调免疫和炎症的问题,免疫炎症会造成胶质细胞的活化,引起泌多巴胺细胞的衰亡,而唑尼沙胺可以抑制左旋多巴上调的免疫和炎症反应问题,阻止了泌多巴胺细胞的衰亡。在左旋多巴基础上加用唑尼沙胺,在临床Ⅲ期对早期的帕金森患者的双盲试验中,唑尼沙胺50 mg·d-1能够缩短1.3 h的治疗时间,唑尼沙胺100 mg·d-1能够缩短1.63 h的治疗时间[11]。在治疗帕金森病中有非常积极的作用,效果很好[12]。目前该药正处于临床Ⅲ期。

表3 ATP竞争性小分子JNK抑制药
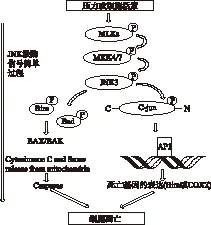
图1 JNK3激酶的作用机制
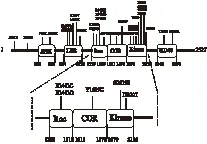
图2 常见的LRRK2突变位点
2.8 5-羟色胺激动药 据调查者表示,帕金森病精神症状增加疾病治疗的复杂性,并且增加发病率、痴呆率及死亡率。主要研究者CUMMINGS J研制的匹莫范色林(pimavanserin)在结束的临床Ⅲ期双盲实验中,证明了具有良好的抗精神病疗效和良好的耐受性。匹莫范色林通过阻断新皮质上血清素5-羟色胺2A受体从而发挥作用,新皮质主要负责感觉、语言的脑部区域,同时和视幻觉及错觉有关。开启了治疗帕金森病精神症状的新途径,由于其具有潜在的良好安全性,匹莫范色林可能有助于治疗帕金森病有精神症状的患者,协助阻止更多麻烦的症状进展,以及靶向于其他疾病的精神症状[13-14]。目前已完成临床Ⅲ期研究。
2.9 多巴胺D2/D3亚群受体激动药 2014年初由MODI等[15]报道了D-264和D-264分子修饰物在实验阶段对治疗帕金森病表现出很好的药效,同时具有神经保护作用。早期MODI和ANTONIO带领的团队合成的D-264在动物模型中,已经表现出很好的激动多巴胺D2/D3亚群受体,为了更好治疗帕金森病,他们在此基础上对D-264进行分子修饰,发现修饰后的分子作用效果更好,同时具有很强的耐受性。目前尚处于临床前研究。
3 结束语
经过多年的研发,已有众多抗帕金森病药在临床中使用,这些药物能在一定程度上治疗帕金森病。但是仍有许多治疗目标难以实现,包括神经保护、治疗运动并发症、治疗运动障碍、治疗精神病等。现有的药物(主要是L-多巴及其衍生物和它的一些辅助药物),虽能控制临床症状但不能控制疾病的发展,对病情只能有一定的延缓作用。新的分子靶点、新的动物模型、新的临床试验设计和生物标志物给未来研制出帕金森病治疗药物带来希望。人们发现许多在试验阶段有很好治疗效果和耐受性的药物,更为欣慰的是在试验阶段发现了具有神经保护作用(JNK抑制药)的药物。这些药物目前只是在试验阶段表现出很好的药效,若使之在临床使用中同样表现出良好的作用还需要付出更多的努力。
[1] 周红杰,蒋晓江,李玮,等.帕金森患者睡眠障碍临床特点及相关因素分析[J].重庆医学,2009,38(10):1163-1165.
[2] STOCCHI F,BORGOHAIN R,ONOFR J M,et al.A rando-mized,double-blind,placebo-controlled trial of safinamide as add-on therapy in early Parkinson's disease patients[J].Mov Disord,2012,27(1):106-112.
[3] SCHAPIRA A H,STOCCHI F,BORGOHAIN R,et al.Long-term efficacy and safety of safinamide as add-on therapy in early Parkinson's disease[J].Eur J Neurol,2013,20(2):271-280.
[4] 邢瑞娟,律涛,刘磊娜,等.沙芬酰胺的合成[J].中国医药工业杂志,2012,43(3):161-163.
[5] LEWITT P A,HAUSER R A,LU M,et al.Randomized cli-nical trial of fipamezole for dyskinesia in Parkinson disease (FJORD study)[J].Neurology,2012,79(2):163-169.
[6] MIZUNO Y,KONDO T.Adenosine A2A receptor antagonist istradefylline reduces daily OFF time in Parkinson's disease[J].Mov Disord,2013,28(8):1138-1141.
[7] MARIE A B,KEVIN R W N,TERESA T Z,et al.c-JunN-terminal kinase (JNK) signaling:recent advances and challenges[J].Biochim Biophys Acta,2010,1804(3):463-475.
[8] CHAMBERS J W,PACHORI A,HOWARD S,et al.Small molecule c-jun-N-Terminal kinase inhibitors protect dopaminergic neurons in a model of Parkinson's disease[J].ACS Chem Neurosci,2011,2(4):198-206.
[9] KRAMER T,MONTE F L,GORING S,et al.Small molecule kinase inhibitors for LRRK2 and their application to Parkinson's disease models[J].ACS Chem Neurosci,2012,3(3):151-160.
[10] MCFARLAND K,PRICE D L,DAVIS C N,et al.AC-186,a selective nonsteroidal estrogen receptor β agonist,shows gender specific neuroprotection in a Parkinson's disease rat model[J].ACS Chem Neurosci,2013,4(9):1249-1255.
[11]MURATA M,HORIUCHI E,KANAZAWA I.Zonisamide has beneficial effects on Parkinson's disease patients[J].Neurosci Res,2001,41(4):397-399.
[12] STOCCHI F.Therapy for Parkinson's disease:what is in the pipeline?[J].Neurotherapeutics,2014,11(1):24-33.
[13] ROBERTS C.ACP-103,a 5-HT2A receptor inverse agonist[J].Curr Opin Investig Drugs,2006,7(7):653-660.
[14] MELTZER H Y,MILLS R,REVELL S,et al.Pimavanserin,a serotonin(2A) receptor inverse agonist,for the treatment of Parkinson's disease psychosis[J].Neuropsycho-pharmacology,2010,35(4):881-892.
[15] MODI G,ANTONIO T,REITH M,et al.Structural modifica-tions of neuroprotective anti-Parkinsonian(-)-N6-(2-(4-(Biphenyl-4-yl)piperazin-1-yl)-ethyl)-N6-propyl-4,5,6,7-tetrahydrobenzo[d]thiazole-2,6-diamine (D-264):an effort toward the improvement ofinvivoefficacy of the parent molecule[J].J Med Chem,2014,57(4):1557-1572.
DOI 10.3870/yydb.2015.08.018
2014-09-04
2014-10-08
*湖北省自然科学基金资助项目(2015CFB490)
叶龙(1969-),男,湖北武汉人,教授,博士,从事有机合成方法学、药物化学、催化化学、绿色化学、组合化学等工作。电话:027-68862127,E-mail:yelong@wust.edu.cn。
R971.5;R746
A
1004-0781(2015)08-1055-05

