促血小板生成素对大鼠局灶性脑缺血-再灌注损伤后JAK2/STAT3信号通路的影响
邹成林,陈维钧,孙晓顺,方璟,涂军,赵亚洲
(湖北省荆州市第二人民医院内一科,荆州 434000)
促血小板生成素对大鼠局灶性脑缺血-再灌注损伤后JAK2/STAT3信号通路的影响
邹成林,陈维钧,孙晓顺,方璟,涂军,赵亚洲
(湖北省荆州市第二人民医院内一科,荆州 434000)
目的 探讨促血小板生成素(TPO)对大鼠脑缺血-再灌注损伤的保护作用及相关信号转导通路机制。方法 采用大脑中动脉线栓法制作大鼠局灶性脑缺血-再灌注损伤模型。将80只雄性SD大鼠随机分为4组,分别为假手术组、模型对照组、TPO组、TPO+蛋白质酪氨酸激酶抑制药(AG490)组。于缺血-再灌注前30 min,TPO组给予5 μg·kg-1TPO腹腔注射,TPO+ AG490组于缺血-再灌注前30 min先腹腔内注射5 μg·kg-1TPO,再给予8 μg·kg-1AG490腹腔注射,模型对照组给予等剂量0.9%氯化钠溶液。再灌注6,12,24,48 h后处死取脑组织、切片,进行苏木精-伊红染色、免疫组化染色、Western blotting和细胞凋亡检测。结果 与模型对照组比较,缺血-再灌注24 h后TPO组细胞凋亡数减少[(67.50±9.37)比(40.20±7.47)个],Bcl-2、蛋白质酪氨酸激酶2(JAK2)及信号转导和转录激活因子3(STAT3)蛋白表达水平升高,分别为(35.40±7.39)比(78.70±9.75),(35.68±6.75)比(62.35±7.53),(25.40±9.45)比(55.36±9.69),均差异有统计学意义(P<0.05)。与TPO组比较,TPO+AG490组Bcl-2、JAK2及STAT3蛋白表达水平降低,分别为(78.70±9.75)比(55.40±9.35),(62.35±7.53)比(40.68±5.89),(55.36±9.69)比(30.40±9.39),细胞凋亡数增多[(40.20±7.47)比(55.23±7.65)个],均差异有统计学意义(P<0.05)。结论 TPO可降低缺血-再灌注所诱导的细胞凋亡,其机制可能与激活JAK2/STAT3信号转导通路上调Bcl-2有关。
促血小板生成素;大鼠;损伤,缺血-再灌注;细胞凋亡;蛋白质酪氨酸激酶2与转导激活因子3;Bcl-2
蛋白质酪氨酸激酶2与转导激活因子3(Janus kinase 2 and signal transducer and activator of transcription 3,JAK2/STAT3)途径广泛参与细胞的增殖、分化、凋亡等过程。近年研究表明,JAK2/STAT3途径参与脑缺血的病理过程,但该途径的激活与缺血导致的神经细胞存活及凋亡之间的具体关系尚不十分清楚,对其在脑缺血中的作用结论不一。促血小板生成素(thrombopoietin,TPO)是重要的造血生长因子,主要调控巨核细胞的增殖和血小板生成,其通过与细胞膜上的TPO受体(TPO-R,C-mpl)结合,形成同源二聚体,激活与之结合的蛋白质酪氨酸激酶(Janus kinase 2,JAK2),引起受体胞内区酪氨酸残基的磷酸化,从而激活下游STAT、 磷脂酰肌醇3 激酶(phosphatidylinositol 3 kinase,PI3K)等多条信号转导通路。杨默等[1]首次证实神经系统中存在TPO受体(C-mpl),能促经神经细胞生长,对抗细胞凋亡。夏文杰等[2]在对体外TPO的神经保护作用的研究中发现TPO通过激活神经细胞PI3K/蛋白激酶B(protein kinase B,PKB)信号通路,拮抗细胞凋亡,具有保护神经祖细胞C17.2的作用。TPO是否通过激活JAK2/STAT3途径参与脑缺血的病理过程,其机制尚不十分明确。
1 材料与方法
1.1 动物 健康雄性斯泼累格·多雷(Sprague Dawley,SD)大鼠80只,体质量250~290 g,华中科技大学同济医学院实验动物中心提供,合格证号:4200600335,许可证号:SCXK[鄂]2011-0007,实验动物级别:SPF。动物以标准饲料喂养,自由摄食水,光照12 h,黑暗12 h,室温20~26 ℃条件下饲养1周后实验。
1.2 药品与试剂 磷酸化JAK2多克隆抗体(批号:K0303)、磷酸化STAT3单克隆抗体(批号:C1303)、小鼠抗Bcl-2单克隆抗体(一抗)(批号:G2804)均购自Santa Cruz,CA公司,辣根过氧化物酶标记的山羊抗兔/兔抗小鼠IgG及Western blotting检测试剂盒(美国Upstate Biotechnology,InC,批号:lotL1609),小鼠抗大鼠β-actin抗体(批号:20070711)、10%水合氯醛(批号:071219)、SABC试剂盒(批号:SA1025)、DAB显色剂(批号:41281194)均购自武汉博士德生物工程有限公司,原位末端转移酶标记技术(TdT-mediated dUTP nick end labeling,TUNEL)检测试剂盒(北京中杉公司,批号:10490800),重组人血小板生成素注射液(沈阳三生制药股份有限公司,批号:S20050049),蛋白质酪氨酸激酶2抑制药AG490(Janus kinase 2 inhibitor AG490,碧云天生物科技有限公司,批号:116K1482)。
1.3 主要仪器与设备 PE9700型PCR仪(美国PE公司),PowerPac型电泳仪(美国BioRad公司),DYCP-31B型琼脂糖水平电泳槽(北京六一仪器厂),2000型凝胶成像分析系统(东胜公司),CX31-72C02型实体显微镜(奥林巴斯),Metamorph Imaging SystemV4.6计算机图像分析软件(美国UIC公司)。
1.4 动物模型及制备 采用LONGA等[3]的大脑中动脉线栓法制备大鼠局灶性脑缺血-再灌注模型。按随机数字表法将大鼠分为假手术组、模型对照组、TPO组、TPO+AG490组(各20只),观察时间点为缺血-再灌注后6,12,24,48 h。于缺血-再灌注前30 min,TPO组给予TPO 5 μg·kg-1腹腔注射,TPO+ AG490组于缺血-再灌注前30 min先腹腔内注射TPO 5 μg·kg-1;再给予AG490 8 μg·kg-1腹腔注射;模型对照组给予等剂量0.9%氯化钠溶液;假手术组大鼠不进行缺血-再灌注处理。
1.5 免疫组化染色检测JAK2、STAT3及Bcl-2蛋白表达 4组大鼠至指定时间点处死后取脑组织,常规固定、石蜡包埋、切片,进行SABC法免疫组化染色。胞质有棕褐色颗粒者为阳性细胞。每张切片在缺血区随机计数5个高倍镜视野(×400)中的阳性细胞数,取平均值为JAK2、STAT3、Bcl-2阳性细胞数。
1.6 Western blotting法检测蛋白表达量 磷酸化JAK2、STAT3及Bcl-2蛋白表达Western blotting检测按照说明书操作。4组大鼠至指定时间点处死后取脑组织,在冰上分离缺血侧大脑组织,匀浆,提取蛋白,蛋白定量,用化学发光法记录结果。蛋白条带进行相对密度扫描并分析,计算各条带的灰度值,以内参照β-actin校正后的灰度值比值表示蛋白表达量。
1.7 TUNEL原位凋亡染色法检测细胞凋亡 按照原位TUNEL试剂盒说明书操作。结果判定:细胞核中有棕黄色颗粒者为阳性细胞。每张切片在缺血区随机计数5个高倍镜视野(×400)中的阳性细胞数,取平均值为该切片凋亡细胞数。

2 结果
2.1 脑组织苏木精-伊红(hematoxylin-eosin,HE)染色检查 模型对照组缺血2 h再灌注24 h后,大鼠缺血侧大脑半球明显肿胀,TPO组肿胀较轻。脑组织切片HE染色显示:假手术组皮质无坏死细胞,神经元数量多;模型对照组皮质缺血中心神经元数量稀疏,可见大量变性及坏死的神经细胞;TPO组缺血中心区变小,边缘区神经细胞变性坏死减少,多数存活细胞形态相对正常;TPO+AG490组缺血中心区较TPO组大,边缘坏死细胞多。
2.2 原位细胞凋亡检测 模型对照组缺血侧可见较多的阳性细胞,以缺血-再灌注24 h后最明显;假手术组偶见个别阳性细胞;TPO组及TPO+AG490组缺血区阳性细胞数目减少,与模型对照组比较差异有统计学意义(P<0.05);TPO+AG490组缺血区阳性细胞数目较TPO组增加,与TPO组比较差异有统计学意义(P<0.05)。见表1。
表1 4组大鼠缺血-再灌注24 h凋亡细胞数的比较
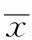
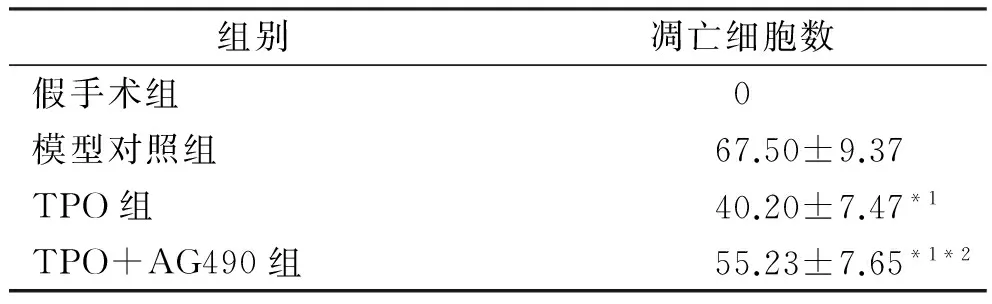
与模型对照组比较,*1P<0.05;与TPO组比较,*2P<0.05
Compared with model control group,*1P<0.05;compared with TPO group,*2P<0.05
2.3 脑组织免疫组化染色检测 阳性细胞主要分布在细胞质内,细胞质/胞膜有棕黄色物质沉积为阳性细胞。模型对照组大鼠缺血周边区可见较多阳性细胞表达,与假手术组相比,差异有统计学意义(P<0.05)。模型对照组、TPO组、TPO+AG490组大鼠再灌注6 h时Bcl-2、JAK2、STAT3表达增强,24 h达峰值,之后表达出现下降。与模型对照组比较,TPO组各时间点Bcl-2、JAK2、STAT3阳性细胞均明显增加,且差异有统计学意义(P<0.05)。与TPO组比较,TPO+ AG490组各时间点阳性细胞数减少,差异有统计学意义(P<0.05)。见表2。
2.4 脑缺血-再灌注损伤后脑组织P-JAK2、P-STAT3及Bcl-2 Western blotting检测 假手术组未见明显P-JAK2、P-STAT3、Bcl-2蛋白的表达,TPO组脑组织P-JAK2、P-STAT3、Bcl-2蛋白表达明显增多,24 h达峰值,之后表达出现下降,与模型对照组比较差异有统计学意义(P<0.05),TPO+AG490组P-JAK2、P-STAT3、Bcl-2蛋白的表达减少,与TPO组比较差异有统计学意义(P<0.05)。见表3,图1。
3 讨论
TPO是调节血小板和巨核细胞系最主要的造血生长因子[4]。研究发现,TPO不仅参与造血的调控,对神经系统也具有保护作用,它们通过动员骨髓的内源性干细胞,或通过其抗凋亡作用,在神经损伤中发挥一定的作用。TPO可通过减少基质金属蛋白酶9(Matrix Metallopeptidase 9,MMP-9)的表达保护大脑和改善感觉运动功能[5]。同时陈美苑等[6]发现,外源性TPO能够在脑缺血发生早期起到神经保护的作用,减轻缺氧缺血导致的脑功能损伤,但其机制尚不明确。本研究采用TUNEL法检测细胞凋亡发现,模型对照组缺血侧可见较多的阳性细胞,而TPO组缺血区阳性细胞数目减少,与模型对照组比较差异有统计学意义(P<0.05)。结果显示,TPO可能通过抑制细胞凋亡而减轻缺血-再灌注所致脑细胞损伤,但其是通过何种途径,目前尚不十分清楚。
表2 4组大鼠脑缺血-再灌注损伤后各时间点Bcl-2、JAK2、STAT3的表达
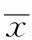

与模型对照组同时间点比较,*1P<0.05;与TPO组同时间点比较,*2P<0.05
Compared with model control group at same time point,*1P<0.05;compared with TPO group at same time point,*2P<0.05
表3 4组大鼠脑组织再灌注损伤后24 h P-JAK2、P-STAT3及Bcl-2蛋白相对表达量
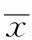
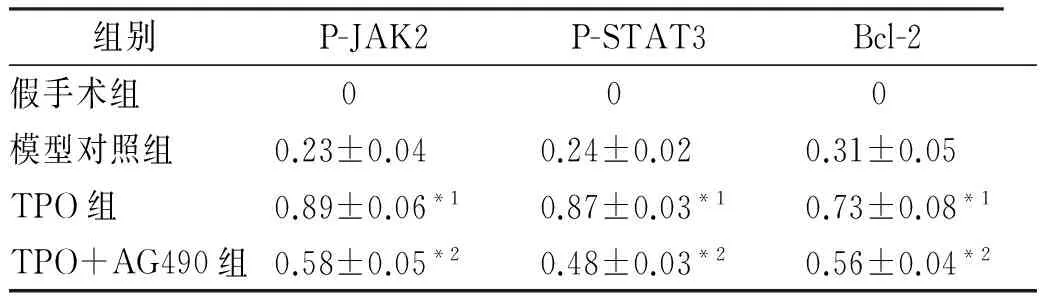
组别P-JAK2P-STAT3Bcl-2假手术组 0 0 0模型对照组0.23±0.040.24±0.020.31±0.05TPO组0.89±0.06*10.87±0.03*10.73±0.08*1TPO+AG490组0.58±0.05*20.48±0.03*20.56±0.04*2
与模型对照组比较,*P<0.05;与TPO组比较,*2P<0.05
Compared with model control group,*1P<0.05;compared with TPO group,*2P<0.05

A.假手术组;B.TPO组;C.TPO+AG490组;D.模型对照组
图1 4组大鼠脑组织再灌注损伤后24 h P-JAK2、P-STAT3及Bcl-2蛋白的表达Western blotting检测结果
A.sham operation group;B.TPO group;C.TPO and JAK kinase inhibitor (AG490) group;D.model control group
Fig.1 Western blotting analysis on the protein expression of P-JAK2, P-STAT3 and Bcl-2 among four groups of rats 24 hours after cerebral ischemia reperfusion
本研究通过免疫组化检测大鼠缺血侧皮层JAK2、STAT3蛋白的表达,结果显示,模型对照组、TPO组再灌注6 h时JAK2、STAT3表达增强,24 h达峰值,之后表达出现下降。同时本研究利用Western blotting方法检测,结果显示,在假手术组大鼠脑组织中未出现磷酸化JAK2及STAT3蛋白表达,脑缺血-再灌注损伤6 h缺血周边区脑组织有少量磷酸化JAK2及STAT3蛋白表达,24 h达峰值。这与免疫组化法检测JAK2及STAT3蛋白表达在时间动态变化上呈一致性,提示脑缺血后JAK2、STAT3表达及活化在缺血诱导的神经细胞死亡中起一定的作用。SUZUKI等[7]研究结果显示,大脑局部缺血-再灌注后缺血皮质及纹状体神经元可检测到磷酸化STAT3蛋白表达,且再灌注24 h磷酸化STAT3蛋白表达达峰值,此后随再灌注时间延长磷酸化STAT3蛋白表达渐减少。而WEN等[8]用免疫蛋白印迹法研究雄性黑鼠局灶性脑缺血损伤后磷酸化STAT3表达变化,结果显示,缺血周边区磷酸化STAT3蛋白在脑缺血6 h显著增加。这与本研究结果一致,但缺血-再灌注脑损伤引起JAK2/STAT3信号通路的激活对神经细胞的确切作用,目前还没有一致的说法。
BROWN等[9]研究显示在脑缺血后STAT1和STAT3表达上调,而在剔除STAT1基因后,则对脑缺血具有一定的保护作用。SATRIOTOMO等[10]研究显示,脑缺血-再灌注损伤后磷酸化JAK2和STAT3蛋白在缺血半暗带表达增强,并参与促进神经细胞的死亡,利用STAT3小分子干扰RNA(siRNA)或JAK2抑制药(AG490)能够抑制脑缺血后磷酸化JAK2和磷酸化STAT3的表达,从而减少神经细胞凋亡,缩小脑梗死范围。JUSTICIA等[11]也证实在脑卒中后JAK2/STAT3信号被激活,并参与神经损伤的病理过程,加重脑卒中后进一步的损伤。而BAKER等[12]在研究TPO对缺血-再灌注小鼠心肌的作用时发现,TPO对损伤的心肌细胞具有抗凋亡的保护作用,JAK2抑制药(AG490)能使该保护作用消失。YAMASHITA等[13]利用IL-6受体单克隆抗体阻断IL-6信号转导,结果显示,小鼠在缺血皮质半暗带磷酸化STAT3表达显著减少,神经凋亡细胞数明显增多,梗死面积增加,神经功能缺损恶化。
本研究通过免疫组化及Western blotting方法检测JAK2、STAT3、Bcl-2蛋白表达,与模型对照组比较,TPO组各时间点JAK2、STAT3及Bcl-2阳性细胞均明显增加,差异有统计学意义(P<0.05)。通过person相关分析发现TPO组Bcl-2蛋白表达与JAK2、STAT3蛋白表达在各时间点呈正相关,而当给予JAK2抑制药AG490后,JAK2、STAT3及Bcl-2蛋白表达减少,且细胞凋亡数增加,推测TPO可能通过激活JAK2/STAT3通路,上调Bcl-2而减少细胞凋亡。研究结果显示,缺血预处理可以通过JAK2/STAT3信号通路活化STAT3,上调抗凋亡基因Bcl-2,下凋促凋亡基因Bax,促进缺血后心肌收缩功能的恢复,减少心肌细胞凋亡和心肌梗死面积[14]。KANDA等[15]研究显示磷酸化STAT3(p-STAT3)可作用于细胞核内特异的DNA结合位点,直接或间接地上调抑制凋亡基因如Bcl-2、Bcl-XL等表达,从而调控细胞增殖和凋亡。
综上所述,TPO是否通过激活JAK2/STAT3途径,上调Bcl-2,减轻脑细胞凋亡,在脑缺血中与其他信号转导途径之间是否有交叉作用等均还未研究清楚,此外该途径与脑缺血后神经元发生和分化之间是否存在关联也有待进一步研究。
[1] 杨默,夏文杰,李桂霞,等.中枢神经系统表达TPO受体的初步研究[J].中国实验血液学杂志,2004,12(4):494-497.
[2] 夏文杰,项鹏,杨默,等.血小板生成素thrombopoietin对神经保护作用的体外研究[J].热带医学杂志,2007,7(7):622-625.
[3] LONGA E Z,WEINSTEIN P R,CARLSON S,et al.Rev-ersible middle cerebralartery occlusion without crainiectomy in rat [J].Stroke,1989,20(1):84-91.
[4] GEDDIS A E,LINDEN H M,KAUSHANSKY K.Thrombo-poietin:a pan-hematopoietic cytokine [J].Cytokine Growth Factor Rev,2002,13(1):61-73.
[5] ZHOU J,LI J,ROSENBAUM D M,et al.Thrombopoietin protects the brain and improves sensorimotor functions:reduction of stroke-induced MMP-9 upregulaion and blood-brain barrier injury [J].J Cereb Blood Flow Metab,2011,31(3):924-933.
[6] 陈美苑,刘青,曾志,等.TPO对新生大鼠缺血缺氧性脑损伤的保护作用[J].暨南大学学报(自然科学与医学版),2014,35(1):37-44.
[7] SUZUKI S,TANAKA K,NOGAWA S,et a1.Phosphory-lation of signal transducer and activator of transcription-3(State 3) after focal cerebral ischemia in rats [J].Exp Neurol,2001,170(1):63-71.
[8] WEN T C,PENG H,HATA R,et al.Induction of phos-phorylated of Stat 3 following focal cerebral ischemia in mice [J].Neurosci Lett,2001,303(3):153-156.
[9] BROWN S,ZEIDLER M P,HOMBRIA J E.JAK-STAT signaling in Drosophila controls cell motility during germ cell migration [J].Dev Dyn,2006,235(4):958-966.
[10] SATRIOTOMO I,BOWEN K K,VEMUQANTI R.JAK2 and STAT3 activation contributes to neuronal damage following transient focal cerebral ischemia [J].J Neurochem,2006,98(5):1353-1368.
[11] JUSTICIA C,GABRIEL C,PLANAS A M.Activation of the JAK/STAT pathway following transient focal cerebral ischemia:signaling through Jak1 and Stat3 in astrocytes [J].Glia,2000,30(3):253-270.
[12] BAKER J E,SU J,HSU A,et al.Human thrombopoietin reduces myocardial infarct size,apoptosis,and stunning following ischaemia/reperfusion in rats [J].Cardiovasc Res,2008,77(1):44-53.
[13] YAMASHITA T,SAWAMOTO K,SUZUKI S,et al.Block-ade of interleukin 6 signaling aggravates ischemic cerebral damage in mice:possible involvement of STAT3 activation in the protection of neurons [J].J Neurochem,2005,94(2):459-468.
[14] HATTORI R,MAULIK N,OTANI H,el a1.Role of STAT3 in ischemia preconditioning [J].J Mol Cell Cardiol,2001,33(1):1929-1936.
[15] KANDA N,SENO H,KONDA Y,et al.STAT3 is cons-titutively activated and supports cell survival in association with survivin expression in gastric cancer cells [J].Oncogene,2004,23(28):4921-4929.
DOI 10.3870/yydb.2015.08.008
Influence of Thrombopoietin on JAK2/STAT3 Signal Transduction Pathway in Focal Cerebral Ischemia-Reperfusion Injury of Rats
ZOU Chenglin, CHEN Weijun, SUN Xiaoshun, FANG Jing, TU Jun, ZHAO Yazhou
(DepartmentofInternalMedicine,theSecondPeople'sHospitalofJingzhou,HubeiProvince,Jingzhou434000,China)
Objective To investigate protective effects of thrombopoietin (TPO) on cerebral model control in rats and associated signal transduction pathway. Methods Thread embolism was performed to generate cerebral ischemia-reperfusion rat model.Eighty male SD rats were randomly divided into sham operation group, model control group, TPO group, TPO and Janus kinase inhibitor (AG490) group.Before 30 min of ischemia-reperfusion, TPO group was given TPO (5 μg·kg-1) by intraperitoneal injection, TPO + AG490 group was given TPO (5 μg·kg-1) before 30 min of ischemia reperfusion, then given AG490 (8 μg·kg-1), and model control group were given the same dose of 0.9% sodium chloride solution.The observation time points were 6, 12, 24, and 48 h after ischemia reperfusion.Immunohistochemical staining and Western blotting were used to measure the protein levels of Bcl-2, JAK2 and signal transducer & activator of transcription (STAT3).TdT-mediated dUTP nick end labeling (TUNEL) was used to detect apoptosis. Results Compared with model control group, the number of apoptotic cells were significantly reduced [(67.50±9.37)vs.(40.20±7.47)], the expression levels of Bcl-2, JAK2 and STAT3 protein were significantly increased [(35.40±7.39)vs.(78.70±9.75); (35.68±6.75)vs.(62.35±7.53); (25.40±9.45)vs.(55.36±9.69), respectively] 24 h after ischeia reperfusion in the TPO group (allP<0.05).Compared with the TPO group, the Bcl-2, JAK2 and STAT3 protein levels were significantly decreased in TPO and AG490 group [(78.70±9.75)vs.(55.40±9.35); (62.35±7.53)vs.(40.68±5.89); (55.36±9.69)vs.(30.40±9.39), respetively], and the number of apoptotic cells was significantly increased [(40.20±7.47)vs.(55.23±7.65)] (allP<0.05). Conclusion TPO can inhibit cell apoptosis after ischemia-reperfusion injury, the mechanism might be related to the activation of JAK2/STAT3 signal transduction pathway through raising the expression of Bcl-2 gene.
Thrombopoietin;Rats;Injury, ischemia-reperfusion;Apoptosis;Janus kinase 2/signal transducer and activator of transcription;Bcl-2
2014-07-25
2014-10-13
邹成林(1981-),湖北宜昌人,男,主治医师,硕士,研究方向:脑血管疾病发病机制及治疗。电话:0716-8223833,E-mail:38716711@qq.com。
R973.6; R965
A
1004-0781(2015)08-1019-05

