白藜芦醇对星形胶质细胞氧化损伤的保护作用*
王景,何超明
(海南省农垦三亚医院神经内科,三亚 572000)
白藜芦醇对星形胶质细胞氧化损伤的保护作用*
王景,何超明
(海南省农垦三亚医院神经内科,三亚 572000)
目的 探讨白藜芦醇(RES)对过氧化氢诱导星形胶质细胞氧化损伤的保护作用及其机制。方法 星形胶质细胞传代培养,随机分为阴性对照组(以正常培养液培养),模型对照组(100 μmol·L-1的过氧化氢作用12 h),RES小剂量组(20 μmol·L-1RES孵育24 h后,加入过氧化氢作用12 h)和RES大剂量组(40 μmol·L-1RES孵育24 h后,加入过氧化氢作用12 h)。采用MTT比色法测定细胞活力,流式细胞仪检测细胞凋亡率,Hochest33258染色观察凋亡细胞形态,比色法检测凋亡相关因子caspase-3及caspase-9的表达。结果 MTT结果显示5,10,20,40 μmol·L-1RES孵育24 h后细胞活性分别为(100.46±3.17)%,(101.33±3.14)%,(101.33±1.30)%,(99.67±2.62)%,与阴性对照组(98.33±2.13)%比较,差异无统计学意义(P>0.05)。表明RES对星形胶质细胞活性无影响。用20及40 μmol·L-1RES处理后,星形胶质细胞在过氧化氢作用12 h后引起损伤,其活性分别提高到(54.67±4.11)%和(70.33±2.61)%,与模型对照组比较,差异有统计学意义(t=3.59,7.13,P<0.01)。RES可以抑制过氧化氢诱导的细胞活性的下降。流式细胞计数结果显示用20,40 μmol·L-1RES处理后,星形胶质细胞凋亡率分别下降到(35.51±3.56)%和(14.12±3.19)%,与模型对照组(46.31±4.16)%比较,差异有统计学意义(t=4.26,6.33P<0.01)。Hochest33258染色结果显示RES可以抑制过氧化氢诱导的细胞凋亡。此外,RES还可以减少过氧化氢所致星形胶质细胞内caspase-3及caspase-9的表达,并且伴随RES作用时间的延长其表达量呈下降趋势。结论 RES通过抑制caspase-3及caspase-9的表达有效抑制了过氧化氢对星形胶质细胞的损伤,从而为其用于治疗中枢神经疾病提供实验依据。
白藜芦醇;星形胶质细胞;氧化损伤
许多神经性疾病的发病机制都与氧化应激密切相关[1]。星形胶质细胞(astrocytes)对维持神经系统正常功能具有重要作用。该细胞受到氧化损伤后会触发一系列改变,进而影响其发挥保护作用,从而成为神经损伤发展过程中的促进因素[2]。白黎芦醇(resveratrol,RES),化学名为为(E)-5-[2-(4-羟苯基)-乙烯基]-1,3-苯二酚;3,4',5-三羟基芪(3,4',5-trihydrolystil-bene),为脂溶性抗氧化剂,广泛存在于多种食用及药用植物中,具有抗炎、抗菌、抗氧化、调节血脂、抗癌等多种功效[3]。近年来已有研究表明,天然RES有较强的抗氧化活性,有学者通过体外实验发现,RES可以有效地清除氧自由基,它对过氧化氢(H2O2)清除能力强于玉米黄质及角黄质[4]。但是否对星形胶质细胞具有保护作用尚不清楚。笔者在本实验中通过体外培养星形胶质细胞,利用H2O2诱导星形胶质细胞损伤模型,探讨RES对星形胶质细胞氧化损伤的预防作用及其可能的作用机制。
1 材料与方法
1.1 动物 取出生2 d内的健康清洁级斯泼累格·多雷(Sprague Dawley,SD) 乳鼠(中国医学科学院实验动物研究所动物资源中心提供,生产许可证号:中科动管第003号,动物使用合格证号:0127011),体质量20~25 g,饲养于海南医学院动物实验中心,饲养条件:相对湿度50%,温度22 ℃,昼夜明暗交替时间12 h:12 h,常规配方饲料喂养,自由进食。
1.2 试剂 RES(Sigma公司,含量:>95%,批号:111535) 用0.2%二甲亚砜(dimethylsulfoxide,DMSO,上海生物工程有限公司,批号:D5879)溶解后分别配成溶液4 ℃保存待用,H2O2购自Sigma公司并在使用前用去离子水液配成100 μmol·L-1,胎牛血清(杭州四季青生物公司,批号:HB0205),达尔伯克改良伊格尔培养基(Dulbecco's modified Eagle's medium,DMEM,美国GIBCO公司,批号:31600034),噻唑蓝(methyl thiazolyl tetrazolium,MTT)、Hoechst33258试剂盒(碧云天上海生物技术有限公司,批号:C0009,C1011),Annexin V FITC/PI(美国BD公司,批号:556547),caspase-3、caspase-9试剂盒(南京建成生物工程研究所,批号:G007,G009)。
1.3 仪器 酶标仪(上海雷勃分析仪器有限公司,型号:MK3),流式细胞仪(美国B-D FACScan,型号:FACSCalibur)。
1.4 星形胶质细胞的分离和培养 剥离乳鼠大脑并剪碎脑皮质,剔除脑膜、血管,用DMEM培养液充分冲洗3次,过滤去除组织块,37 ℃下胰酶消化10 min,用含10%胎牛血清的DMEM培养液终止消化,吹打分散细胞,以1.0×106·mL-1细胞密度接种于细胞培养瓶,培养11 d后去培养液,用无菌磷酸盐缓冲液(phosphate buffered solution,PBS)洗涤3次后用0.25%胰蛋白酶消化,1 000 r·min-1(r=6 cm)离心5 min,去上清液后进行传代培养,传至第3代即得纯化的星形胶质细胞。
1.5 RES对星形胶质细胞活力的影响 为了检测RES对星形胶质细胞活性是否存在潜在影响,先进行不同浓度RES对星形胶质细胞活力影响的检测。星形胶质细胞接种于96孔培养板(细胞密度5×104·L-1,每孔120 μL)培养24 h后,共分5组,每组18孔,分别加入0,5,10,20,40 μmol·L-1RES,继续孵育24 h,MTT法测定细胞活力。具体方法如下:向各孔细胞中加入MTT 20 μL(5 g·L-1),培养4 h后弃去培养液,加入DMSO溶液150 μL,室温下微量振荡器振荡10 min,然后用酶标仪测定492 nm的吸光度,按下式求得星形胶质细胞的存活率:存活率(%)=(各组细胞吸光度值/阴性对照组细胞吸光度值)×100%。
1.6 细胞分组 星形胶质细胞接种于96孔培养板后,根据SPSS11.5版统计软件产生的随机数字分为以下4组,每组24孔。阴性对照组:以正常培养液培养;模型对照组:除上述培养液以外,加入100 μmol·L-1的H2O2,制备氧化损伤模型;RES小剂量组:20 μmol·L-1RES孵育24 h后,加入H2O2作用12 h;RES大剂量组:40 μmol·L-1RES孵育24 h后,加入H2O2作用12 h。对培养和处理的细胞用MTT法检测细胞活力(具体方法同“1.5”项下)。
1.7 细胞凋亡检测 各组星形胶质细胞接种于6孔板,经过相应处理后于12 h后进行检测。具体操作如下:用0.1%胰酶消化并收集细胞,制备细胞悬液,1 000 r·min-1离心(r=6 cm)弃上清液,洗涤收集细胞,在冰浴中避光进行下述操作:用Annexin V-FITC试剂盒中缓冲液悬浮细胞,调节细胞浓度为5×104·L-1,取上述细胞分别按试剂盒说明,加入膜联蛋白A5和碘化丙啶,混匀后孵育20 min,于1 h内用流式细胞仪检测细胞凋亡。
1.8 Hoechst33258染色观察凋亡细胞形态 细胞接种于6孔板中,各实验组按要求给予不同因素处理后吸尽培养液,PBS洗3次,每次2 min,用固定液固定20 min后去固定液,PBS洗2次后加入染色液在暗处染色20 min,吸掉染色液后PBS洗2次置于倒置显微镜下观察细胞形态。
1.9 caspase活性检测 20,40 μmol·L-1RES预处理细胞12,24,48 h后,H2O2作用12 h,用0.1%胰酶消化后,1 200 r·min-1(r=6 cm)离心12 min,弃上清液,收集细胞并用PBS冲洗2次,每份样品加30 μL细胞裂解液,冰上孵育20 min,10 000 r·min-1(r=6 cm)离心10 min,进行caspase活性检测。caspase活性=A405 nm/A595 nm。检测方法和所用试剂均按南京建成生物工程研究所生产的试剂盒进行。

2 结果
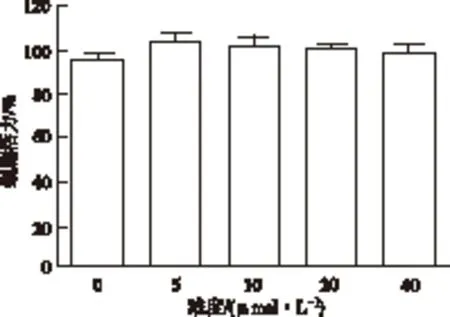
2.1 不同浓度RES对星形胶质细胞活性的影响 5,10,20,40 μmol·L-1RES孵育24 h后细胞活性分别为(100.46±3.17)%,(101.33±3.14)%,(101.33±1.30)%,(99.67±2.62)%,与阴性对照组(98.33±2.13) %比较,差异无统计学意义(P>0.05)。见图1。


2.2 RES对H2O2致星形胶质细胞氧化损伤的影响 模型对照组星形胶质细胞经H2O2处理后,细胞活性下降(32.67 ± 3.81) %,与阴性对照组比较差异有统计学意义(t=10.58,P<0.01)。用20及40 μmol·L-1RES处理后,星形胶质细胞活性分别提高到(54.67±4.11)%和(70.33±2.61)%,与模型对照组比较差异有统计学意义(t=3.59,7.13,P<0.05和P<0.01)。见图2。
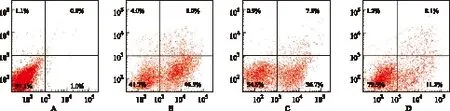
2.3 RES对氧化损伤致星形胶质细胞凋亡的抑制作用 星形胶质细胞经氧化损伤处理后,细胞凋亡率明显升高,平均凋亡率(46.31±4.16)%,与阴性对照组(1.39±0.54) %比较差异有统计学意义(t=13.29,P<0.01)。用20,40 μmol·L-1RES处理后,星形胶质细胞凋亡率分别下降到(35.51±3.56)%和(14.12%±3.19)%,与模型对照组比较,差异有统计学意义(t=4.26,6.33,P<0.01)。实验结果表明H2O2可以导致星形胶质细胞凋亡,经20及40 μmol·L-1RES处理后,其凋亡率呈下降趋势。见图3。
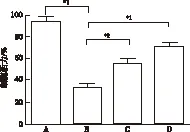
A.阴性对照组;B.模型对照组;C.RES小剂量组;D.RES大剂量组;与模型对照组比较,*1P<0.01,*2P<0.05
A.negative control group;B.model control group;C.low-dose RES group; D.high-dose RES group;compared with model control group,*1P<0.01,*2P<0.05
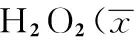
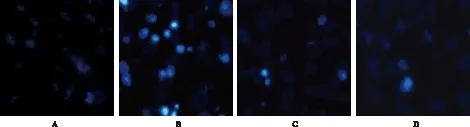
2.4 RES对H2O2诱导星形胶质细胞凋亡的影响 Hoechst33258核染色法检测结果显示,与阴性对照组比较,模型对照组星形胶质细胞经过100 μmol·L-1H2O2处理12 h后,凋亡明显增多,染色质固缩,细胞核呈致密浓染,荧光较强。与模型对照组比较,RES作用后凋亡细胞减少且细胞核形态改善,荧光强度减弱。见图4。
2.5 RES对H2O2致星形胶质细胞氧化损伤caspase-3、caspase-9活性的影响 模型对照组星形胶质细胞内caspase-3、caspase-9活性明显增加,与相同作用时间点的阴性对照组比较差异具有统计学意义(P<0.05)。20及40 μmol·L-1RES处理后,可见caspase-3、caspase-9表达量下降,且呈时间依赖性,与相同作用时间点的模型对照组比较差异有统计学意义(P<0.05)。见表1。
3 讨论
RES作为一种天然活性成分,主要存在于花生、豆科、葡萄皮、蓼科、百合科和多种药用植物中,是一种具备抗氧化、抗癌、抗炎等作用的多酚类化合物[4-5]。笔者将不同浓度RES作用于星形胶质细胞,发现其对细胞并无损伤作用。正常星形胶质细胞给予H2O2处理后,细胞凋亡率明显上升,说明氧化损伤可以诱导细胞凋亡的发生。而给予不同剂量的RES后,凋亡受到抑制,而且这种药物对细胞的保护作用呈剂量依赖性,进而证实RES可以在一定程度上能够抑制H2O2诱导的细胞凋亡。
A.阴性对照组;B.模型对照组;C.RES小剂量组;D.RES大剂量组
A.阴性对照组;B.模型对照组;C.RES小剂量组;D.RES大剂量组
Tab.1 Content of caspase-3 and caspase-9 in four groups of astrocytes
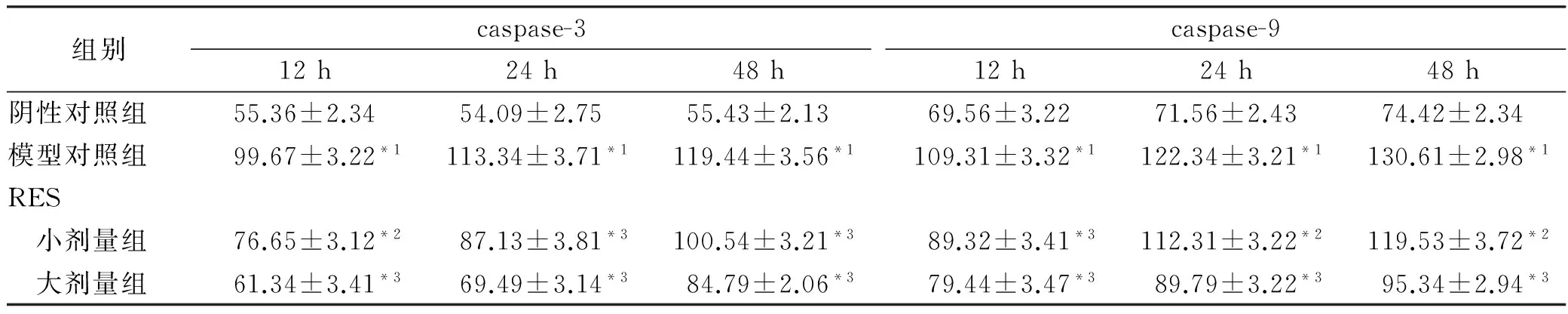
组别caspase-312h24h48hcaspase-912h24h48h阴性对照组55.36±2.3454.09±2.7555.43±2.1369.56±3.2271.56±2.4374.42±2.34模型对照组99.67±3.22*1113.34±3.71*1119.44±3.56*1109.31±3.32*1122.34±3.21*1130.61±2.98*1RES 小剂量组76.65±3.12*287.13±3.81*3100.54±3.21*389.32±3.41*3112.31±3.22*2119.53±3.72*2 大剂量组61.34±3.41*369.49±3.14*384.79±2.06*379.44±3.47*389.79±3.22*395.34±2.94*3
与阴性对照组比较,*1P<0.01;与模型对照组比较,*2P<0.05,*3P<0.01
Compared with negative control group,*1P<0.05;compared with model control group,*2P<0.05,*3P<0.01
细胞的氧化损伤在神经系统疾病的发生发展过程中起着重要的作用。而氧自由基对星形胶质细胞的损伤作用已日渐引起广泛重视[6]。活性氧是人体内最重要的自由基,活性氧过多可致蛋白质、核酸等生物大分子氧化损伤,当氧化损伤产生大量的自由基时,很容易诱发细胞凋亡,从而引起疾病的发生。H2O2是一种极易透过细胞膜的强氧化剂,通过增加细胞内活性氧含量发挥对细胞的氧化损伤作用[7-9]。本实验以活性氧形式之一的H2O2作用于星形胶质细胞,造成星形胶质细胞氧化损伤,研究RES对该细胞的保护作用。
凋亡是存在于生命体内的一种基本的生物学现象,它在生物体正常生理活动中可去除不需要的或异常的细胞,对生物体内环境的稳定以及多个系统的发育起着重要作用。caspases蛋白酶家族参与该机制并发挥着重要作用[10-11]。虽然氧化应激引起星形胶质细胞凋亡的具体机制至今仍不清楚,但多个研究显示caspase家族在其中起着重要的作用,caspase蛋白酶家族是细胞凋亡下游的关键酶,细胞凋亡的诱导实质上是通过caspase蛋白的次序激活来实现的[12]。研究表明,氧化损伤可以激活线粒体信号通路,触发caspase的级联反应。而caspase-3和caspase-9是细胞凋亡的必经之路。有实验证实,过氧化氢损伤可以使星形胶质细胞凋亡过程中caspase-3及caspase-9的活性明显增强[13]。本实验结果显示,模型对照组星形胶质细胞内caspase-3及caspase-9的表达均增加,提示caspases参与氧化损伤的病理生理过程,是星形胶质细胞凋亡的重要调控因子。用RES处理后caspase-3及caspase-9的活性显著下降,其下降趋势与RES的剂量和作用时间正相关,提示caspases参与氧化损伤的病理生理过程,是星形胶质细胞凋亡的重要调控因子。
综上所述,本研究证实RES可以明显抑制星形胶质细胞凋亡,其抑制凋亡的作用可能是其防止和延缓神经系统相关疾病发生、发展的细胞学基础,从而为寻求有效的防治神经系统损伤药物提供实验依据。
[1] 张春阳,卫涛涛,马辉,等.活性氧参与一氧化氮诱导的神经细胞凋亡[J].生物化学与生物物理进展,2001,28(1):81-85.
[2] 邱晶,高静,熊御云,等.嗅鞘细胞上清液对抗过氧化氢诱导的星形胶质细胞损伤的线粒体机制[J].江苏大学学报(医学版),2012,22(1):38-42.
[3] WENG C J,YANG Y T,HO C T,et al.Mechanisms of apoptotic effects induced by resveratrol,dibenzoylmethane,and their analogues on human lung carcinoma cells[J].J Agric Food Chem,2009,57(12):5235-5243.
[4] 程霜,郭长江.白藜芦醇抗肿瘤作用机制研究进展[J].疾病控制杂志,2005,9(3):257-260.
[5] 刘芝兰,曾春娇,吴梅青,等.白藜芦醇与白皮杉醇及赤松素研究进展[J].医药导报,2013,32(8):1043-1049.
[6] O'CONNOR I,O'BRIEN N.Modulation of UVA light-induced oxidative stress by beta-carotene,lutein and astaxanthin in cultured fibroblasts[J].J Dermatol Sci 1998,16(3):226-230.
[7] KAMAT C D,GADAL S,MHATRE M,et al.Antioxidants in cen-tral nervous system diseases:preclinical promise and translational challenges[J].J Alzheimers Dis,2008,15(3):473-493.
[8] 贺芳,刘晓梅,何叶成,等.肝细胞生长因子对体外缺血/再灌注星形胶质细胞氧化应激的影响[J].暨南大学学报:自然科学与医学版,2014,35(3):279-285.
[9] 冯洁,裴保香.复方丹参滴丸对过氧化氢损伤 PC12细胞的保护作用[J].医药导报,2008,27 (2):159-161.
[10] 吴云飞,郑维银,李焰.caspase-3在血管内皮细胞凋亡中的作用研究进展[J].西南军医,2013,15(4) :408-411.
[11] AKASAKA Y,ISHIKAWA Y,ONO I,et al.Enhanced exp-ression of caspase-3 in hypertrophic scars and keloid:induction of caspase-3 and apoptosish in keloid fibroblasts in vitro[J].Lab Invest,2000,80(3):354-357.
[12] 薛瑞,王明仲,洪学军,等.原花青素通过caspase途径诱导乳腺癌MCF-7细胞凋亡[J].实用药物与临床,2013,16(1):15-17.
[13] SHINOURA N,MURAMATSU Y,YOSHIDA Y,et al.Ade-novirus-mediated transfer of caspase-3 with Fas ligand induces drastic apoptosis in U-373 MG glioma cells[J].Exp Cell Res,2000,256(2):423-433.
DOI 10.3870/yydb.2015.08.004
Protective Effect of Resveratrol on Oxidative Injury in Astrocytes
WANG Jing, HE Chaoming
(DepartmentofNeurology,NongkenSanyaHospital,HainanProvince,Sanya572000,China)
Objective To investigate the protective effect of resveratrol (RES) against hydrogen peroxide (H2O2)-induced oxidative injury to astrocytes and the related mechanism. Methods Subcultured astrocytes were randomly divided into four groups: negative control group (treated with normal culture medium), model control group (treated with 100 μmol·L-1H2O2for 12 h), resveratrol low dose group (treated with 20 μmol·L-1RES for 24 h H2O2for 12 h) and resveratrol high dose group (treated with 40 μmol·L-1RES for 24 h before H2O2for 12 h).Cell viability was detected by MTT assay, apoptosis rate was detected by flow cytometry, apoptotic cell morphology was detected by hochest33258 staining, and the expression of apoptosis-related factors such as caspase-3 and caspase-9 were measured by colorimetric detection. Results MTT assay showed that after treatment with 5, 10, 20, and 40 μmol·L-1RES for 24 h, cell viability was (100.46±3.17)%, (101.33±3.14)%, (101.33±1.30)%, and (99.67±2.62)%, respectively, and the difference was not statistically significant compared with the negative control group [(98.33±2.13)%,P>0.05].RES showed no effect on astrocyte activity. After treatment with 20 and 40 μmol·L-1RES, astrocyte activity was significantly elevated to (54.67±4.11)% and (70.33±2.61)% compared with model control group (t=3.59, 7.13,P<0.05), RES inhibited hydrogen peroxide-induced decrease in cell viability.Flow cytometry results showed that after treatment with 20, 40 μmol·L-1RES, the apoptosis rate of astrocytes significantly decreased to (35.51±3.56)% and (14.12%±3.19)% (t=4.26, 6.33,P<0.01) compared with model control group (46.31±4.16)%.Hochest 33258 staining showed that RES inhibited hydrogen peroxide-induced cell apoptosis, besides, the RES treatment also could reduce H2O2-induced expression of caspase-3 and caspase-9 in astrocytesin a time-dependent manner. Conclusion RES can inhibit hydrogen peroxide-induced astrocytes apoptosis through inhibiting the expression of caspase-3 and caspase-9, which can provide experimental evidence for its treatment of central nervous disorders.
Resveratrol;Astrocytes;Oxidative damage
2014-07-14
2014-10-15
*三亚市医疗卫生科技创新项目(YW1216)
王景(1981-),女,海南三亚人,主治医师,学士,研究方向:神经内科。电话:(0)13895757226,E-mail:bee21212@163.com。
何超明(1970-),男,海南三亚人,主任医师,学士,研究方向:神经内科。电话:(0)13697558895,E-mail:chen7707177@163.com。
R286;R285.5
A
1004-0781(2015)08-1002-05

