乙酰半胱氨酸颗粒在健康人体的生物等效性研究
李杰,刘明周,黎维勇,贾萌萌,周颖,李虎群
(1.华中科技大学同济医学院附属协和医院药剂科,武汉 430022;2.武汉大学基础医学院,武汉 430071)
乙酰半胱氨酸颗粒在健康人体的生物等效性研究
李杰1,刘明周2,黎维勇1,贾萌萌1,周颖1,李虎群1
(1.华中科技大学同济医学院附属协和医院药剂科,武汉 430022;2.武汉大学基础医学院,武汉 430071)
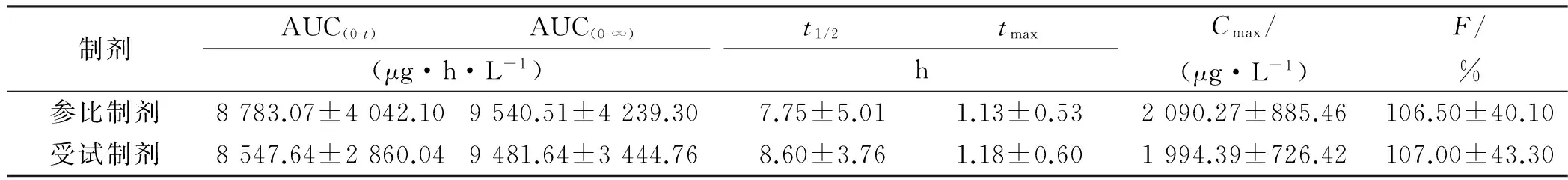
目的 建立人血浆乙酰半胱氨酸浓度测定方法,研究乙酰半胱氨酸颗粒在健康人体内的相对生物利用度与生物等效性。 方法 采用二制剂三周期自身对照完全三交叉试验设计,其中每位受试者有一周期不服药,健康男性受试者24例分别单剂量口服乙酰半胱氨酸受试制剂或参比制剂0.6 g。高效液相色谱串联质谱法测定血浆乙酰半胱氨酸浓度,应用DAS 3.0版统计软件计算药动学参数并评价两种制剂生物等效性。结果 单剂量口服乙酰半胱氨酸颗粒受试制剂和参比制剂0.6 g的主要药动学参数:AUC0→t分别为(8 547.64±2 860.04)和(8 783.07±4 042.10) μg·h·L-1;AUC0→∞分别为(9 481.64±3 444.76)和(9 540.51±4 239.30) μg·h·L-1;Cmax分别为(1 994.39±726.42)和(2 090.27±885.46) μg·L-1;tmax分别为(1.18±0.60)和(1.13±0.53) h;t1/2分别为(8.60±3.76)和(7.75±5.01) h;相对生物利用度以AUC0→t和AUC0→∞计算分别为(107.00±43.30)%和(106.50±40.10)%。结论 乙酰半胱氨酸颗粒两种制剂具有生物等效性。
乙酰半胱氨酸颗粒;生物利用度,相对;生物等效性;液相色谱串联质谱法
N-乙酰半胱氨酸(N-acetylcysteine,以下简称NAC)是L-半胱氨酸乙酰化后的产物,它通过分解黏蛋白复合物、核酸,将痰中的脓性成分及其他黏液分泌物从黏稠变为稀薄而发挥黏液溶解作用[1]。作为一种非处方药,乙酰半胱氨酸临床主要作为黏痰溶解药,适用于手术后、急性和慢性支气管炎、支气管扩张、肺结核、肺炎、肺气肿等引起的黏稠分泌物过多所致的咯痰困难[2]。笔者在本实验中建立了灵敏准确的高效液相串联质谱方法(liquidchromatography-tandemmassspectrometry,LC-MS/MS)以氘代乙酰半胱氨酸(d3-N-acetylcy-steine,以下简称d3-NAC)为内标测定人血浆中的乙酰半胱氨酸,评价乙酰半胱氨酸颗粒受试制剂及参比制剂的生物利用度及生物等效性,为考核受试制剂的药品质量提供科学依据。
1 仪器与试药
1.1 仪器LC-MS/MS仪器:包括Agilent1200型高效液相色谱仪(含四元梯度泵、在线脱气机、自动进样器、柱温箱,美国Agilent公司);API4000型三重四极杆串联质谱仪(配备电喷雾离子源,美国AppliedBiosystemSciex公司)。数据处理系统为Analyst1.5.2。
1.2 药品与试剂 乙酰半胱氨酸颗粒受试制剂(批号:120302,规格:每袋0.1g,桂林华信制药有限公司);乙酰半胱氨酸颗粒参比制剂(商品名:富露施®,海南赞邦制药有限公司,规格:每袋0.1g,批号:C1311K12)。NAC标准品(批号:140671-200501,含量:100%,中国食品药品检定研究院);d3-NAC标准品(内标,批号:1-JUZ-124-3,含量:97%,TorontoResearchChemicalsInc.);二硫代苏糖醇(以下简称DTT,批号:YY11175,含量>99%,上海原叶生物科技有限公司)。
1.3 色谱条件与质谱条件
1.3.1 色谱条件 色谱柱:Polar-RPC18(2.1mm×100mm,5μm;WelchMaterialInc.);预柱:PhenomenesSecurityGuardTMC18(4mm×3.0mm,5μm);流动相:0.1%甲酸水溶液-乙腈=16:84;流速为0.3mL·min-1;柱温为40 ℃;进样体积为5μL。
1.3.2 质谱条件 选用电喷雾离子化源,在正离子电离模式下,采用多反应监测的质谱扫描方式,测定NAC和内标的检测离子分别为:m/z 163.9→122.0和m/z157.0→123.0。
1.4 溶液配制
1.4.1 对照品工作液的配制 精密称取NAC标准品适量,以50%甲醇溶解,定量配制成100.0,500.0,1 000.0,3 000.0,10 000.0,25 000.0,50 000.0μg·L-1NAC标准工作溶液及浓度为300.0,5 000.0,40 000.0μg·L-1NAC质控工作溶液,置-20 ℃冰箱,待用。
1.4.2 内标工作液的配制 精密称取d3-NAC标准品适量,给予50%甲醇溶解,定量配制成浓度为1.00mg·L-1的内标工作液,置-20 ℃冰箱,待用。
1.4.3DTT溶液的配制 精密称取DTT标准品适量,以50%甲醇溶解,定量配制成浓度为46.28g·L-1的DTT溶液,置-20 ℃冰箱,待用。
1.5 血浆样品处理 精密取血浆200μL至2mL离心管中,加入30μL内标工作液液及50μL,46.28g·L-1DTT溶液,混匀,放置5min,加400μL甲醇沉淀蛋白,涡旋混匀1min,于15 000r·min-1(r=3cm)、4 ℃离心5min,取上清液100μL至2mL离心管中,加入0.05%甲酸-溶液200μL,混匀,取5μL进样测定,记录色谱图。
1.6 临床试验
1.6.1 受试者选择 按照《药物临床试验管理规范(GCP)指导原则》设计试验方案,并获得华中科技大学同济医学院医学伦理委员会批准招募健康男性受试者,最终24例健康男性受试者参加了本次试验。年龄(24.67±3.27)岁,体重指数(21.40±1.39)kg·(m2)-1,体检证明心、肺、肝、肾功能正常。受试者试验开始前两周及试验期间未服用其他药物,无药物滥用史及烟酒嗜好,自愿参加试验并签署知情同意书。
1.6.2 给药方案与样品采集NAC为内源性生理活性物质,在对血样进行定量分析时采用了基线扣除法,即将测得的内源性和外源性化合物的总量减去未给药时测得的内源性化合物的量。为此本次研究采用二制剂三交叉试验设计,每名受试者均有一周期不服药而仅采集空白血样,洗净期为7d,每周期均在固定时间给药采血以排除生理节律对内源性NAC的影响。乙酰半胱氨酸颗粒最大临床使用剂量为每次0.6g,每日1或2次[3-4]。由于NAC为内源性物质,本底浓度为20~30μg·L-1,鉴于本品消除快,若服用剂量较低,则吸收相早期和消除相末期的血样点的血药浓度可能接近本底浓度而出现误差;且Ⅰ期临床药代显示NAC口服制剂在剂量范围200~3 200mg·(m2)-1呈线性药代特征[5-6]。为准确检测血药浓度,科学评价生物等效性,选用单次服用0.6g作为本次生物等效性试验的服用剂量。24例健康男性受试者随机分为3组,每组8例,分别一次口服乙酰半胱氨酸颗粒受试制剂(A)、参比制剂(B) 或不服药(C),两次间隔7d。受试者试验前禁食12h,不禁水,于次日晨空腹口服受试制剂、参比制剂0.6g或不服药,2h后方可饮水,4h后统一进食低脂清淡饮食。于服药前(0h)及服药后10,20min,0.5,0.75,1.0,1.5,2.0,3.0,4.0,6.0,8.0,10.0,12.0,24.0h自肘静脉采血3mL,置肝素化试管内,离心[3 500r·min-1(r=3cm),4 ℃,5min]分离血浆,置-70 ℃冰箱,待测。
1.7 统计学方法 采用DAS3.0版软件计算和统计药动学参数,统计分析先将浓度-时间曲线下面积(AUC)和峰浓度(Cmax)数据进行对数转换,然后进行方差分析与双单侧t检验处理,达峰时间(tmax)用非参数法进行检验,评价受试与参比制剂的生物等效性。
2 结果
2.1 方法学确证结果
2.1.1 特异性 在本试验所采用的色谱与质谱条件下,分别测定受试者空白血浆、空白血浆中加入NAC对照品溶液及内标d3-NAC溶液、受试者服药后2h血样。结果如图1所示,NAC及内标保留时间分别为1.64,1.63min,血浆中内源性物质NAC对药源性NAC的测定产生了一定的干扰,因此在评价乙酰半胱氨酸两种制剂的生物等效性时应扣除内源性NAC的干扰。
2.1.2 标准曲线及定量下限 精密取空白血浆180μL,置2mL离心管中,加入不同浓度的NAC标准工作溶液20μL,配制成相当于NAC浓度为10.00,50.00,100.00,300.00,1 000.00,2 500.00,5 000.00μg·L-1的血浆样品,按“1.5”项血浆样品的处理操作,进行LC-MS/MS分析,记录色谱图,以NAC浓度增加值为纵坐标值(Y),以待测物峰面积增加值与内标物的峰面积比值为横坐标值(X),用加权(W=1/X2)最小二乘法进行回归运算。所得回归方程为:Y=9.78×10-4X+ 2.83×10-2(n=7),r=0.998,表明血浆中NAC在10.00~5 000μg·L-1范围内有良好的线性关系;定量下限为10.00μg·L-1,6样本分析后RSD<15%。
2.1.3 精密度及准确度 精密取空白血浆180μL,置2mL离心管中,精密加入不同浓度的NAC质控工作溶液20μL,配制成低、中、高(30.00,500.00,4 000.00μg·L-1)浓度质控样品,按“1.5”项血浆样品的处理操作,根据当日标准曲线计算质控样品的浓度,连续制备并测定3d,每个浓度进行6样本分析,对计算结果进行方差分析,得出方法精密度与准确度,结果见表1。
2.1.4 基质效应与提取回收率 精密取空白血浆200μL,除不加内标溶液外,按“1.5”项血浆样品的处理操作,取血浆上清液180μL,分别加入不同浓度的NAC质控工作溶液20μL和内标工作液30μL后,进样分析获得峰面积;与相应浓度的标准溶液和内标溶液直接进样获得的峰面积按照基线扣除法计算后相比评价基质效应。结果显示3个质量浓度下血浆样品的基质效应分别为:(90.83±5.61)%,(100.44±6.47) %,(101.33±4.63)%,内标的基质效应为(91.41±2.50)%,表明本基质效应对不同浓度血浆样品的影响基本一致。

A.空白血浆;B.空白血浆中加入NAC(μg·L-1)和氘代乙酰半胱氨酸标准溶液;C.受试者服药后2 h的血样;Ⅰ.乙酰半胱氨酸;Ⅱ.氘代乙酰半胱氨酸
图1 血浆NAC和氘代乙酰半胱氨酸的LC-MS/MS色谱图
A.blank plasma;B.blank plasma spiked with NAC andd3-NAC;C.plasma sample two hours after oral treatment;Ⅰ.NAC;Ⅱ.d3-NAC
Fig.1 LC-MS/MS chromatograms of NAC andd3-NAC
表1 测定方法的精密度及准确度


加入浓度/(μg·L-1)日内(n=18)检测浓度/(μg·L-1)RSDRE%日间(n=18)检测浓度/(μg·L-1)RSDRE%30.0027.98±3.245.4793.2732.20±4.156.78107.33500.00530.00±62.904.26106.00472.90±58.795.6794.584000.004216.00±347.216.09105.404174.00±348.918.56104.35
此处浓度测得值均按基线扣除法计算后所得
The measured concentrations were obtained using baseline subtraction method
精密取空白血浆180 μL,精密加入不同浓度的NAC质控工作溶液20 μL,配制成低、中、高(30.00,500.0,4 000 μg·L-1)浓度的血浆样品,按“1.5”项血浆样品的处理操作,获取相应的峰面积,与相应浓度的标准溶液和内标溶液直接进样获得的峰面积按照基线扣除法计算后相比计算提取回收率,结果显示3个质量浓度下血浆样品的平均提取回收率分别为:(99.53±4.09)%,(98.25±1.32)%,(92.04±1.24)%,内标的平均提取回收率为(97.28±1.56)%。
2.1.5 样品稳定性 按血浆样品标准曲线测定方法配制成为NAC浓度为30.00,500.00,4 000.00 μg·L-1的低、中、高3个浓度的质控样本。样品配制好后分别于室温下放置4 h、处理后样品4 ℃进样器中放置4 h、反复冻融3次、-70 ℃冰箱中冷冻保存30 d后取出室温融解,按“1.5”项血浆样品的处理操作,考察血浆样本中NAC的稳定性。按基线扣除法计算所得结果,结果显示按上述各条件处理后低、中、高3个浓度血浆样品中的NAC均保持稳定(RSD均在10%以内),表明样品在储存及检测过程中稳定性良好。
2.2 生物等效性分析
2.2.1 内源性NAC的测定 受试者未服药周期内所有采血时间点的空白血样进行测定,结果显示在24 h内,内源性NAC基础值为(33.20±1.05) μg·L-1,平均血药浓度-时间曲线如图2A所示。
2.2.2 血药浓度-时间曲线 24例健康受试者单剂量口服乙酰半胱氨酸颗粒受试和参比制剂0.6 g后,按照基线扣除法计算后血浆中外源性NAC的平均血药浓度-时间曲线见图2B。
2.2.3 药动学参数 24例健康受试者单剂量口服乙酰半胱氨酸颗粒受试和参比制剂0.6 g后,血药浓度测定结果经DAS 3.0版软件计算药动学参数,结果见表2。
2.2.4 生物等效性评价 24例健康受试者单剂量口服乙酰半胱氨酸颗粒受试和参比制剂0.6 g后,药动学参数 AUC(0-t)、AUC(0-∞)、Cmax经对数转换,进一步双单侧t检验和(1-2α)置信区间检验,tmax经非参数检验,两种制剂符合生物等效性假设,即两种制剂具有生物等效性。
2.2.5 方法学可行性评价 以上结果显示,24 h内内源性NAC浓度基本恒定,不受生理节律的影响出现较大波动,且外源性NAC较内源性NAC浓度变化较为显著,表明基线扣除法在本次试验中具有可行性。
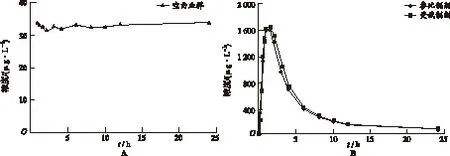
图2 24例健康受试者的内源性NAC(A)及单剂量口服乙酰半胱氨酸颗粒受试和参比制剂0.6 g后药源性NAC(B,扣除内源性NAC)平均血药浓度-时间曲线
Fig.2 Plasma concentration-time curve of endogenous and exogenous NAC in 24 healthy volunteers before(A) and after(B) a single oral dose of acetylcysteine granules as reference or test preparation at 0.6 g
表2 24例健康受试者单剂量口服乙酰半胱氨酸颗粒受试和参比制剂0.6 g后的主要药动学参数
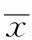
2.2.6 安全性评价 整个试验过程中未发现与试验药物有关的不良事件,试验结束后受试者均接受体格检查及实验室检查,未发现有临床意义改变的指标。
3 讨论
文献报道的检测血浆中的NAC的方法有HPLC法[7-8]及LC-MS/MS法[6],但是均未对内源性和外源性NAC加以区分。笔者采用了基线扣除法排除了内源性NAC对外源性NAC测定结果的干扰,并且得出了内源性NAC的基础值及其变化规律,进一步证明了该法在本实验中的可行性。
NAC分子式中含有二硫键,在血样前处理过程中不稳定,DTT的加入能够减缓这一过程的发生。因此,笔者分别对DTT的用量、浓度及其加入血样后放置时间进行了考察,发现50 μL,46.28 g·L-1的DTT溶液加入血样后放置5 min所得待测物的响应值最大。
本次试验结果显示,受试者单剂量口服乙酰半胱氨酸颗粒受试和参比制剂0.6 g后,在约1 h血药浓度即可达峰值,半衰期为约8 h,受试制剂的相对生物利用度为(107.00±43.30)%,两种制剂的血药浓度-时间曲线变化趋势基本一致,其主要药动学参数的差异无统计学意义(P>0.05),受试制剂AUC(0-t)、AUC(0-∞)、Cmax的90%置信区间均落在生物等效性要求范围内。综上所述,受试制剂与参比制剂具有生物等效性。
[1] ROGERS D F.Mucoactive agents for airway mucus hyperse-cretory diseases[J].J Respir Care,2007,52(9):1176-1193.
[2] 陈新谦,金有豫,汤光.新编药物学[M].17版.北京:人民卫生出版社,2011:426-428.
[3] 鲍红荣,董立力.N-乙酰半胱氨酸的药理作用及其临床应用[J].浙江临床医学,2008,10(9):1274-1275.
[4] 程天贵.乙酰半胱氨酸制剂与临床应用研究进展[J].中国生化药物杂志,2007,28(6):430-432.
[5] LIU Y M,LIU Y,LU C,et al.Relative bioavailability of gen-eric and branded acetylcysteine effervescent tablets:A single-dose,open-label,randomized-sequence,two-period crossover study in fasting healthy Chinese male volunteers[J].J Clin Ther,2010,32(12):2097-2105.
[6] LU C,LIU G J,JIA J Y,et al.Liquid chromatography tandem mass spectrometry method for determination ofN-acetylcysteine in human plasma using an isotope-labeled internal standard[J].J Biomed Chromatogr,2011,25(4):427-431.
[7] 张乐,胡岚岚,周世文,等.柱前衍生-高效液相色谱荧光法测定人血浆中乙酰半胱氨酸及其生物等效性研究[J].中国测试,2013,39(2):52-55.
[8] 席建军,王福根,庄让笑,等.反相高效液相色谱法测定家兔体内乙酰半胱氨酸血药浓度[J].中国药业,2012,21(5):13-14.
DOI 10.3870/yydb.2015.08.007
Study on Bioequivalence of Acetylcysteine Granules in Chinese Healthy Volunteers
LI Jie1,LIU Mengzhou2,LI Weiyong1,JIA Mengmeng1,ZHOU Ying1,LI Huqun1
(1.DepartmentofPharmacy,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China; 2.SchoolofBasicMedicalScience,WuhanUniversity,Wuhan430071,China)
Objective To establish an analytical method for assessing acetylcysteine in human plasma and study the relative bioavailability and bioequivalence of acetylcysteine granules in Chinese healthy volunteers. Methods In the randomized crossover study, 24 healthy male volunteers
a single oral dose of 0.6 g test acetylcysteine granules, reference acetylcysteine granules or no medication.The plasma concentration of acetylcysteine was determined by LC-MS/MS.Pharmacokinetic parameters were calculated and bioequivalence of two preparations were evaluated by DAS3.0 software. Results The main pharmacokinetic parameters of the test and reference preparations were as follows: AUC0→twas (8 547.64±2 860.04) and (8 783.07±4 042.10) μg·h·L-1, respectively; AUC0→∞was (9 481.64±3 444.76) and (9 540.51±4 239.30) μg·h·L-1, respectively;Cmaxwas (1 994.39±726.42) and (2 090.27±885.46) μg·L-1, respectively;tmaxwas (1.18±0.60) and (1.13±0.53) h, respectively;t1/2was (8.60±3.76) and (7.75±5.01) h, respectively.The relative bioavailabilityF0→tandF0→∞was(107.00±43.30)%and(106.50±40.10)%,respectively.ConclusionTheresultsofstatisticalanalysisindicatethatthetestandreferenceformulationsarebioequivalent.
Acetylcysteinegranules;Bioavailability,relative;Bioequivalence;Liquidchromatography-tandemmassspectrometry
2014-07-04
2014-10-17
李杰(1988-),男,河南鹤壁人,药师,硕士,研究方向:临床药学。电话:027-84289582,E-mail:157512890@qq.com。
黎维勇(1966-),男,湖北鄂州人,主任药师,教授,博士生导师,研究方向:药动学和药物代谢。电话:027-85726063,E-mail:2621239868@qq.com。
R974.1;R969.1
B
1004-0781(2015)08-1014-05

