可乐定对原代培养大鼠皮质神经元氧糖剥夺损伤的保护作用
张晓雪,贾俊婷,罗攀,陈诚,郭莲军
(1.华中科技大学同济医学院附属普爱医院检验科,武汉 430033;2.华中科技大学同济医学院药理学系,武汉 430030)
可乐定对原代培养大鼠皮质神经元氧糖剥夺损伤的保护作用
张晓雪1,贾俊婷2,罗攀2,陈诚2,郭莲军2
(1.华中科技大学同济医学院附属普爱医院检验科,武汉 430033;2.华中科技大学同济医学院药理学系,武汉 430030)
目的 研究可乐定对原代培养大鼠皮质神经元氧糖剥夺(OGD)损伤的保护作用。方法 取培养8 d的皮质神经元,分为正常对照组、模型对照组、可乐定(1.0,3.0,10.0 μmol·L-1)预处理组。神经元氧糖剥脱损伤模型通过化学性缺氧、孵育液缺糖的方法建立。神经元损伤程度采用噻唑蓝(MTT)染色法和检测乳酸脱氢酶(LDH)的释放量来进行评价,观察预给予可乐定(1.0,3.0,10.0 μmol·L-1)对神经元损伤的保护作用。结果 显微镜下,正常对照组细胞密集,胞体饱满,边缘光滑,有较强折光性;神经元存活率(100.00±32.12)%,LDH释放比率(100.00±37.51)%。模型对照组细胞核固缩,细胞膜不完整,折光性差,MTT染色吸光度值明显降低,神经元存活率(53.61±7.62)%,LDH释放量显著增加,释放率为(166.07±9.65)%。可乐定(1.0,3.0,10 μmol·L-1)预处理可明显逆转ODG损伤所致细胞形态的改变,剂量依耐性升高MTT染色吸光度值,神经元存活率分别为(67.53±10.54)%,(71.50±9.79)%和(87.48±5.29)%,同时可明显降低LDH的释放量,释放率分别为(136.45±25.72)%,(130.92±24.94)%和(121.63±32.68)%。结论 可乐定对原代培养大鼠皮质神经元ODG损伤具有良好的保护作用。
可乐定;皮质神经元;原代培养;损伤,氧糖剥夺
20世纪70年代,可乐定作为α2肾上腺素受体激动药成功应用于治疗高血压。但随后一些疗效好、不良反应少的降压药的出现,使得可乐定现已很少用于高血压的治疗,而较多用作麻醉辅助药及镇痛药,以及阿片类药物依赖的脱毒治疗[1-2]。最近发现,一种新型的α2肾上腺素受体激动药盐酸右美托咪啶(dexmedetomidine,DEX),系统给药对脑缺血引起的神经损伤具有保护作用[3],同时可拮抗麻醉药氯胺酮、异氟烷等引起的神经凋亡和海马损伤[4-5]。在成人清醒开颅术中发现,DEX可抑制高碳酸血症导致的脑血管扩张而产生脑保护作用[6]。对此有关α2肾上腺素受体激动药对神经细胞的保护作用受到高度关注。以往有关可乐定神经保护作用的实验主要在整体脑缺血模型中展开,而在体外水平研究则较少报道[7]。为了深入了解可乐定在体外水平及氧糖剥夺(oxygen and glucose deprivation,OGD)情况下是否具有神经细胞的保护作用,笔者应用大鼠原代培养皮质神经细胞,通过化学性缺氧缺糖即OGD损伤模型,进一步评价可乐定对神经细胞的保护作用,为该类药物的临床应用提供实验依据。
1 材料与方法
1.1 动物 1~3 d龄的斯泼累格·多雷(Sprague Dawley,SD)乳鼠,清洁级,合格证号:No:00020736,华中科技大学同济医学院实验动物中心提供,生产许可证号:SCXK(鄂)20100007。动物房自然采光,室温22~25 ℃,相对湿度(50±10)%。常规饲料,自由饮食。
1.2 试剂 可乐定(clonidine,含量:>95%,批号:4205-91-8)粉剂,购自Sigma公司,临用前用双蒸水配成1.0,3.0,10.0 μmol·L-1的浓度,过滤除菌后备用,于4 ℃避光保存;连二亚硫酸钠(批号:07032)购自南京化学试剂一厂;噻唑蓝(methyl thiazolyl tetrazolium,MTT,批号:M8180-1)购自Sigma公司;胎牛血清(批号:20091116)购自中美合资兰州民海生物工程有限公司,-20 ℃冰箱保存;胰酶(trypsin,批号:BE2189),L-多聚赖氨酸(P1399),阿糖胞苷(批号:w10562)均购自Sigma公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒,批号:GTX62716,购自南京建成生物工程研究所;其余试剂均为国产市售分析纯。
1.3 仪器 2306-2型二氧化碳(CO2)培养箱(美国SHELLAB公司);SW-CJ-2FD型超净工作台(苏净集团苏州安泰空气技术有限公司);WV-GP460型光学显微照相系统(苏州松下通信工业有限公司);ELX800全自动酶标仪(德国Bioztek仪器公司)。
1.4 大鼠皮质细胞原代培养 用75%乙醇消毒后断头,分离颅骨,快速取脑,仔细剥离脑膜,分离大脑皮质放入培养皿清洗两次后置于青霉素瓶,加适量D-Hank's液,用眼科剪剪成大小0.8 mm3;转移至刻度试管按1:1的比例加0.25%胰酶,吸管吹打混匀,37 ℃孵育15~20 min,待液体呈粘稠状后,吸管吹打混匀,加入少许完全培养液终止消化,吸管吹打混匀;过滤,75 μm孔径筛网过滤至烧杯转移至刻度试管,加入基础培养液至10 mL,吸管吹打混匀,1 000 r·min-1(r=8 cm)离心10 min(重复两次);去上清液,加入适量完全培养液重悬细胞,根据实验需要调整细胞密度至106个·mL-1,接种于预先用多聚赖氨酸处理过的培养板;第3天全量换液,第4天加阿糖胞苷(终浓度为5×10-3g·L-1)抑制神经胶质细胞的生长,第5天全量换液,以后每隔1 d半量换液,或根据培养液颜色定期换液。
1.5 ODG模型制备与实验分组 取培养8 d的皮质神经元,利用拆信封法随机分为正常对照组,模型对照组和可乐定(1.0,3.0,10.0 μmol·L-1)预处理组,每组6孔(n=6),重复3次。可乐定在ODG前24 h给予。上述各组孵育24 h后,正常对照组各孔分别加入200 μL含糖的Earle’s液,而模型对照组和给药组各孔分别加入连二亚硫酸钠浓度为2 mmol·L-1的无糖Earle’s液,于CO2培养箱内(37 ℃,5%CO2,95%O2)孵育4 h后进行细胞活性检测[8-9]。
1.6 MTT还原实验 用于检测神经元的活力。OGD结束后,向接种细胞的96孔板中加入MTT(5 g·L-1,每孔200 μL),培养箱(37 ℃,CO25%,O295%)孵育4 h。孵育结束后将上清去除,每孔加入二甲亚砜(DMSO)150 μL,气浴震荡仪震荡10 min使深蓝色甲臜充分溶解后,用全自动酶标仪测定各孔在波长570 nm处的吸光度(A)值。细胞存活率(%)=(测定组A570 nm-测定空白A570 nm)/(正常组A570 nm-测定空白A570 nm)×100%。
1.7 LDH释放量的测定 作为细胞内标志酶LDH是糖的无氧酵解和糖异生的重要酶系之一,其释放量与细胞受损、膜通透性改变等密切相关。本实验ODG损伤结束后,收集细胞孵育液,其中LDH的含量按照LDH试剂盒说明书进行。检测原理,LDH催化乳酸生成丙酮酸,丙酮酸再与2,4-二硝基苯肼反应生成丙酮酸二硝基苯腙,后者在碱性溶液中呈棕红色,测定其在440 nm处A值,然后按公式计算LDH的含量,以百分率表示。LDH释放量百分率(%)=各实验组LDH含量/正常组LDH含量×100%。
2 结果
2.1 可乐定对原代培养大鼠皮质神经元OGD损伤的保护作用 正常对照组神经元胞体饱满,边缘光滑,有较强折光性;模型对照组神经元细胞核固缩,胞体膨胀甚至破裂,细胞膜不完整,折光性差。MTT还原实验结果发现:正常对照组的神经元存活百分率为(100.00±32.12)%,模型对照组神经元存活百分率为(53.61±7.62)%。与正常对照组比较,模型对照组神经元的存活率明显降低,其差异有统计学意义(P<0.01);可乐定1.0,3.0,10 μmol·L-1预处理组存活百分率分别为(67.53±10.54)%,(71.50±9.79)%,(87.48±5.29)%,与模型对照组比较明显升高,差异有统计学意义(P<0.01),结果见图1,2。
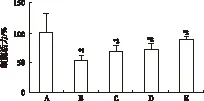
A.正常对照组;B.模型对照组;C.可乐定1.0 μmol·L-1预处理组;D.可乐定3.0 μmol·L-1预处理组;E.可乐定10.0 μmol·L-1预处理组;与正常对照组比较,*1P<0.01,与模型对照组比较,*2P<0.01
图1 5组原代培养大鼠皮质细胞活力的比较
A.normal control group;B.model control group;C.1.0 μmol·L-1clonidine pretreatment group;D.3.0 μmol·L-1clonidine pretreatment group;E.10.0 μmol·L-1clonidine pretreatment group;compared with normal control group,*1P<0.01; compared with model control group,*2P<0.01
Fig.1 Comparison of the activity among five groups of primary cultured rat cortical neurons
2.2 可乐定对OGD损伤的原代培养大鼠皮质神经元
LDH释放量的影响 正常对照组神经元LDH释放量百分率为(100.00±37.51)%,模型对照组为(166.07±9.65)%,与正常对照组比较,模型对照组释放量明显升高,差异有统计学意义(P<0.01);可乐定(1.0,3.0,10.0 μmol·L-1)预处理LDH释放量百分率分别为(136.45±25.72)%,(130.92±24.94)% 和(121.63±32.68)%,与模型对照组比较,释放量明显下降,差异有统计学意义(P<0.05),结果见图3。
3 讨论
本实验在原代培养的大鼠大脑皮质细胞中加入连二亚硫酸钠,同时用无糖培养液孵育4 h,即进行OGD损伤,可见细胞数量明显减少,MTTA值明显减少,LDH释放明显增加。LDH是细胞内糖的无氧酵解和糖异生的重要酶系之一,其释放量与细胞受损、膜通透性改变等密切相关,OGD损伤后,细胞培养液中LDH含量增加,其增加程度与细胞受损程度呈正相关。本实验结果显示,原代培养的皮质细胞在OGD的同时加入可乐定(1.0,3.0,10.0 μmol·L-1)均可以显著逆转神经元的损伤。显微镜下可见细胞密度明显增加,剂量依耐性增加MTTA值和减少LDH释放。证明可乐定对由OGD所致的原代大鼠皮质神经元损伤有良好的保护作用。
α2肾上腺素受体广泛分布于中枢神经、外周神经系统和自主神经节中,是一种跨膜性的G蛋白耦联受体。在大脑多个脑区含有丰富的去甲肾上腺素能系统,研究发现选择性的激动蓝斑核α2肾上腺素受体,能发挥镇静催眠效应,作用于脊髓部位α2受体能产生镇痛作用。在整体动物脑缺血模型中已经报道α2受体激动药DEX能通过减少中枢交感神经活性、降低循环中的儿茶酚胺浓度[10],减少谷氨酸释放及降低谷氨酸受体敏感性[11],而发挥神经保细胞的保护作用。

A.正常对照组;B.模型对照组;C.可乐定10 μmol·L-1预处理组
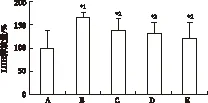
A.正常对照组;B.模型对照组;C.可乐定1.0 μmol·L-1预处理组;D.可乐定3.0 μmol·L-1预处理组;E.可乐定10.0 μmol·L-1预处理组;与正常对照组比较,*1P<0.01,与模型对照组比较,*2P<0.05
图3 5组原代培养大鼠皮质神经元LDH释放量的比较
A.normal control group;B.model control model group;C.1.0 μmol·L-1clonidine pretreatment group;D.3.0 μmol·L-1clonidine pretreatment group;E.10.0 μmol·L-1clonidine pretreatment group;compared with normal control group,*1P<0.01; compared with model control group,*2P<0.05
Fig.3 Comparison of LDH release among five groups of primary cultured rat cortical neurons
可乐定作为选择性α2受体激动药亦能通过激活不同脑区α2受体,分别产生镇静、镇痛等作用。也有研究指出,可乐定激动α2受体也可以影响谷氨酸神经递质的传递及儿茶酚胺类递质的释放[12 -13]。所以,在本实验中当神经细胞遭受OGD损伤时,可乐定可能是通过减少儿茶酚胺类神经递质及谷氨酸神经递质的释放而发挥对神经细胞的保护。但有关可乐定对神经细胞保护的详细机制,还有待进一步研究。
[1] MAVROPOULOS G,MINGUET G,BRICHANT J F.Alpha-2 adrenoreceptor agonists in anaesthesia and intensive care medicine[J].Rev Med Liege,2014,69(2):97-101.
[2] CHEN S Q,ZHAI H F,CUI Y Y,et al.Clonidine attenuates morphine withdrawal and subsequent drug sensitization in rhesus monkeys[J].Acta Pharmacol Sin,2007,28(4):473-483.
[3] KOSE E A,BAKAR B,KASIMCAN O,et al.Effects of intra-cisternal and intravenous dexmedetomidine on ischemia-induced brain injury in rat:a comparative study[J].Turk Neurosurg,2013,23(2):208-217.
[4] DUAN X,LI Y,ZHOU C,et al.Dexmedetomidine provides neuroprotection:impact on ketamine-induced neuroapoptosis in the developing rat brain[J].Acta Anaesthesiol Scand,2014,58(9):1121-1126.
[5] LIAO Z,CAO D,HAN X,et al.Both JNK and P38 MAPK pathways participate in the protection by dexmedetomidine against isoflurane-induced neuroapoptosis in the hippocampus of neonatal rats[J].Brain Res Bull,2014,107:69-78.
[6] ARD JL J R,BEKKER A Y,DOYLE W K.Dexmedetomi-dine in awake craniotomy:a technical note[J].Surg Neurol,2005,63(2):114-116.
[7] JELLISH W S,MURDOCH J,KINDEL G,et al.The effect of clonidine on cell survival,glutamate,and aspartate release in normo- and hyperglycemic rats after near complete forebrain ischemia[J].Exp Brain Res,2005,167(4):526-534.
[8] WANG X Q,YAO R Q,LIU X,et al.Quercetin protects oligodendrocyte precursor cells from oxygen/glucose deprivation injury in vitro via theactivation of the PI3K/Akt signaling pathway[J].Brain Res Bull,2011,86(3-4):277-284.
[9] ZHANG Z G,LV T S,YUAN H Y.Neuroprotective effects of ultra-low-molecular-weight heparininvitroandvivomodels of ischemic injury[J].Fundam Clin Pharmacol,2011,25(3):300-303.
[10] ENGELHARD K,WERNER C,KASPAR S,et al.Effect of the α2-agonist dexmedetomidine on cerebral neurotrans-mitter concentrations during cerebral ischemia in rats[J].Anesthe siology,2002,96(2):450-457.
[11] PARIS A,MANTZ J,TONNER P H,et al.The effects of dexmedetomidine on perinatal excitotoxic brain injury are mediated by the α2-adrenoceptor subtype[J].Anesth Analg,2006,102(2):456-461.
[12] JIMENEZ-RIVERA C A.Presynaptic inhibition of glutamate transmission by α2receptors in the VTA[J].Eur J Neurosci,2012,35(9):1406-1415.
[13] BERG T,JENSEN J.Tyramine reveals failing α2-adrenoce-ptor control of catecholamine release and total peripheral vascular resistance in hypertensive rats[J].Front Neurol,2013,28(4):19.
DOI 10.3870/yydb.2015.08.006
Neuroprotective Effect of Clonidine on Primary Cultured Cortical Neurons in Rats Subjected to Oxygen-glucose Deprivation Injury
ZHANG Xiaoxue1, JIA Junting2, LUO Pan2, CHEN Cheng2, GUO Lianjun2
(1.DepartmentofLaboratoryMedicine,Pu’aiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430033,China; 2.DepartmentofPharmacology,SchoolofBasicMedicalSciences,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China)
Objective To determine the neuroprotective effect of clonidine on primary cultured cortical neurons in rats exposed to oxygen-glucose deprivation (OGD) injury. Methods Cortical neurons cultured for 8 days were randomly assigned to the three groups: normal control group, model control group, and clonidine pretreatment group.OGD injury model was established by chemical hypoxia and glucose deprivation in incubation liquid for 4 h.Clonidine (1.0, 3.0, 10 μmol·L-1) was added 24 h before OGD injury.Neuronal injury was evaluated by MTT staining and the release of lactate dehydrogenase (LDH). Results Under the microscope, primary cultured cortical neurons in normal control group presented great density, round size, smooth edge, and high diopter,The suvival rate of neurons and the percentage of LDH releasing were (100.00±32.12)% and (100.00±37.51)%, respectively.After exposure to OGD injury, cortical neurons showed karyopyknosis, incomplete cell membranes, low diopters and a significant reduction in optical density of MTT staining.In addition, the suvival rate of neurons and the percentage of LDH releasing were (53.61±7.62)% and (166.07±9.65)% separately compared with normal control group.In the group with pretreatment of different concentrations of clonidine (1.0, 3.0, 10 μmol·L-1), morphological changes induced by OGD injury were significantly reversed and optical density of MTT staining was dose-dependently raised.The percentages of survival neurons much higher than that of model control group were [(67.53±10.54)%, (71.50±9.79)% and (87.48±5.29)%, separately] and the obvious reductions of LDH releasing were [(136.45±25.72)%, (130.92±24.94)% and (121.63±32.68)%, respectively]. Conclusion Clonidine can exert neuroprotection against OGD-induced injury in primary cultured cortical neurons in rats.
Clonidine;Cortical neurons;Primary culture;Injury, oxygen-glucose deprivation
2014-06-17
2014-09-15
张晓雪(1984-),女,甘肃兰州人,博士,从事临床检验工作。电话:(0)13720231780,E-mail:1078953720@qq.com。
郭莲军(1953-),女,湖北天门人,教授,博士生导师,研究方向: 心脑血管药理。电话:027-83691763,E-mail: Ljguo@hust.edu.cn。
R977.15; R965
A
1004-0781(2015)08-1010-04
DOI 10.3870/yydb.2015.08.005

