缺氧/复氧大鼠心肌中IL-1β浓度的动态变化及意义*
何金波, 包财盈, 叶玉柱, 罗梓垠, 应 磊, 王万铁
(温州医科大学缺血/再灌注损伤研究所, 浙江 温州 325035)
缺氧/复氧大鼠心肌中IL-1β浓度的动态变化及意义*
何金波, 包财盈, 叶玉柱, 罗梓垠, 应 磊, 王万铁△
(温州医科大学缺血/再灌注损伤研究所, 浙江 温州 325035)
目的:探讨大鼠心肌中白细胞介素-1β(IL-1β)在心肌缺氧/复氧过程中的动态变化及其意义。方法:采用Langendorff方法制备离体大鼠心肌缺氧/复氧模型。40只雄性SD大鼠随机分为对照组(A组)和缺氧/复氧组( H/R组)。H/R组按照复氧时间分为H/R 0.5 h、H/R 1 h、H/R 2 h组(B、C、D组)(n=10)。连续纪录各组左室发展压(LVDP)、左心室发展压最大上升/下降速率(± dp/dtmax)的变化,ELISA检测各组心肌IL-1β和肌酸激酶同工酶(CK-MB)的浓度,RT-PCR检测心肌IL-1β mRNA 的表达水平,光镜观察心肌结构。结果:与对照组相比,H/R组大鼠 LVDP、 ± dp/dtmax值均降低(P<0.05),心肌中IL-1β的含量及IL-1β mRNA 的表达明显升高(P<0.05),CK-MB浓度上升(P<0.05),随复氧时间的延长以上指标的变化更明显,B、C、D组间两两比较,差异均有统计学意义(P<0.05),H/R 2 h组心肌中的IL-1β、CK-MB的浓度以及IL-1β mRNA 的表达量与A、B、C组相比,达到最高(P<0.05)。结论:大鼠心肌缺氧/复氧后IL-1β在心肌组织中的表达上升并引起心肌再灌注损伤。
IL-1β;心肌缺血/再灌注损伤;血流动力学
心肌缺血/再灌注损伤(myocardial ischemia/reperfusion injury,MI/RI)是指缺血心肌在恢复血流灌注后所产生的心肌损伤加重的现象。随着近些年来心肌梗死后冠状动脉再灌注治疗技术的发展,MI/RI成为当今医学领域关注的热点。研究表明,再灌注期间,自由基的大量生成、细胞钙超载、炎症反应、凋亡是导致MIRI的重要原因[1]。作为白细胞介素-1(interleukin-1,IL-1)家族中的一员,IL-1β是反映IL-1系统活性的重要指标[2],它可以激活免疫细胞产生多种细胞因子促进自由基等的产生和释放,参与介导炎症反应的重要过程[3]。IL-1β与许多心脏疾病,如冠心病、心肌梗死的发生与发展有密切关系[4],并且在缺血性心脏病心肌细胞凋亡的进程中具有重要作用[5]。本研究旨在通过观察IL-1β在大鼠心肌缺氧/复氧(hypoxia/reoxygenation,H/R)过程中的动态变化,探讨IL-1β在心肌缺血/再灌注损伤中的作用。
1 材料与方法
1.1 主要试剂
RT-PCR引物购自上海生工生物工程技术公司,RT-PCR试剂盒购自美国Thermo公司,大鼠IL-1β ELISA试剂盒购自上海西唐生物科技有限公司,其它试剂为市售分析纯产品。改良克氏液(Krebs-Henseleit,K-H):氯化钠 118.5 mmol/L,氯化钾4.8 mmol/L,硫酸镁1.2 mmol/L,磷酸二氢钾1.2 mmol/L,碳酸氢钠25.0 mmol/L,氯化钙2.5 mmol/L,葡萄糖11.1 mmol/L,pH 7.40±0.05。改良ThomasⅡ停搏液:氯化钠110 mmol/L,氯化钾16 mmol/L,氯化钙1.2 mmol/L,碳酸氢钠1.0 mmol/L,氯化镁16 mmol/L,pH 7.80±0.05。
1.2 动物模型的制备与分组
SPF级健康雄性SD大鼠40只,体重(280±30)g,由温州医科大学实验动物中心提供[SYXK(浙)2010-0150]。将大鼠随机分为空白对照组(A组)、缺氧/复氧30 min组(B组)、缺氧/复氧1 h组(C组)、缺氧/复氧2 h组(D组)(n=10)。大鼠称重后,用5%水合氯醛(7~8)ml/kg腹腔注射麻醉,开腹,经下腔静脉注射肝素(1 000 U/kg)抗凝,迅速开胸取出心脏,将心脏悬挂在Langendorff离体心脏灌流装置上,经主动脉进行逆行灌注,恒温恒压灌流,灌注液温度(37±0.5)℃,灌注压100 mmHg。A组在建立Langendorff离体心脏灌注模型的基础上,平衡灌注20 min后将心脏保存;B、C、D组在平衡灌注20 min后,持续灌注改良ThomasⅡ停搏液3 min,使心脏完全停搏,继而停灌30 min,然后再复灌恒温恒压并通有混合气体的K-H缓冲液使其复跳并持续灌注,复灌的时间分别为30 min、1 h、2 h。
1.3 监测心功能相关指标
从左心耳向左心室插入球囊,球囊内注射适量生理盐水,直至左心室舒张末期压力(left ventricular end dilated pressure ,LVEDP)维持在(4~10)mmHg,通过Powerlab八通道生理记录仪连续记录各组左室发展压(1eft ventricular development pressure,LVDP)、左心室发展压最大上升/下降速率( maximal rates of increase/decrease of the left ventricular pressure,±dp/dtmax)的变化。
1.4 ELISA方法检测心肌组织中IL-1β和CK-MB的蛋白表达水平
取心肌组织100 mg,在超声匀浆机中充分匀浆,将匀浆液转入1.5 ml EP管中,4℃,3 000 r/min,离心15 min,取上清,用BCA试剂盒对上清液进行蛋白定量,用大鼠IL-1β ELISA试剂盒和大鼠CK-MB ELISA试剂盒进行IL-1β和CK-MB蛋白表达水平的检测。
1.5 RT-PCR方法检测心肌组织中IL-1β mRNA的表达水平
Trizol法提取大鼠心肌组织总RNA,蛋白核酸仪进行RNA浓度检测。按RNA逆转录试剂盒说明书合成cDNA产物。按RT-PCR逆转录试剂盒说明书准备25 μl的反应体系: 模板cDNA 1 μl ,PCR Mix 12.5 μl,上下游引物各1 μl,加三蒸水至25 μl。IL-1β的上游引物为5’-CTTCAAATCTCACAGCAGCATC-3’,下游引物为5’-GCTGTCTAATGGGAACATCACA-3’,扩增片段长度:220 bp。PCR反应条件:94℃ 预变性3 min,进入循环:94℃ 30 s,59.6℃ 30 s,72℃ 1 min,28个循环,再72℃ 5 min。β-actin上游:5’-TCAGGTCATCACTATCGGCAAT-3’,下游:5’-AAAGAAAGGGTGTAAAACGCA-3’,扩增片段长度:432 bp。PCR反应条件:94℃ 预变性3 min,进入循环:94℃ 30 s,58℃ 30 s,72℃ 1 min,29个循环,再72℃ 5 min。PCR产物用1.5%的琼脂糖凝胶进行电泳,用MUVB-20凝胶图像分析仪进行灰度值扫描,拍照。用Quantity One凝胶软件分析系统分析灰度值。
1.6 HE染色标本制备
各组停灌后迅速从心尖部同一部位取材,用10%的甲醛溶液固定,石蜡包埋、切片、HE染色,光镜下观察心肌组织结构的改变。
1.7 统计学分析

2 结果
2.1 各组动物心功能参数的的比较
与A组相比,B、C、D组的LVDP、+dp/dtmax、-dp/dtmax值明显降低(P<0.05);B、C、D组随着复氧时间延长,LVDP、+dp/dtmax、-dp/dtmax的值逐渐下降,B、C、D组间LVDP、+dp/dtmax、-dp/dtmax的值两两比较,差异均有统计学意义(P<0.05);D组与其他组相比,LVDP、+dp/dtmax、-dp/dtmax值达到最低(P<0.05,表1)。


Group+dp/dtmax(mmHg/s)-dp/dtmax(mmHg/s)LVDP(mmHg)A7096.36±319.52-3318.56±310.28225.31±27.45B6479.32±286.73*-2731.65±359.25*153.89±10.14*C5125.74±241.93*#-2054.57±413.20*#123.32±3.99*#D3070.58±410.64*#Δ-757.93±283.54*#Δ42.16±16.43*#Δ
A: Sham group; B: H/R 0.5 h group; C: H/R 1 h group; D: H/R 2 h group; +dp/dtmax: Maximal rates of increase of the left ventricular pressure; -dp/dtmax: Maximal rates of decrease of the left ventricular pressure;LVDP:Left ventricular development pressure; H/R: Hypoxia /reoxygenation
*P<0.05vsA group;#P<0.05vsB group;ΔP<0.05vsC group
2.2 各组大鼠心肌组织IL-1β和CK-MB蛋白的表达水平
与A组比较,B、C、D组心肌组织中IL-1β的表达明显增高(P<0.05),CK-MB的浓度上升(P<0.05);在B、C、D组,IL-1β和CK-MB的水平随着复氧时间的延长而升高,B、C、D组间两两比较,差异均有统计学意义(P<0.05);与A、B、C组相比,D组心肌组织中IL-1β和CK-MB的表达达到到高峰(P<0.05,表2)。


GroupIL-1β(pg/ml)CK-MB(ng/ml)A90.52±17.3522.83±3.79B148.87±19.27*62.82±2.71*C206.21±16.11*#114.71±28.08*#D280.03±55.07*#158.18±7.74*#Δ
A: Sham group; B: H/R 0.5 h group; C: H/R 1 h group; D: H/R 2 h group; IL-1β: Interleukin-1β; CK-MB: Creatine kinase-MB; H/R: Hypoxia /reoxygenation
*P<0.05vsA group;#P<0.05vsB group;ΔP<0.05vsC group
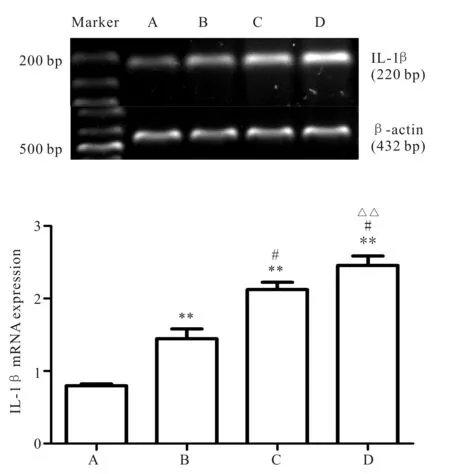
2.3 各组大鼠心肌组织IL-1β mRNA的表达水平
RT-PCR发现,各组心肌组织均见220 bp的IL-1β mRNA条带,对各组的IL-1β mRNA表达进行半定量分析,B、C、D组IL-1β mRNA的表达量与对照组相比显著升高(P<0.01);随着复氧时间的延长,在B、C、D组,IL-1β mRNA的表达量逐渐升高,B、C、D组间两两比较,差异均有统计学意义(P<0.01);D组与其他组相比,IL-1β mRNA的表达量达到最高(P<0.01,图1)。
2.4 相关性分析结果
大鼠心肌缺氧/复氧期间LVDP、+dp/dtmax、-dp/dtmax的值与心肌组织IL-1β的浓度呈显著负相关(P<0.05);大鼠心肌组织CK-MB的表达量与心肌组织IL-1β的浓度呈显著正相关(P<0.01);心肌IL-1β mRNA相对表达量与心肌组织IL-1β的浓度呈显著正相关(P<0.01);心肌缺氧/复氧期间LVDP、+dp/dtmax、-dp/dtmax的值与心肌组织IL-1β mRNA相对表达量呈显著负相关(P<0.05);大鼠心肌组织CK-MB的表达量与心肌组织IL-1β mRNA相对表达量呈显著正相关(P<0.01)。

2.5 光镜下大鼠心肌组织形态学观察
A组心肌细胞排列整齐,形态正常,细胞核居中,未见炎性细胞浸润;B组心肌细胞大体正常,排列尚有序,部分出现炎性细胞浸润;C组心肌纤维肿胀、变性,部分出现坏死;D组心肌纤维出现大范围断裂、溶解(图2,见彩图页Ⅱ)。光镜下大鼠心肌组织结构观察表明随着复氧时间延长,大鼠心肌组织损伤逐渐加重。
3 讨论
随着冠心病,心肌梗死发病率的节节攀高,溶栓治疗、PCI和搭桥手术在临床上也日趋广泛,这意味着术后心肌缺血/再灌注损伤会成为困绕临床医师的重要问题,自1960年Jennings第一次提出心肌缺血/再灌注损伤的概念以来,其具体机制也一直不断地被探讨,作为一种中介因素,炎症反应贯穿于心肌缺血/再灌注损伤的全过程,不仅能够激活中性粒细胞合成并释放炎症介质,通过级联反应引起血管内皮细胞游走收缩,使血管通透性增加,诱导细胞以及血管细胞粘附分子的表达增加,最终导致再灌注心肌的炎症损伤[6],而且能够与其他损伤因素相互作用,共同导致心肌的缺血/再灌注损伤[7]。
作为炎症反应的启动因子,IL-1β广泛参与了组织破坏、水肿形成等多种病理损伤过程,在炎症反应介导的机体缺血/再灌注损伤中也发挥着重要作用。有研究表明,脑、肝脏、肾脏等其他器官在经历缺血/再灌注后,炎症通路被激活,炎症因子的表达量升高,而在使用药物或者缺血预处理干预后,相应组织与血浆中IL-1β的含量降低,器官的缺血/再灌注损伤也得到有效缓解[8, 9]。IL-1β可直接上调细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)和内皮白细胞黏附分子-1(endothelial leukocyte adhesion molecule-1, ELAM-1)表达,进而诱导中性粒细胞迁移至心肌缺血区域,通过影响微血管通透性、释放氧自由基等机制导致最终引起心肌再灌注损伤。在李拥军的研究中表明,急性心肌梗死患者在接受PCI治疗后,再灌注过程中血浆IL-1β表达上升,于术后12 h血浆IL-1β水平达到高峰,而在兔的心肌缺血/再灌注模型中,再灌注即刻给予重组人IL-1受体拮抗剂(recombinant human interleukin-1 receptor antagonist, rhIL-1ra)之后,心肌再灌注损伤明显减轻,梗死面积缩小[10]。
本实验采用Langendorff离体灌流系统制备大鼠心脏缺氧/复氧模型,研究结果显示,作为提示心功能早期损伤的敏感指标,复氧期间CK-MB在心肌中的表达量逐渐升高,LVDP、+dp/dt、-dp/dt的值呈下降趋势,随着复氧时间延长,心肌损伤加重。缺氧/复氧组的心肌IL-1β的含量普遍高于对照组(P<0.05),而在缺氧/复氧组组内,B、C、D组随着再灌注时间的延长,IL-1β的表达量逐渐上升,组间两两比较差异均有统计学意义(P<0.05),反映出心肌的再灌注损伤与再灌注期间IL-1β的高表达所介导的炎症反应有着密切关联。相关性分析结果显示,大鼠心肌缺氧/复氧期间LVDP、+dp/dtmax、-dp/dtmax的值与心肌组织IL-1β的浓度呈显著负相关(P<0.05),心肌组织CK-MB的表达量与心肌组织IL-1β的浓度呈显著正相关(P<0.01),反映了缺氧/复氧期间心肌损伤的发生与发展和心肌组织中IL-1β的水平有密切关系。病理形态学观察可见,心肌缺氧/复氧后呈明显缺血、坏死性改变,在复氧的不同时间点其表现程度不同,最典型的特征是大量炎细胞浸润,也证实了炎症反应在再灌注损伤中的重要地位。
综上所述,在心肌缺氧/复氧过程中,心肌组织IL-1β的表达量呈动态的的上升趋势,并与再灌注损伤的程度相一致,因此我们有理由相信大鼠心肌缺氧/复氧过程中IL-1β介导的炎症反应是引起再灌注损伤的重要机制,这对临床上心肌缺血/再灌注损伤的预防与治疗有一定的指导意义。
[1] Saeed SA, Waqar MA, Zubairi AJ,etal. Myocardial ischaemia and reperfusion injury: reactive oxygen species and the role of neutrophil[J].JCollPhysiciansSurgPak, 2005, 15(8): 507-514.
[2] Barksby HE, Lea SR, Preshaw PM,etal. The expanding family of interleukin-1 cytokines and their role in destructive inflammatory disorders[J].ClinExpImmunol, 2007, 149(2): 217-225.
[3] Tu S, Bhagat G, Cui G,etal. Overexpression of interleukin-1beta induces gastric inflammation and cancer and mobilizes myeloid-derived suppressor cells in mice[J].CancerCell, 2008, 14(5): 408-419.
[4] Li L, Zhao X, Lu Y,etal. Altered expression of pro- and anti-inflammatory cytokines is associated with reduced cardiac function in rats following coronary microembolization[J].MolCellBiochem, 2010, 342(1-2): 183-190.
[5] Zhang J, Cheng X, Liao YH,etal. Simvastatin regulates myocardial cytokine expression and improves ventricular remodeling in rats after acute myocardial infarction[J].CardiovasDrugsTher, 2005, 19(1): 13-21.
[6] 刘亚坤, 黄林静, 赵 珊, 等. 血必净注射液对缺氧/复氧大鼠心肌TLR4--NF-κВ--IL-1β通路的影响[J]. 中国应用生理学杂志, 2014, 30(1): 55-59.
[7] Ao L, Zou N, Cleveland JC Jr,etal. Myocardial TLR4 is a determinant of neutrophil infiltration after global myocardial ischemia: mediating KC and MCP-1 expression induced by extracellular HSC70[J].AmJPhysiolHeartCircPhysiol, 2009, 297(1): H21-28.
[8] 门秀丽, 熊建新, 李宏杰, 等. 牛磺酸对大鼠肢体缺血/再灌注后肺损伤时磷脂酶A2的影响[J]. 中国应用生理学杂志, 2007, 23(4): 466-512.
[9] Tao X, Wan X, Xu Y,etal. Dioscin Attenuates Hepatic Ischemia-Reperfusion Injury in Rats Through Inhibition of Oxidative-Nitrative Stress, Inflammation andapoptosis[J].Transplantation, 2014, 98(6): 604-611.
[10]李拥军, 丁文惠, 高 炜, 等. 白介素-1受体拮抗剂对缺血再灌注心肌的保护作用及其机制探讨[J]. 中华医学杂志, 2004, 84(7): 548-553.
Dynamic changes of IL-1β in rat myocardium during hypoxia/ reoxygenation transition
HE Jin-bo, BAO Cai-ying, YE Yu-zhu, LUO Zi-yin, YING Lei, WANG Wan-tie△
(Ischemia/Reperfusion Injury Research Institute, Whenzhou Medical University, Whenzhou 325035, China)
Objective: To investigate the expression profile of interleuki-1β (IL-1β) in rat myocardium at different time points during hypoxia/reoxygenation(H/R)transition. Methods: The isolated Langendorff perfused rat heart model was established.Forty SD rats were randomly divided into sham group (A group) and hypoxia/reoxygenation group (H/R group). The H/R group rats were subdivided into H/R 0.5 h group(B group), H/R 1 h group(C group), H/R 2 h group(D group)according to reoxygenation time. The 1eft ventricular development pressure(LVDP) , maximal rates of increase/decrease of the left ventricular pressure(±dp/dtmax) were continuously recorded.The concentration of interleukin-1β( IL-1β ) and creatine kinase-MB (CK-MB) in myocardium was measured by ELISA. The mRNA expression of IL-1β in myocardium was determined by RT-PCR. Microstructure of myocardium was observed under light microscopy. Results: The value of LVDP and ± dp/dtmaxin hypoxia/reoxygenation group rat were significantly lower than that in sham group(P<0.05). The expression of IL-1β and CK-MB at protein level and the expression of IL-1β at mRNA level in hypoxia /reoxygenation group were higher than that in sham group(P<0.05). There were significant differences of the above parameters among H/R 0.5 h,1 h,2 h group(P<0.05). The concentration of IL-1β and CK-MB, the mRNA expression of IL-1β were higher in H/R 2 h group than that of other groups(P<0.05). Conclusion: The high expression of IL-1β in myocardium after myocardial hypoxia /reoxygenation in rats might lead to.ischemia/reperfusion injury.
IL-1β; myocardial ischemia/reperfusion injury; hemodynamics
R363
A
1000-6834(2015)01-027-04
10.13459/j.cnki.cjap.2015.01.009

