大鼠骨髓间充质干细胞向神经细胞分化后自噬水平的变化*
李 博, 黄春田, 李彩芳, 段 萍, 韩雪飞, 鄢文海△, 邢 莹,4△
(1. 郑州大学生理学教研室, 2. 病理生理学教研室, 3. 干细胞研究中心, 河南 郑州 450001; 4. 新乡医学院生理学教研室, 河南 新乡 453003)
大鼠骨髓间充质干细胞向神经细胞分化后自噬水平的变化*
李 博1,3, 黄春田2,3, 李彩芳2,3, 段 萍1,3, 韩雪飞3, 鄢文海2,3△, 邢 莹3,4△
(1. 郑州大学生理学教研室, 2. 病理生理学教研室, 3. 干细胞研究中心, 河南 郑州 450001; 4. 新乡医学院生理学教研室, 河南 新乡 453003)
目的:探讨骨髓间充质干细胞(BMSCs)向神经细胞分化前后自噬水平的变化,进一步研究BMSCs神经分化机制。方法:原代培养大鼠BMSCs,三代后用L-DMEM(2% DMSO+ 200 μmol/L BHA)诱导其向神经细胞分化,采用免疫细胞化学方法检测神经元特异标记物NSE表达,采用RT-PCR方法检测自噬相关基因LC3B、Beclin1、Atg5、Atg7、Atg10的表达,用Western blot及流式细胞术检测了自噬标志蛋白LC3B的表达。结果:大鼠BMSCs传3代后,贴壁的BMSCs可达90%以上,类成纤维细胞样梭形生长,经诱导剂作用5 h后,细胞呈现神经细胞样改变, NSE阳性率为(83±5)% 。RT-PCR结果表明BMSCs向神经细胞分化后LC3B,Beclin1,Atg5,Atg7,Atg10的表达升高,流式细胞术检测LC3B的平均荧光强度升高, Western blot结果表明神经分化后LC3B-Ⅱ表达增加。结论:大鼠BMSCs向神经细胞分化后自噬水平增加。
骨髓间充质干细胞;自噬;分化;神经细胞;大鼠
自噬(autophagy)来源于希腊词汇,自噬是指在营养缺乏或者受到外界应激情况下,细胞降解自身一些成分获得营养存活下来[1]。自噬被认为是细胞适应饥饿的一种方式,它还被认为在细胞质组分正常的更新中起重要作用。在干细胞分化过程中,势必会存在调控干细胞特性的蛋白被降解、更新的过程。自噬作为细胞降解内源性蛋白质的一种机制,很可能参与到干细胞分化的过程中。本实验通过检测大鼠骨髓间充质干细胞(bone mesenchymalstem cell,BMSCs)向神经细胞分化前后自噬相关基因LC3B、Beclin1、Atg5、Atg7、Atg10的mRNA的变化及自噬标志蛋白微管相关蛋白1轻链3B(microtubule associated protein 1 light chain 3,LC3B)的蛋白表达变化,探讨自噬活动在骨髓间充质干细胞向神经细胞分化中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物:SD大鼠购自郑州大学医学实验动物中心
1.1.2 试剂:琼脂粉购自Genehk公司,0.25% Trypsin-EDTA,DMEM培养基,胎牛血清,胰蛋白酶、EDTA购自Gibco公司,总RNA提取试剂盒(Trizol)北京天根公司,PCR premix购自TaKaRa公司, RIPA裂解液,PMSF,BCA蛋白定量试剂盒购自碧云天公司,Tis-base、甘氨酸、SDS购自 Solarbio公司,Temed购自上海华硕精细化学有限公司,过硫酸铵(AP)购自天津科密欧有限公司,彩色预染蛋白Marker北京鼎国有限公司,ECL发光试剂盒购自中杉金桥公司,自噬LC3B抗体购自Cell signaling 公司,LC3B流式抗体购自BD公司,NSE抗体购自Santa cruz 公司。
1.1.3 引物设计与合成:引物由上海生工成:β-actin-F:5’-CTGGGTATGGAATCCTGTGG-3’; β-actin-R:5’-GTACTTGCGCTCAGGAGGAG-3’ Atg5-F: 5'-GGAAGAATGACAGATGAC-3'; Atg5-R:5'-CTTTCA ATCTGTTGGCTG-3'; Atg7-F:5'-ATGGGGGGACCCTGGACTG-3'; Atg7- R:5'-CAGAACAGTGTCGTCATC-3'; Atg10-F:5'-TTCTGAAGTGACGAGACCTGC; Atg10-R:5'GCCATGATGTGATATAGTTGAC'; Beclin1-F: ATGGAGGGGTCTAAGGCGTC'; Beclin1-R: TCCTCTCCTGAGTTAGCCTCT。
1.2 骨髓间充质干细胞的分离,纯化及诱导
颈椎脱臼法处死SD大鼠,置于无菌操作台分离胫骨和股骨。剪断两端骨骺端,用5 ml注射器抽取培养基(L-DMEM+15%FBS)反复冲洗,冲洗出的细胞以1×106cells/ml的浓度接种,37℃、5% CO2培养,3~4 d后弃去培养基,加入完全培养基,6~7 d左右原代细胞(P0)生长至80%~90%融合时胰酶消化以1∶2的比例传代。4~5 d后待细胞生长每融合至80%~90%时再次传代,培养过程中用倒置显微镜观察并拍摄其形态变化。
细胞传至第3代时,进行细胞分化实验。采用诱导培养基L-DMEM(2% DMSO+ 200 μmol/L BHA)诱导骨髓间充质干细胞分化,5 h后收集细胞[2];对照组,不施加任何干预因素,正常换液,与实验组一同收细胞。
1.3 免疫细胞化学染色检测神经元特异性烯醇化酶(NSE)
细胞爬片用4%多聚甲醛进行固定,室温孵育20 min后,洗涤3次,3%过氧化氢孵育10 min, 洗涤3次,5%山羊血清封闭1 h,滴加一抗NSE(1∶100),4℃湿盒孵育过夜,PBS冲洗2 min×3次。滴加羊抗兔IgG抗体HRP多聚体, 37℃下孵育50 min,洗涤3次,DAB显色。
1.4 PCR检测自噬相关基因
采用RNA提取试剂盒提取总RNA,具体操作方法参见试剂盒说明书,逆转录步骤为于无RNA酶EP管中依次加入总RNA 5 μg,Oligo(dT)primer 1 μl,RNase-free ddH2O 6 μl,total 12 μl 后65℃ 5 min,再置于冰上,依次加入5×Reaction Buffer 4 μl,RNase Inhibitor 1 μl,10 mmol/L dNTP Mix 2 μl,反转录酶1 μl ,42℃ 60 min后70℃ 5 min。PCR反应体系为50 μl:10×PCR buffer5 μl,MgCl24 μl,dNTP(2.5 mmol/L)4 μl,Primer 1(10 pmol/μl)1.5 μl,Primer 2(10 pmol/μl)1.5 μl,cDNA (1 μg/μl)5 μl,TdH2O 28 μl,Taq DNA聚合酶1 μl,PCR反应条件为首先是94℃ 5 min;然后95℃ 1 min变性,55℃ 30 s退火,72℃ 50 s延伸,共30个循环;最后72℃ 10 min。实验重复三次。
1.5 Western blot检测自噬蛋白LC3B的表达
细胞提取蛋白后,采用BCA试剂盒测定蛋白浓度,制备SDS-PAGE凝胶,80 V稳压电泳120 min。采用半干转转PVDF膜, 5%脱脂奶粉封闭60 min,兔抗LC3B按照1∶1 000的比例稀释,β-actin抗体按1∶2 000的比例稀释,4℃冰箱过夜孵育,TBST洗膜三次;辣根过氧化物酶标记的二抗1∶2 000的比例稀释,室温2 h,TBST洗膜三次,采用ECL发光试剂盒曝光,Quantity one 图像分析软件分析目的条带和内参条带的灰度值,计算目的/内参的比值。实验重复三次。
1.6 流式细胞仪检测分化前后自噬相关蛋白LC3B表达变化
0.25%胰酶消化各孔细胞,1 000 r/min,离心5 min,PBS洗两次后,参照BD细胞破膜固定试剂盒说明书方法处理细胞,每管加入LC3B-PE 抗体1 μl,室温避光孵育30 min,加入2 ml BD Perm/Wash buffer洗涤,离心,1 000 r/min,5 min,弃上清,每管加入300 μl含 1%多聚甲醛的PBS重悬后流式细胞仪BD Canto Ⅱ上机检测。实验重复三次。
1.7 统计学分析
2 结果
2.1 大鼠骨髓间充质干细胞向神经细胞分化
间充质干细胞传3代后,杂质细胞等未贴壁细胞换液后大部分被清除,细胞呈现梭形,类似成纤维细胞样贴壁生长,BMSCs纯度可达90%以上,故此时可以进行后续实验。经诱导剂2% DMSO+200 μmol/L BHA诱导5 h后,可以观察到细胞伸出长突起,呈现神经细胞样的形态(图1)。检测神经元特异标记蛋白NSE的表达情况表明诱导分化组NSE阳性率升高,达到(83±5)%(图2)。
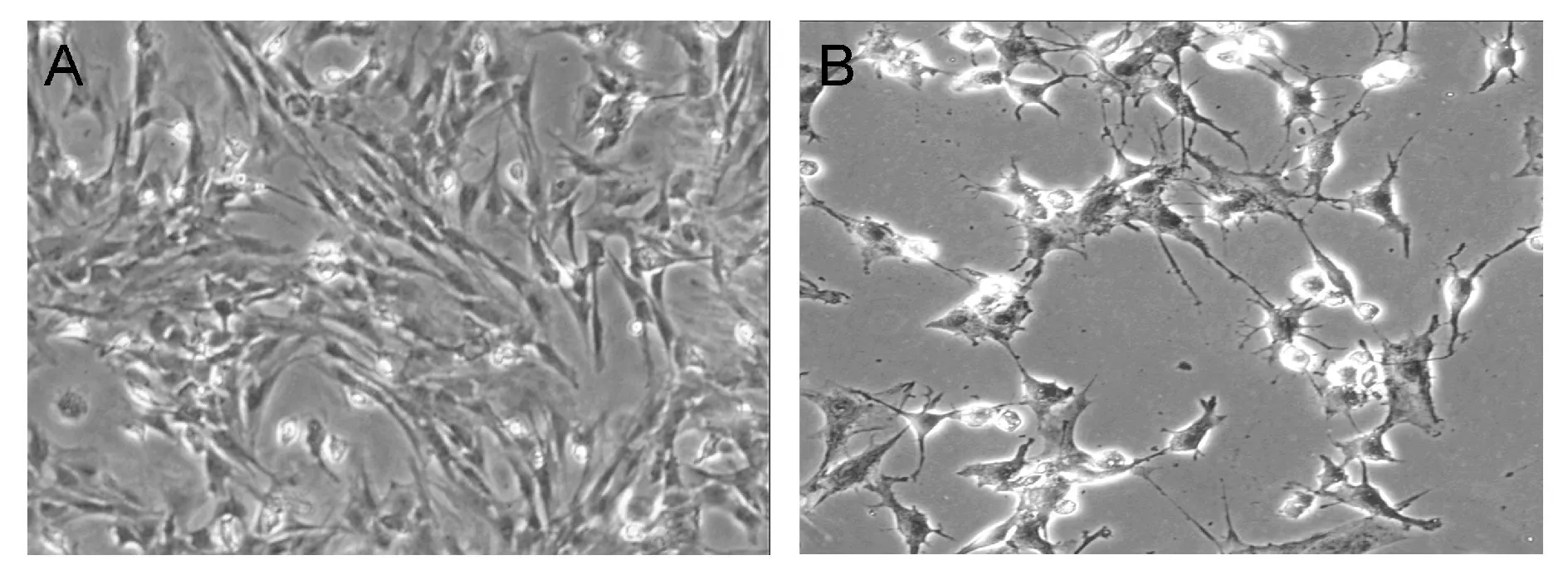
Fig.. 1 Rat BMSC culture(×40) A: Rat BMSC passed 3 generations; B: After BMSC induced 5 h; BMSC: Bone mesen chymal stem cells

Fig.. 2 Expression of NSE by immunocytochemistry(×40) A: Undifferentiated group; B: Induction group
2.2 分化后自噬相关基因mRNA表达的变化
RT-PCR检测结果显示,加入诱导培养基L-DMEM后,大鼠骨髓间充质干细胞向神经细胞分化后,自噬相关基因LC3B, Beclin1, Atg5, Atg7, Atg10的mRNA表达明显升高,与分化前相比差异有显著性(P<0.05,表2),表明大鼠骨髓间充质干细胞在向神经细胞分化过程中自噬活动增强。
Tab. 1 Relative expression of Autophagy associated gene between BMSC neural differentiation

GroupAutophagyassociatedgeneLC3BBeclin1Atg5Atg7Atg10BMSC1.0 1.0 1.0 1.0 1.0 BMSC-in-duced1.3±0.05*1.5±0.10*1.6±0.078*1.2±0.09*1.34±0.08*
BMSC: Bone mesenchymal stem cell; LC3B: Microtubule associated protein 1 light chain 3
*P<0.05vsBMSC group
2.3 分化后自噬标志蛋白LC3B表达的变化
LC3包括LC3A,LC3B,LC3C三个亚型,在细胞自噬活性升高时仅有LC3B表达。采用流式细胞术对自噬标志蛋白LC3B进行定量分析,结果表明骨髓间充质干细胞在向神经细胞分化前后LC3B的平均荧光强度(mean fluorescence intensity,MFI)发生明显改变,分化前的MFI为(147±23),分化后显著升高为(380±40),具有明显的统计学意义(P<0.05,图4)。LC3蛋白有LC3-I和LC3-II两种存在形式,当自噬发生时,LC3-Ⅰ经泛素样加工后,与自噬小体膜表面的磷脂酰乙醇胺结合,形成LC3-Ⅱ,因此,LC3-Ⅱ的含量与自噬泡数量成正比,LC3蛋白和低分子量的LC3-II都是细胞发生自噬的分子标志,而LC3-II的含量更能反映自噬活性[3]。采用SDS-PAGE可以将LC3-Ⅰ和LC3-II区分开来,我们用Western blot方法检测了自噬标志蛋白LC3B-Ⅱ型蛋白表达变化,结果显示大鼠骨髓间充质干细胞向神经细胞分化后LC3B-Ⅱ表达与未分化组相比增高,分化前相对表达量为0.51±0.08,诱导后相对表达量为0.8±0.09,差异具有显著性(P<0.05 ,图5),表明大鼠骨髓间充质干细胞向神经细胞分化后自噬活性增强。
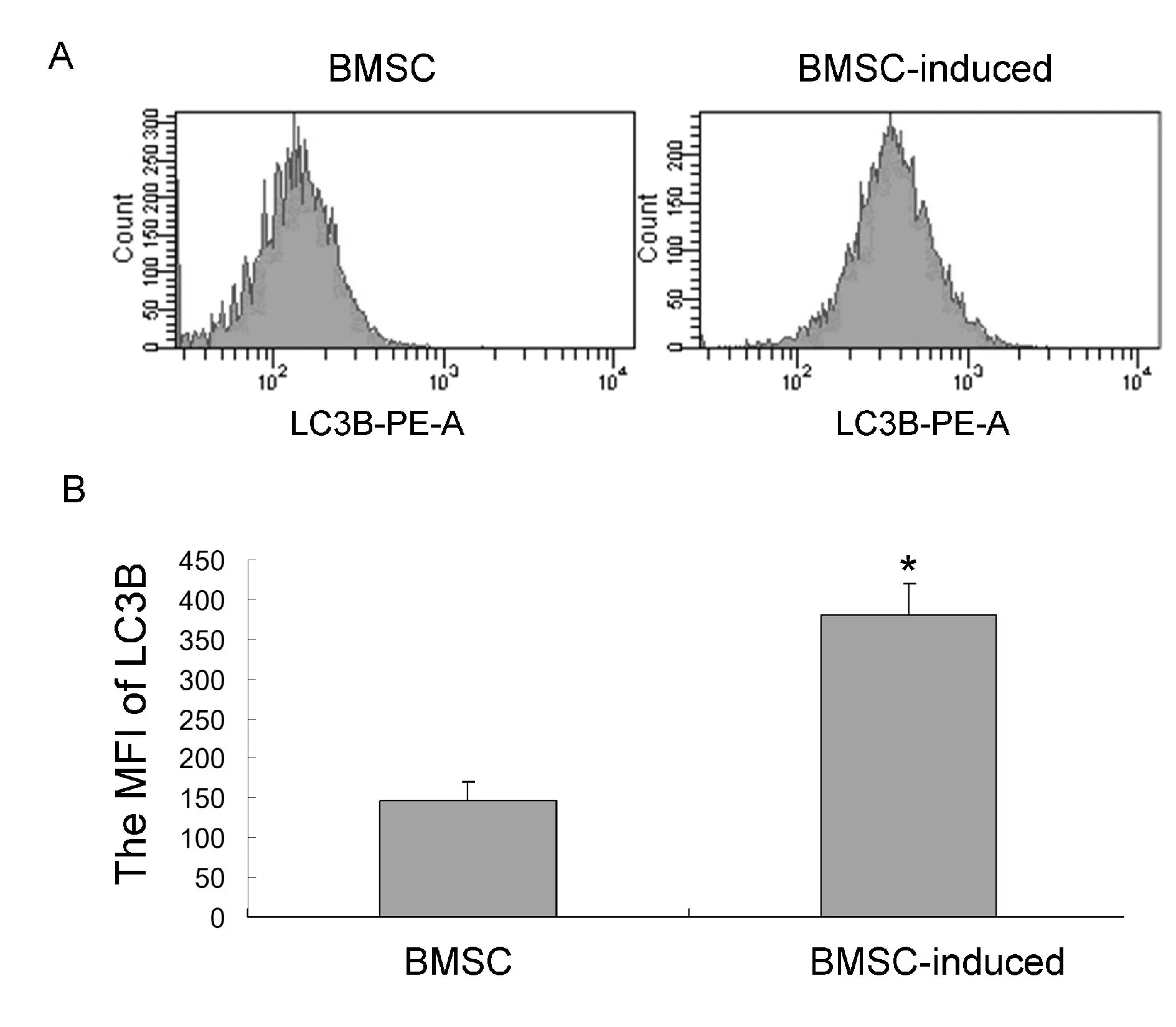
Fig.. 4 Mean fluorescence intensity(MFI) of autophagy protein LC3B between BMSC neural differentiation A: MFI analysis of LC3B shows larger after BMSC neural differentiation; B: Statistical analysis of MFI was used to calculate the LC3B expression; BMSC: Bone mesenchymal stem cell; LC3B: Microtubule associated protein 1 light chain 3*P<0.05vsBMSC group

Fig. 5 Expression of autophagy protein LC3B-Ⅱ between BMSC neural differentiation A: Western blot analysis of LC3B-Ⅱshows increased after BMSC neural differentiation; B: Statistical analysis was used to calculate the LC3B-Ⅱexpression; BMSC: Bone mesenchymal stem cell; LC3B: Microtubule associated protein 1 light chain 3*P<0.05vsBMSC group
3 讨论
骨髓间充质干细胞(mesenchymal stem cell,MSCs)可以跨胚层分化为神经细胞,这为细胞移植治疗神经系统疾病提供了新的途径。但由于其分化过程和调控机制尚不十分清楚,限制了其应用效果。
研究发现,自噬是细胞内蛋白降解的一种主要途径。自噬不仅有利于胞浆成分和细胞器的正常更新,还参与了细胞的生长发育过程,自噬参与了成神经胶质瘤细胞N2a细胞的分化,维甲酸诱导N2a细胞向神经细胞分化过程中,自噬被激活,自噬抑制剂3-MA,LY94002抑制细胞分化,而敲除自噬基因Beclin1后,细胞的分化也受抑制[4]。
有研究表明骨髓间充质干细胞存在自噬现象[5],骨髓间充质干细胞中自噬蛋白Beclin1参与ERK 调控的cyclinE的激活[6],提示自噬可能通过某些信号通路调控骨髓间充质干细胞的增殖和分化[7]。有文献报道,人牙髓间充质干细胞向成骨细胞分化1 d后,AMPK及其受体Raptor表达升高,mTOR表达降低,自噬标记蛋白LC3-Ⅱ和Beclin1表达升高,P62表达降低,AMPK敲除后则抑制mTOR的表达下调及自噬水平的增加,提示在人牙髓间充质干细胞向成骨细胞分化过程中,AMPK信号通路可能通过在分化早期调控mTOR诱导的自噬来影响分化[8]。但大鼠骨髓间充质干细胞自噬现象的研究还少见报道,我们检测了骨髓间充质干细胞神经分化前后细胞的自噬水平,结果表明,骨髓间充质干细胞表达基础水平的自噬,神经分化过程中,自噬相关基因LC3B,Beclin1,Atg5,Atg7,Atg10的mRNA的表达升高,自噬标记蛋白LC3B-Ⅱ的蛋白表达升高,表明在间充质干细胞神经分化过程中自噬水平升高,自噬可能参与神经分化的调节。自噬能够快速有效的降解细胞内的酶、黏附分子、一些分泌蛋白及转录因子,而这些物质在干细胞的分化和增殖中都起到重要作用,干细胞往往都处于G0期[9],因此可以通过自噬清除干细胞内一些编码错误的大分子物质,以防止干细胞衰老及对DNA的损伤引起基因突变,在分裂增殖中淡化这些物质对子代细胞的影响[10]。在干细胞分化过程中,势必会存在调控其干细胞特性的蛋白被降解,自噬作为细胞降解内源性蛋白质的一种机制,很可能参与到细胞分化的过程中。本研究为骨髓间充质干细胞中自噬现象的进一步研究奠定了基础。
[1] Fricke B, Heink S, Stefen J,etal. The proteasome maturation protein POMP facilitates major steps of 20S proteasome formation at the endoplasmie retieulum[J].EMBORep, 2007, 8(12): 1170-1175.
[2] Woodbury D,Schwarz EJ, Prockop DJ,etal. Adult rat and human bone marrow stromal cells differentiate into neurons[J].JNeurosciRes, 2000, 61(4): 364-370.
[3] 马 泰, 孙国平, 李家斌. 细胞自噬的研究方法[J]. 生物化学与生物物理进展, 2012, 39(3): 204-209.
[4] Zeng M, Zhou JN. Roles of autophagy and mTOR signaling in neuronal differenttiation of mouse neuroblastoma cells[J].CellSignal, 2008, 20(4): 659-665.
[5] Phadwal K, Watson AS, Simon AK. Tightrope act: autophagy in stem cell renewal, differentiation, proliferation, and aging[J].CellMolLifeSci, 2013, 70(1): 89-103.
[6] Ugland H, Naderi S, Brech A ,etal. cAMP induces autophagy via a novel pathway involving ERK, cyclin E and Beclin 1[J].Autophagy, 2011, 7(10): 1199-1211.
[7] Lee Y, Jung J, Cho KJ,etal. Increased SCF/c-kit by hypoxia promotes autophagy of human placental chorionic plate-derived mesenchymal stem cells via regulating the phosphorylation of mTOR[J].JCellBiochem, 2013, 114(1): 79-88.
[8] Pantovic A, Krstic A, Janjetovic K,etal. Coordinated time-dependent modulation of AMPK/Akt/mTOR signaling and autophagy controls osteogenic differentiation of human mesenchymal stem cells[J].Bone, 2013, 52(1): 524-531.
[9] Coller HA, Sang L, Roberts JM. A new description of cellular quiescence[J].PLoSBiol, 2006, 4(3): e83.
[10]Frankel LB, Wen J, Lees M,etal. microRNA-101 is a potent inhibitor of autophagy[J].EMBOJ, 2011, 30(22): 4628-4641.
Research of autophagy activity between rat bone marrow mesenchymal stem neural differentiation
LI Bo1,3, HUANG Chun-tian2,3, LI Cai-fang2,3, DUAN Ping1,3, HAN Xue-fei3, YAN Wen-hai2,3△, XING Ying3,4△
(1. Department of Physiology, 2. Department of Pathophysiology, 3. Stem Cell Research Center, Zhengzhou University, Zhengzhou 450001;4. Department of Physiology, Xinxiang Medical University, Xinxiang 453003, China)
Objective: To study the autophagy activity between rat bone marrow stem cells (BMSCs) neural differentiation in order to explore the mechanism involve in this process. Methods: BMSCs were passed by 3 generation, then was induced with the revulsant 2% (DMSO)+200 μmol/L (BHA), NSE expression was detected by immunocytochemical stain, the mRNA expression of autophagy associated genes LC3B, Beclin1, Atg5, Atg7, Atg10 were detected by RT-PCR, the autophagy protein LC3B was examined by Western blot and flow cytometry analysis. Results: BMSCs were passed by 3 generation, the purity of BMSCs could reach more than 90%, the morphology of cells were like fibroblasts, after the revulsant 2% DMSO + 200 μmol/L BHA induced, cells were extended long neurites, like nerve cells, positive rate of NSE staining was (83±5)%, RT-PCR results showed that the expression of autophagy associated genes LC3B, Beclin1, Atg5, Atg7 Atg10 were rised after BMSCs neural differentiation, Western blot analysis showed that the LC3B-Ⅱ protein expression was increased after neural differentiation and the MFI of LC3B was highten by flow cytometry. Conclusion: Autophagy is increased after rat BMSC neural differentiation.
bone mesenchymal stem cells; autophagy; differentiation; neural cells; rat
国家自然科学基金资助项目(81171250,31100790)
2014-09-11 【修回日期】2014-11-21
Q28
A
1000-6834(2015)01-031-04
10.13459/j.cnki.cjap.2015.01.010
△【通讯作者】Tel: 0371-67739263; E-mail: Yanwh@zzu.edu.cn, Xingy@zzu.edu.cn

