青蒿琥酯抑制肝纤维化的作用及其机制*
杜 岩, 李立楠, 方步武
(天津医科大学基础医学院药理学教研室, 天津 300070)
青蒿琥酯抑制肝纤维化的作用及其机制*
杜 岩, 李立楠, 方步武△
(天津医科大学基础医学院药理学教研室, 天津 300070)
目的:探讨青蒿琥酯(Art)对人源肝星状细胞(LX-2)的作用。方法:样本为体外培养人源肝星状细胞,实验分为对照组及3个不同剂量的Art(250、350、450 μmol/L)组。四甲基偶氮唑盐法(MTT)检测LX-2的增殖情况,HPLC-FLD法检测LX-2上清中神经酰胺的含量,酶消化法测定羟脯氨(Hyp)的含量,Western blot法检测PPAR-γ、p53、Caspase 3蛋白在各组中的表达。结果:与对照组比较,不同浓度青蒿琥酯组对肝星状细胞增殖均有明显抑制作用,且呈剂量-效应关系(P<0.01);青蒿琥酯可提高神经酰胺的含量(P<0.01),同时各给药组羟脯氨酸的含量明显下降(P<0.05,P<0.01);与对照组比较,青蒿琥酯组PPAR-γ、p53、Caspase 3蛋白的表达上调(P<0.01)。结论:青蒿琥酯可能是通过上调神经酰胺,发挥抑制肝星状细胞增殖、促进其凋亡的作用。
青蒿琥酯; 肝纤维化; 神经酰胺; PPAR-γ; p53; Caspase 3
肝纤维化(hepatic fibrosis)是慢性肝损伤后组织修复过程的代偿反应,主要表现为肝星状细胞的增殖活化,活化的肝星状细胞增殖、分化、收缩、粘附能力均增强,胶原分泌增多,使细胞外基质的沉积与降解失衡,肝脏功能受到破坏[1]。肝纤维化的治疗途径主要有:(1)抑制炎症和免疫反应;(2)阻断受体信号通路;(3)抗氧化损伤;(4)抑制肝星状细胞的增殖与活化;(5)诱导肝星状细胞的凋亡等。其中抑制肝星状细胞的增殖活化,诱导其凋亡是肝纤维化研究的热点[2]。神经酰胺为细胞内的脂质第二信使分子[3],其与细胞的增长、分化、生长抑制和凋亡等活动有密切关系[4,5]。 神经酰胺在肿瘤细胞凋亡的调控作用中已有很多报道,其在抗肝纤维化中尚未见报道。青蒿琥酯是具有β-倍半萜内酯类青蒿素的衍生物,其抗疟作用强,并具有抗肿瘤、抗病毒、调节免疫等药理作用[6]。本课题组以往研究发现,青蒿琥酯具有保护肝脏的作用,能有效地抑制肝星性状细胞(hepatic stellate cells, HSCs)增殖、促进细胞凋亡、减少胶原生成,但作用机制尚需进一步研究。本研究以人源肝星状细胞株(LX-2)为研究对象,测定神经酰胺含量等的变化,分析青蒿琥酯对其增殖、活化及凋亡的作用,进一步探讨其抗肝纤维化的作用及机制。
1 材料与方法
1.1 材料
1.1.1 实验细胞 人源肝星状细胞株LX-2由北京市地坛医院提供。
1.1.2 药物及主要试剂 青蒿琥酯(artesunate,Art)(C19H28O8,Mr:384.42)由广西桂林南药股份有限公司赠与;DMEM与胎牛血清购自美国Gibico公司;邻苯二甲醛(OPA,色谱纯)、β-巯基乙醇(色谱纯)购自Sigma-aldrich公司;PPAR-γ抗体购自Santa cruz公司,Caspase 3 购自Cell signaling technology 公司,Bata-actin抗体购自碧云天生物技术研究所,羟脯氨酸检测试剂盒购自南京建成试剂公司。
1.1.3 仪器 恒温CO2培养箱(美国NAPCOseries 5400);680酶标仪(美国BIO-RAD公司);日本岛津高效液相色谱仪(LC-6A泵,SCL-6B系统控制箱;RF-535荧光检测器;Anastar色谱工作站),MSB010.CX2.5型台式高速离心机(SANYO)。
1.2 实验方法
1.2.1 实验设计及分组 将LX-2细胞置于10%胎牛血清的DMEM培养液中,5%CO2,37℃饱和湿度培养箱里培养,当其生长至80%融合时,弃去培养基,PBS冲洗3次,加入0.25%胰蛋白酶1 ml, 37℃消化1 min,按1∶3或1∶4进行细胞传代取对数生长期细胞进行后续实验。细胞实验分4组:(1)Control组:细胞对照组;(2)Art处理组:细胞用3个不同剂量Art(250、350、450 μmol/L)处理24 h。
1.2.2 MTT法检测Art对LX-2增殖的影响 取对数生长期细胞,0.25%胰蛋白酶消化制成单细胞悬液,以2×104cells/ml的密度接种于96孔板,每孔100 μl,细胞分别根据细胞实验设计进行处理,每组3个复孔。24 h孵育结束后,每孔加入MTT 10 μl,继续孵育4 h,将培养基倒尽、吸干,每孔加入二甲基亚砜 200 μl,混匀后置酶标仪中570 nm测定各孔吸光度值(A值),按以下公式计算细胞抑制率(inhibition rate,IR),抑制率(%)=[(对照组A值-实验组A值)/对照组A值]×100%。
1.2.3 HPLC-FLD法测定细胞培养上清中C2神经酰胺的含量 LX-2以2×104cells/ml的密度接种于96孔培养板,每孔100 μl,分别根据细胞实验设计进行处理,收集各实验组作用24 h后的细胞培养上清液,取100 μl细胞培养上清液,加入等量的乙腈,漩涡振荡混合均匀后,13 000 r/min离心3 min。吸取上清液,储存于4℃冰箱中,待测,测定方法参考文献[7](测定生物样本中神经酰胺含量的HPLC-FLD法)。
1.2.4 测定细胞培养上清液中羟脯氨酸含量 LX-2以 2×104cells/ml的密度接种于96孔板,每孔100 μl,分别根据细胞实验设计进行处理。收集各实验组作用24 h后的细胞上清液,按照羟脯氨酸测定试剂盒说明书进行操作(南京建成生物工程研究所提供)。计算公式:羟脯氨酸浓度(μg/ml)=(测定管吸光度-空白管吸光度)/(标准管吸光度-空白管吸光度)×标准管浓度(5 μg/ml)×样本测试前稀释倍数。1.2.5 Western blot检测PPAR-γ、p53及Caspase 3蛋白的表达 将LX-2细胞以密度为5×104cells/ml接种于6孔板,分别根据细胞实验设计进行处理,作用24 h后,裂解蛋白,使用BCA试剂盒检测所提蛋白的浓度(按试剂盒说明书操作)。蛋白变性后取30 μg上样,30%聚丙烯酰胺凝胶电泳,全湿式电转法将胶上的蛋白转移到硝酸纤维素膜上,转膜2 h,5%脱脂奶粉室温封闭2 h后,分别加入PPAR-γ(1∶500)、p53(1∶1 000)及Caspase 3(1∶1 000)一抗封袋,4℃摇床上过夜,TBST缓冲液振荡洗膜3次,每次10 min,加入稀释好的二抗(1∶1 000),室温孵育2 h,TBST缓冲液振荡洗膜3次,每次10 min。采用ECL化学发光试剂显色,再进行曝光。用Quantity One凝胶软件分析系统分析蛋白条带的光密度值。
1.3 统计学方法
2 结果
2.1 Art对HSCs LX-2增殖的影响
MTT检测结果表明:不同浓度的Art作用于LX-2细胞24 h,与对照组比较,细胞增殖抑制率增加且呈剂量依赖性,差异具有统计学意义(P<0.01,表1),说明Art能抑制LX-2细胞的增殖。


GroupInhibition(%)Control —Art250μmol/L30.57±1.48** 35053.01±2.45**## 45073.43±2.11**##△△
Art: Artesunate; HSCs: Hepatic stellate cells
**P<0.01vscontrol group;##P<0.01vsArt 250 μmol/L group;△△P<0.01vsArt 350 μmol/L group
2.2 Art对神经酰胺含量的影响
我们通过HPLC-FLD法测定细胞培养上清液中神经酰胺含量的变化,结果表明,Art处理LX-2细胞24 h后,与对照组比较,Art可呈剂量依赖性地升高神经酰胺的含量,差异具有统计学意义(P<0.01,表2)。
2.3 Art对羟脯氨酸含量的影响
Art处理LX-2细胞24 h后,羟脯氨酸测定试剂盒测定结果显示:各剂量组细胞上清液中的羟脯氨酸含量降低,且剂量越大,羟脯氨酸含量越低,差异具有统计学意义(P<0.05,P<0.01,表3)。

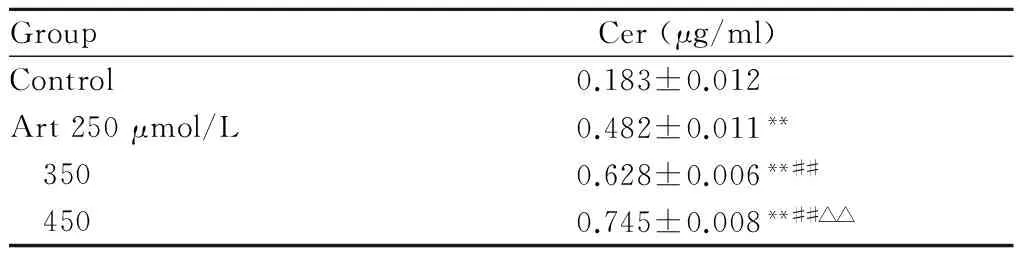
GroupCer(μg/ml)Control0.183±0.012Art250μmol/L0.482±0.011** 3500.628±0.006**## 4500.745±0.008**##△△
Art: Artesunate; HSCs: Hepatic stellate cells; Cer: Ceramide
**P<0.01vscontrol group;##P<0.01vsArt 250 μmol/L group;△△P<0.01vsArt 350 μmol/L group

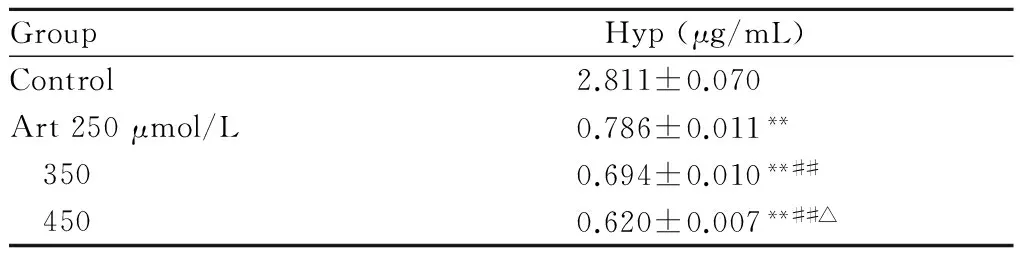
Group Hyp(μg/mL)Control2.811±0.070Art250μmol/L0.786±0.011** 3500.694±0.010**## 4500.620±0.007**##△
Art: Artesunate; Hyp: Hydroxyproline; HSCs: Hepatic stellate cells
**P<0.01vscontrol group;##P<0.01vsArt 250 μmol/L group;△P<0.05vsArt 350 μmol/L group
2.4 Art 对PPAR-γ、p53及Caspase 3蛋白表达的影响
Western blot检测结果显示,对照组及给药组均有PPAR-γ 、p53及Caspase 3蛋白的表达,对照组表达较少,不同剂量青蒿琥酯作用于LX-2细胞24 h后,PPAR-γ 、p53、Caspase 3蛋白表达上均明显高于对照组(P<0.01),且随着Art剂量的增加,PPAR-γ、p53及Caspase 3蛋白表达灰度值呈明显递增(P<0.01,表4)。
Tab. 4 Effect of Art on PPAR-γ,p53 and Caspase protein expression

GroupPPAR-γ/β-Actinp53/β-ActinCaspase3/β-ActinControl0.198±0.0360.277±0.0210.105±0.008Art250μmol/L0.509±0.021**1.025±0.066**0.778±0.014** 3501.273±0.036**##1.148±0.017**##1.017±0.027**## 4501.750±0.063**##△△1.364±0.035**##△△1.462±0.048**##△△
Art: Artesunate
**P<0.01vscontrol group;##P<0.01vsArt 250 μmol/L group;△△P<0.01vsArt 350 μmol/L group
3 讨论
肝纤维化是多种因素参与的复杂病理过程,具有可逆性。肝星状细胞的增殖与活化是肝纤维化发生和发展的关键环节[8]。研究发现青蒿琥酯能有效抑制大鼠原代肝星状细胞增殖及诱导其凋亡,但其具体作用机制鲜见研究。神经酰胺即N-脂酰鞘氨醇,作为脂质第二信使其参与多种信号通路,可调节细胞的生长、分化、凋亡及应急反应等,但有关神经酰胺在肝纤维化中的作用却鲜见报道。低分子量的神经酰胺(如神经酰胺C2)可透过细胞膜,所以测定细胞培养上清液中的神经酰胺C2含量可以显示出细胞内神经酰胺的变化,本实验采用高效液相法测定其含量,与对照组比较,不同浓度青蒿琥酯作用后LX-2培养上清中神经酰胺C2的含量增加,同时随着给药浓度的增加抑制LX-2增殖的作用也增强。实验结果表明青蒿琥酯可能是通过提高神经酰胺含量而抑制肝星状细胞的增殖。
过氧化物酶体增殖受体(PPAR-γ)是核受体家族成员之一,PPAR-γ 表达与HSC静止表型的维持有一定的关系,如体外培养人HSC细胞,随着HSC的激活,PPAR-γ 的表达显著下降[9]。用腺病毒转染PPAR-γ,结果PPAR-γ 能够抑制HSC的增殖,同时抑制活化的HSC表达α-SMA、Ⅰ型胶原[10]。近年来研究证实神经酰胺能抑制PPAR-γ 的表达,从而减少肝脏的脂肪病变[11]。神经酰胺能增加人肝癌细胞中PPAR-γ 的转录活性,使细胞周期阻滞,从而抑制肝癌细胞生长[12]。然而在肝纤维化中,神经酰胺对PPAR-γ 的潜在影响尚不清楚。本实验发现青蒿琥酯能呈剂量依赖性地提高神经酰胺的含量,同时也使PPAR-γ 表达呈剂量依赖性地增加,并且神经酰胺和PPAR-γ 在对肝星状细胞及肝癌细胞等增殖、活化的影响上有诸多类同,因此本研究结果初步探明了我们的设想青蒿琥酯可能通过干预神经酰胺-PPAR-γ 通路抑制LX-2细胞增殖。课题组前期研究还发现青蒿琥酯可增加p53 mRNA和蛋白表达,从而影响细胞周期,使其阻滞在G1期,同时还可以促进肝星状细胞凋亡[12], 但其与神经酰胺的关系并未指出,本研究中随着青蒿琥酯浓度的升高,神经酰胺含量增加,p53蛋白表达增加,凋亡执行效应分子Caspase 3激活,促进细胞凋亡。从而推测,青蒿琥酯可能是通过增加LX-2内的神经酰胺含量,促进肝星状细胞凋亡,从而减少了羟脯氨酸的含量,使肝纤维化减弱。
综上所述,青蒿琥酯能显著增加肝星状细胞LX-2内神经酰胺含量,提高PPAR-γ、p53及Caspase 3的表达,抑制LX-2细胞增殖,促进细胞凋亡。为青蒿琥酯抑制肝纤维化的作用及机制研究提供了一个新的思路,这一研究结果对肝纤维化的治疗有重要意义。
[1] Wallace K, Burt AD, Wright MC. Liver fibrosis[J].BiochemJ, 2008, 411(1): 1-18.
[2] Yin C, Evason K J, Asahina K,etal. Hepatic stellate cells in liver development, regeneration, and cancer[J].JClinInvest, 2013, 123(5): 1902-1910.
[3]Schiffmann S, Birod K, Mønnich J,etal. Ceramide metabolism in mouse tissue[J].IntJBiochemCellBiol, 2013, 45(8): 1886-1894.
[4] Grøsch S, Schiffmann S, Geisslinger G. Chain length-specific properties of ceramides [J].ProgLipidRes, 2012, 51(1): 50-62.
[5] Hannun YA, Obeid LM. Principles of bioactive lipid signalling: lessons from sphingolipids[J].NatRevMolCellBiol, 2008, 9(2): 139-150.
[6] Efferth T, Dunstan H, Sauerbrey A,etal. The anti-malarial artesunate is also active against cancer[J].IntJOncol, 2001, 18(4): 767-773
[7] 娄婷婷, 李英娴, 方步武, 等. 测定生物样本中神经酰胺含量的HPLC-FLD法[J]. 药物分析杂志, 2012, 32(10): 1807-1812.
[8] Friedman SL. Mechanisms of hepatic fibrogenesis[J].Gastroenterol, 2008, 134(6): 1655-1669.
[9] Marra F, Efsen E, Romanelli RG,etal. Ligands of peroxisome proliferator-activated receptor γ modulate profibrogenic and proinflammatory actions in hepatic stellate cells[J].Gastroenterol, 2000, 119(2): 466-478.
[10]Hazra S, Xiong S, Wang J,etal. Peroxisome proliferator-activated receptor γ induces a phenotypic switch from activated to quiescent hepatic stellate cells[J].JBiolChem, 2004, 279(12): 11392-11401.
[11]Li Y, Dong J, Ding T,etal. Sphingomyelin synthase 2 activity and liver steatosis: an effect of ceramide-mediated peroxisome proliferator-activated receptor γ2 suppression[J].ArteriosclerThrombVascBiol, 2013, 33(7): 1513-1520.
[12]Longxi P, Buwu F, Yuan W,etal. Expression of p53 in the effects of artesunate on induction of apoptosis and inhibition of proliferation in rat primary hepatic stellate cells[J].PloSOne, 2011, 6(10): e26500
Effects of Artesunate on hepatic fibrosis and its mechanism
DU Yan, LI Li-nan, FANG Bu-wu△
(Department of Pharmacology, Basic Medical College, Tianjin Medical University, Tianjin 300070, China)
Objective: To investigate the effects of Artesunate(Art) on the LX-2 cell. Methods: The cultured hepatic stellate cells were divided into control group and Art-treated groups with 250,350,450 μmol/L. The rate of cellular proliferation was detected by MTT assay, the content of ceramide (Cer)was determined by HPLC method, the content of hydroxyproline (Hyp) was determined by enzyme digestion method, the expressions of PPAR-γ, p53 and Caspase 3 were detected by Western blot. Results: Compared with control group, LX-2 treated with Art were inhibited in a concentration-dependent manner(P<0.01). Art could significantly increase the content of ceramide in LX-2 (P<0.01), and the content of Hyp was significantly decreased (P<0.05,P<0.01). The expressions of PPAR-γ, p53 and Caspase 3 were increased compared with that of control group(P<0.01). Conclusion: Artesunate could inhibit the proliferation and induce apoptosis of hepatic stellate cells through upregulating ceramide.
Artesunate; hepatic fibrosis; ceramide; PPAR-γ; p53; Caspase 3
国家自然科学基金资助项目(30772856)
2014-10-15 【修回日期】2014-11-07
R337.2
A
1000-6834(2015)01-014-04
10.13459/j.cnki.cjap.2015.01.005
△【通讯作者】Tel: 022-83336835; E-mail: fangdch@aliyun.com

