急性冷暴露对大鼠肺组织中促炎性因子表达的影响*
张 莹, 李 曦, 张 莉, 林阳生, 肖忠海, 宿 庄, 刘 颖, 杨丹凤△
(1. 内蒙古医科大学公共卫生学院, 呼和浩特 010059; 2. 军事医学科学院卫生学环境医学研究所, 天津 300050)
急性冷暴露对大鼠肺组织中促炎性因子表达的影响*
张 莹1,2, 李 曦2, 张 莉2, 林阳生2, 肖忠海2, 宿 庄1, 刘 颖1, 杨丹凤2△
(1. 内蒙古医科大学公共卫生学院, 呼和浩特 010059; 2. 军事医学科学院卫生学环境医学研究所, 天津 300050)
目的:观察急性冷暴露大鼠肺部炎症反应及病理学损伤的变化情况,探讨冷应激对肺损伤的可能机制。方法:40只雄性Wistar 大鼠随机分为5组(n=8),即对照组,-25℃ 0.5 h组、-25℃ 1 h组、-25℃ 2 h组和-25℃ 2.5 h组。除对照组外,其他各组均在温度为-25℃、无风的低温舱内暴露。在冷暴露前后分别测定直肠温度,冷暴露后取材在光镜下观察肺组织学变化,酶联免疫吸附实验检测肺组织匀浆中促炎性因子的表达。结果:在急性冷暴露后,与对照组相比,-25℃ 1 h组、-25℃ 2 h组和-25℃ 2.5 h组暴露前后体心温度明显降低,其差值升高(P<0.05)。-25℃ 2.5 h组肺组织学分析出现明显的炎性细胞浸润和肺泡内水肿液。-25℃ 1 h组、-25℃ 2 h组和-25℃ 2.5 h组肺组织匀浆中促炎性因子的浓度升高(P<0.05)。结论:急性冷暴露后,肺组织出现明显的炎性细胞浸润和促炎性因子水平增加,从而导致肺组织损伤。
急性冷暴露;肺;炎性反应;大鼠
呼吸道直接与外界相通,所以肺与外界环境接触极为密切。在严寒条件下,气温低、湿度低,机体吸入干冷的空气导致上、下呼吸道生理学改变,而使呼吸系统功能改变如呼吸急促、喘息、长期咳嗽或是咳嗽发作及粘液分泌物增多等[1]。在严寒地区及冬季,随着外界环境温度的降低,呼吸系统疾病的发病率和死亡率增加[2-6]。本文通过观察大鼠急性冷暴露后肺组织病理形态学及促炎性因子表达水平的改变,以进一步揭示急性冷暴露对肺组织损伤的可能机制。
1 材料与方法
1.1 实验材料
实验动物:健康雄性清洁级的Wistar大鼠(由军事医学科学院卫生学环境医学研究所提供)40只,体重180~220 g,饲以普通饲料,自由饮水。暴露前均在室温为(23±2)℃的SPF级动物房中适应4 d后进行实验。
主要实验试剂和仪器:12导人体温度测定仪器购自新加坡Eutech Instruments 有限公司;大鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素1β(interleukin-1β,IL-1β)、白介素6(IL-6)酶联免疫试剂盒购自武汉华美生物工程有限公司;酶标仪购自美国Thermo公司。
1.2 方法
1.2.1 实验分组及冷暴露方法 动物在实验前禁食12 h,不禁水。实验动物随机分为5组(n=8),冷暴露组置于温度为-25℃,风速为0 m/s的低温舱,暴露时间分别为0.5、1、2、2.5 h,每只动物均采用单笼暴露方式;对照组以相同方式暴露在(23±2)℃环境舱内2.5 h。
1.2.2 体心温度测定 所有实验大鼠在入舱前将测温探头蘸取少许甘油后,轻柔地插入大鼠肛门3 cm处,待数值稳定后读数。于不同时间的冷暴露后出舱立即测定直肠温度。
1.2.3 标本采集 实验结束24 h后,大鼠行10%水合氯醛腹腔注射麻醉,开胸取出肺脏,右肺中叶行4%中性甲醛固定,进行组织病理学观察。肺组织匀浆的制备:以每克肺组织加入10 ml生理盐水,在玻璃匀浆器中冰浴研磨制成10%肺组织匀浆,以3 500 r/min离心10 min,上清液分装贮存于-20℃。
1.2.4 肺组织匀浆TNF-α、IL-6、IL-1β浓度测定 采用酶联免疫吸附法,严格按照试剂盒说明书进行操作。
1.3 统计学处理

2 结果
2.1 急性冷暴露对大鼠体心温度的影响
暴露前各冷暴露组与对照组及冷暴露组之间体心温度无差别。大鼠在-25℃的寒冷温度暴露后,随着暴露时间的延长,与暴露前相比,各实验组暴露后的体心温度均降低且差异显著(P<0.05)。与对照组相比,-25℃ 1 h、2 h和2.5 h组暴露前后体心温度的差值升高,差异显著 (P<0.05);与-25℃1 h组相比,-25℃ 2 h和2.5 h组暴露前后体心温度的差值显著升高(P<0.05 ,表1),结果表明冷暴露时间愈长,体心温度降低愈严重。


GroupBefore After Control37.91±0.4237.58±0.45-25℃0.5h37.96±0.3036.43±0.82*▲-25℃1h37.84±0.5335.83±0.88*▲-25℃2h37.83±0.5432.66±2.31*#△▲-25℃2.5h37.88±0.3726.38±5.05*#△▲
*P<0.05vscontrol group;#P<0.05vs25℃ 0.5 h group;△P<0.05vs25℃ 1 h group;▲P<0.05vsbefore cold exposure in the same group
2.2 各组肺组织病理学改变
光镜下,对照组肺泡结构清晰、扩张均匀,肺泡壁薄,肺泡壁及间质内无明显的水肿、出血及炎性细胞浸润。-25℃ 0.5 h、-25℃ 1 h、-25℃ 2 h和-25℃ 2.5 h组均为肺中度间质性炎症,出现不同程度的肺泡间隔增宽,单核细胞浸润,肺泡扩张和塌陷及肺泡内含有水肿液。-25℃ 2.5 h组有些区域肺实变为重度炎症,大量炎细胞浸润,有的肺泡内充满分叶核白细胞或吞噬细胞,支气管内也可见充有炎细胞和吞噬细胞(图1,见彩图页Ⅱ),表明冷暴露时间愈长,肺组织损伤愈严重。
2.3 各组肺组织细胞因子浓度的变化
与常温对照组相比,-25℃1 h、2 h及2.5 h组TNF-α和IL-6水平均显著升高,TNF-α水平-25℃ 1 h、2 h及2.5 h组均高于-25℃ 0.5 h组(P<0.05)-25℃ 2 h组,2.5 h组IL-6水平明显高于-25℃ 0.5 h及1 h组,-25℃ 2 h和2.5 h组IL-1β水平明显高于常温对照组(P<0.05,表2)。结果表明随着冷暴露时间愈长,肺组织细胞促炎性因子水平升高。

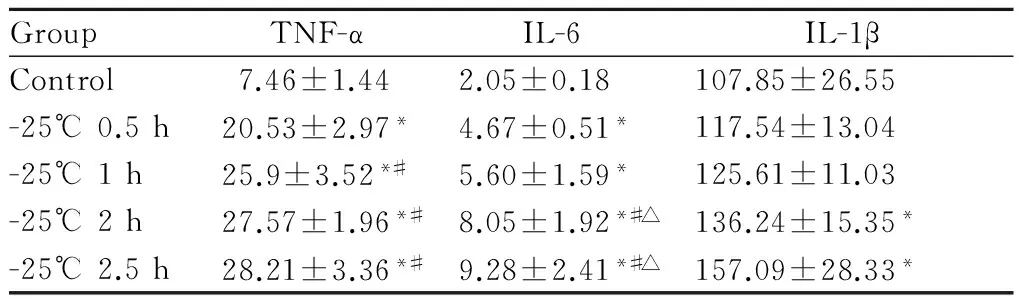
GroupTNF-αIL-6IL-1βControl7.46±1.442.05±0.18107.85±26.55-25℃0.5h20.53±2.97*4.67±0.51*117.54±13.04-25℃1h25.9±3.52*#5.60±1.59*125.61±11.03-25℃2h27.57±1.96*#8.05±1.92*#△136.24±15.35*-25℃2.5h28.21±3.36*#9.28±2.41*#△157.09±28.33*
TNF-α: Tumor necrosis factorα: IL: Interleukin
*P<0.05vscontrol group;#P<0.05vs25℃ 0.5 h group;△P<0.05vs-25℃ 1 h group
3 讨论
低温引起的呼吸系统症状和肺功能障碍可能导致明显的冬季作业能力降低。在寒冷环境下,反射性地鼻和上呼吸道的血管收缩,抑制呼吸系统的防御功能并且使亚临床症状的病毒性感染转变为有症状的临床感染[7]。肺泡巨噬细胞的吞噬功能降低,以致清除细菌的能力大为减退,这种变化使上呼吸道“自身菌”侵入下呼吸道的机会增加[8]。过度吸入冷空气,导致气道表面液体蒸发,从而形成干燥和高渗状态,而在易感个体可以直接造成气道上皮的损伤;气道表面液体的高渗状态,引起嗜酸性细胞或是肥大细胞的释放,如白三烯、前列腺素和组胺等介质,增加血管的通透性,引起上皮损伤[9]。当体心温度降至35℃以下时称为低体温,常被分为轻、中、重度三类,轻度体心温度为35℃~32℃,中度体心温度32℃~28℃,重度体心温度<28℃[10]。本研究结果显示,-25℃ 2 h和-25℃ 2.5 h组在急性冷暴露之后体心温度下降,分别达到中度和重度的水平而出现肺组织损伤,且随冷暴露程度而加重。因纤毛功能的损伤,保护性气道反应降低,这样倾向于肺炎的发生[10],有可能在这一条件下增加呼吸系统疾病的易感性。
急性冷暴露于冷空气中导致下呼吸道的炎性细胞(粒细胞和巨噬细胞)数目增多[11],本实验的组织学结果显示在-25℃ 2 h组出现了大量炎性细胞的浸润。而在不同的暴露时间条件下,其肺组织病检出现单核细胞的浸润,寒冷刺激增加单核细胞的募集,可能是由明显的交感神经兴奋介导,单核细胞的激活与许多介质的释放有关,特别是细胞因子的释放[12,13],募集单核细胞和中性粒细胞这类炎性细胞到呼吸道是宿主遇到外界有害因素的防御反应,但是过多的炎性细胞可以释放弹性蛋白酶和氧自由基,引起肺组织的损伤。
从-25℃ 1 h及以后的寒冷暴露组可以看出,随冷暴露时间的延长,大鼠肺组织匀浆中TNF-α和IL-6的浓度持续升高,这些炎性因子直接募集中性粒细胞或是激活肺泡上皮细胞释放黏附分子来增加中性粒细胞的浸润。其他实验也显示冷暴露刺激单核细胞分泌促炎性因子,例如IL-1,TNF-α和IL-6这些炎性因子的浓度升高[14]。TNF-α对多形中性粒细胞和单核细胞有趋化作用,增强中性粒细胞、单核细胞和淋巴细胞与血管内皮细胞之间的黏附,肺微血管内皮细胞的通透性增强,它还可刺激单核/巨噬细胞产生IL-1β和IL-6,引起放大和连锁效应,即瀑布效应。IL-6主要由单核巨噬细胞为主的免疫活性细胞分泌,具有促进炎症反应的作用,增强白细胞的聚集、迁移至局部损伤部位,导致组织炎性细胞的浸润,加重肺损伤。IL-1β是肺损伤中另一具有重要作用的介质。其诱导肺损伤的可能机制:(1)增加血管内皮通透性。(2)协同TNF-α,加重TNF-α诱发的肺损伤。(3)诱导粒细胞在肺内聚集,对粒细胞具有趋化和激活作用[15]。经非炎性或是炎性媒介的激活,单核细胞随后释放许多的细胞因子,包括TNF-a, IL-1β, IL-6, and IL-1 receptor antagonist(IL-1ra),在组织损伤过程中,许多的炎性因子调节单核细胞对内皮细胞的黏附和随后的跨内皮细胞的迁移[16]。这些炎性细胞和炎性介质的相互作用,造成内皮细胞的损伤,毛细血管通透性增加,导致肺间质性肺水肿,肺泡上皮屏障破坏,从而造成肺组织损伤。
综上所述,本实验表明,在急性寒冷应激之后,暴露时间愈长,肺组织出现炎性细胞的浸润和肺泡内水肿液的增加更加明显,而且肺组织中促炎性因子水平显著升高,从而对肺组织造成损伤,导致呼吸系统疾病的发生。
[1] Makinen TM, Hassi J. Health problems in cold work[J].IndHealth, 2009, 47(3): 207-220.
[2] Falagas M E, Theocharis G, Spanos A,etal. Effect of meteorological variables on the incidence of respiratory tract infections[J].RespirMed, 2008, 102(5): 733-737.
[3] Jaakkola K, Saukkoriipi A, Jokelainen J,etal. Decline in temperature and humidity increases the occurrence of influenza in cold climate[J].EnvironHealth, 2014, 13(1): 22.
[4] The Eurowinter Group. Cold exposure and winter mortality from ischaemic heart disease, cerebrovascular disease, respiratory disease, and all causes in warm and cold regions in Europe[J].Lancet, 1997, 349(9062): 1341-1346.
[5] Analitis A, Katsouyanni K, Biggeri A,etal. Effects of Cold Weather on Mortality: Results From 15 European Cities Within the PHEWE Project[J].AmJEpidemiol, 2008, 168(12): 1397-1408.
[6] Guo YM, Punnasiri K, Tong SL. Effects of temperature on mortality in Chiang Mai city, Thailand: a time series study[J].EnvironHealth, 2012, 11: 36.
[7] Makinen TM, Juvonen R, Jokelainen J,etal. Cold temperature and low humidity are associated with increased occurrence of respiratory tract infections[J].RespirMed, 2009, 103(3): 456-462.
[8] 傅 珏, 朱清仙. 极端环境温度变化致肺脏结构及免疫功能损伤的研究[J]. 南昌大学学报(医学版), 2011, 51(06): 85-88.
[9] Koskela HO. Cold air-provoked respiratory symptoms: The mechanisms and management[J].IntJCircumpolarHealth, 2007, 66(2): 91-100.
[10]Mallet ML. Pathophysiology of accidental hypothermia[J].QJM, 2002, 95(12): 775-785.
[11]Larsson K, Tornling G, Gavhed D,etal. Inhalation of cold air increases the number of inflammatory cells in the lungs in healthy subjects[J].EurRespirJ, 1998, 12(4): 825-830.
[12]Jansky L, Pospísilová D, Honzová S,etal. Immune system of cold-exposed and cold adapted humans[J].EurJApplPhysiolOccupPhysiol, 1996, 72(5-6): 445-450.
[13]Brenner IK, Castellani JW, Gabaree C,etal. Immune changes in humans during cold exposure: effects of prior heating and exercise[J].JApplPhysiol, 1999, 87(2): 699-710.
[14]Shirai T, Magara KK, Motohashi S,etal. T(H)1-biased immunity induced by exposure to Antarctic winter[J].JAllergyClinImmunol, 2003, 111(6): 1353-1360.
[15]邱海波, 潘家绮, 赵永强, 等. 肿瘤坏死因子α、白细胞介素1β和巨噬细胞炎性蛋白1α在感染及器官损伤中的作用及治疗探讨[J]. 中国危重病急救医学, 1996, (03): 13-16,64.
[16]van Furth R. Human monocytes and cytokines[J].ResImmunol, 1998, 149(7-8): 719-720.
Effects of acute cold exposure on pulmonary proinflammatory cytokine of rat
ZHANG Ying1,2, LI Xi2, ZHANG Li2, LIN Yang-sheng2, XIAO Zhong-hai2,SU Zhuang1, LIU Ying1, YANG Dan-feng2△
(1. Department of Public Health,Inner Mongolia Medical University, Hohhot 010059; 2. Institute of Health and Environmental Medicine, Academy of Military Medical Sciences, Tianjin 300050, China)
Objective: To study the effects of acute cold exposure on the inflammation and pathologic injuries in pulmonary of rats, and explore the mechanism induced by cold stress. Methods: Forty male Wistar rats were randomly divided into five groups(n=8): control group(23±2)℃ 2.5 h, -25℃ 0.5 h group, -25℃ 1 h group, -25℃ 2 h group and -25℃ 2.5 h group. Rats were exposed to cold at -25℃and no wind by keeping them in a low temperature chamber except control group. Rectal temperatures of the rats were measured before and after cold exposure. The morphological changes of pulmonary were observed by the optics microscope. The levels of tumer necrosis factor-α(TNF-α), interleukin-6 (IL-6) and interleukin-1β (IL-1β) in lung tissue homogenate were measured by ELISA. Results: Compared to the control group, body core temperatures of the -25℃1 h group, -25℃2 h group and -25℃2.5 h group were decreased significantly, and the D-values of rectal temperature were increased before and after cold exposure (P<0.05). The infiltration of inflammatory cells and alveolar edema fluid appeared in the lung tissue of the -25℃2.5 h group. The concentrations of tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6) and interleukin-1β (IL-1β) in lung tissue homogenate were increased significantly in -25℃1 h group, -25℃2 h group and -25℃2.5 h group (P<0.05). Conclusion: The infiltration of inflammatory cells and the increase in proinflammatory cytokine from pulmonary may lead to the lung tissue injury after acute cold exposure.
acute cold exposure; lung; inflammation response; rat
2011ZXJ09105-03B
2014-09-23 【修回日期】2014-11-12
R337.2
A
1000-6834(2015)01-006-04
10.13459/j.cnki.cjap.2015.01.002
△【通讯作者】Tel: 022-84655058; E-mail: fengdyd@126.com

