裙带菜中岩藻黄质的提取纯化工艺研究
周卫松,杨 艳,2,刘明社
(1.宁波天宏生物科技有限公司,浙江宁波 315800;2.中北大学,山西太原 030051)
裙带菜中岩藻黄质的提取纯化工艺研究
周卫松1,杨 艳1,2,刘明社1
(1.宁波天宏生物科技有限公司,浙江宁波 315800;2.中北大学,山西太原 030051)
本实验以裙带菜为原料提取岩藻黄质,通过单因素实验分析,并正交实验对提取条件进行工艺优化,最后采用硅胶柱层析做进一步的分离纯化。实验结果表明,经过预处理后的裙带菜原料,加入12倍的提取溶液,95%丙酮浸提2.5h,提取3次,效果较好。提取后的浸提液经超滤除渣,硅胶柱层析,最终岩藻黄质含量可由原来的2.31%提高到24.2%,回收率达90.9%。
裙带菜,岩藻黄质,高效液相色谱法,柱层析
裙带菜属于褐藻门翅藻科植物,营养价值高,是海洋主要经济藻类之一,外观形态如图1。

图1 裙带菜形态Fig.1 Undaria pinnatifida botanical morphology
岩藻黄质(fucoxanthin)又名岩藻黄素、褐藻黄素,属于类胡萝卜素中的叶黄素类脂溶性色素,具有良好的抗氧化作用,及抗肿瘤活性[1]、减肥、神经细胞保护等多方面的作用[2-3]。日本北海道大学研究人员通过小鼠实验发现,岩藻黄质可以通过两种方式消除脂肪堆积:激活被称为UCP1蛋白,这种蛋白可以促进脂肪分解;刺激肝脏生成降低胆固醇水平的DHA[4]。岩藻黄质分子式:C42H58O6,结构式如图2,不溶于水,溶于某些有机溶剂,如三氯甲烷、正已烷、石油醚等。在偏酸性溶液、弱光和低温下比较稳定;在弱酸、弱碱条件下,发生颜色可逆变化;在强碱、强光或高温条件下则被破坏[5]。
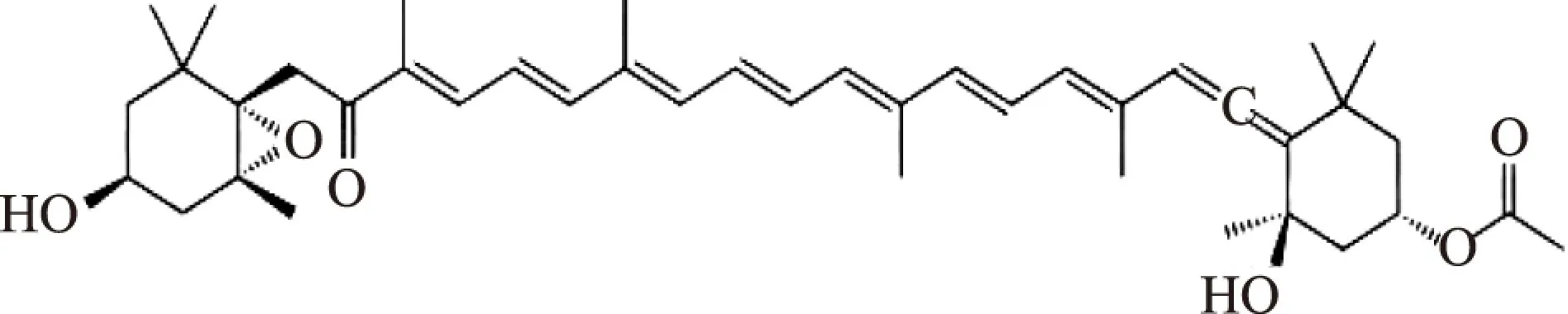
图2 岩藻黄质(Fucoxanthin)结构式Fig.2 Chemical structure of fucoxanthin
目前国内岩藻黄质的生产销售企业主要集中在北京、宁波及陕西三地。不同货源产品质量良莠不齐,价格也相差非常大。根据最新的市场调研,目前国内市场能供应合格产品的公司不超过3家,国际市场也不超过8家,其中日本是走在最前列的。一般而言,合格产品10% UV岩藻黄质价格在USD 140/kg左右,1% HPLC、5% HPLC更分别高达USD 570/kg、USD 3000/kg,经济价值相当可观。
本实验参考国内外相关文献,结合岩藻黄质的化学特性,采用高效液相色谱探索建立准确高效简便的岩藻黄质分析方法,并通过单因素及正交实验分析,确定裙带菜中岩藻黄质的最佳提取工艺,最后通过硅胶柱层析,达到进一步的纯化目的,该工艺所得产品完全能符合当前国内外市场的要求。
1 材料与方法
1.1 材料与仪器
岛津LC-20AT高效液相色谱仪 日本岛津公司;岛津SPD-20A紫外检测器 日本岛津公司;电子分析天平 瑞士Mettler-Toledo公司;SK1200H型超声波清洗器 上海科导超声仪器有限公司;SY-5000型旋转蒸发仪 上海亚荣生化仪器厂;SHZ-Ⅲ型真空泵 上海亚荣生化仪器厂;SZ-97型自动纯水蒸馏器 上海亚荣仪器厂;DHG-9070型数显恒温水浴锅 上海精宏实验设备有限公司,LGJ-18实验型冷冻干燥机 北京松源华兴科技发展有限公司。
岩藻黄岩藻黄质对照品 购于Sigma公司,纯度大于98%。
裙带菜 宁波天宏生物公司提供,产于浙江舟山群岛。
甲醇为色谱纯 SPECTAUM,乙腈为色谱纯SPECTAUM;水为重蒸水;其余试剂均为分析纯。
1.2 裙带菜岩藻黄质含量的高效液相色谱测定方法
岩藻黄质的检测方法,目前主要有UV和HPLC两种,UV方法原理是,将岩藻黄质样品溶于复合有机溶剂中,充分溶解,完全过滤后,通过记录比对450nm波长吸光度进行定量。由于通常岩藻黄质样品自身含有大量的杂色素,而UV法前处理过程又过于简单,没有对杂色素的干扰采取任何相应的预处理措施,因此存在很大的局限性。本研究建立了高效快捷的HPLC检测方法,后续提取纯化部分也均以HPLC检测数据为依据。
1.2.1 色谱条件 色谱柱Shim-pack VP-ODS C18(5μm,250mm×4.6mm);流动相为乙腈-磷酸溶液(90∶10);流速设定1.0mL·min-1;柱温35℃;检测波长取450nm。
1.2.2 对照品溶液的制备 精密称取岩藻黄质标准品2.02mg,加甲醇制成100mL岩藻黄质标准溶液,0.45μm有机膜滤过,取滤过液,即得。
1.2.3 供试品溶液的制备 称取裙带菜提取物适量,精密称定,置50mL量瓶中,加甲醇超声使溶解并稀释至刻度,0.45μm有机膜滤过,取滤过液,即得。
1.2.4 测定方法 精密吸取上述供试品溶液和对照品溶液各20μL,分别注入液相色谱仪,记录色谱图。按外标法计算样品的含量。
1.2.5 岩藻黄质样品含量计算公式:
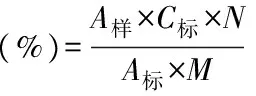
式中:A样-样品峰面积;A标-标准品峰面积;C标-标准品浓度(g/mL);N-稀释倍数(mL);M-样品称量(g)。
1.2.6 岩藻黄质的得率计算公式:

式中:C浸提液-浸提液浓度(g/mL);V浸提液-浸提液体积(mL);M药材-提取药材称量(g)。
1.3 裙带菜提取岩藻黄质单因素分析
实验以岩藻黄质得率为响应值,选取影响裙带菜岩藻黄质提取的溶剂比、提取温度、时间、液料比等进行单因素实验。
1.3.1 不同提取溶剂的影响 分别取60%乙醇、75%乙醇、85%乙醇、95%乙醇、无水乙醇、石油醚、三氯甲烷、乙酸乙酯、甲醇、丙酮十种溶剂为考察对象,称取裙带菜原料50g,料液比为1∶10,置于40℃恒温水浴锅中加热2h,提取2次,浸提液过0.45μm微孔滤膜,HPLC测定,记录相应的峰面积,计算岩藻黄质的得率。
1.3.2 温度的影响 分别以20、30、40、50、60(热回流)、70℃(热回流)五个水平釜内温度为考察对象,提取溶剂为丙酮,称取裙带菜原料50g,料液比1∶10,提取2h,共2次,浸提液过0.45μm微孔滤膜,HPLC测定,记录相应的峰面积,计算岩藻黄质的得率,
1.3.3 料液比的影响 称取裙带菜原料50g,采用料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25、1∶30六个水平为考察对象,丙酮为提取溶剂,50℃水浴,按照上述同样方法进行单因素实验,
1.3.4 提取时间的影响 以丙酮为提取溶剂,裙带菜原料50g,料液比为1∶10,置于50℃恒温水浴锅中,提取2次,采用加热1、2、3、4、5、8h六个水平为考察对象,按照上述同样方法进行单因素实验,
1.4 岩藻黄质提取工艺正交实验
综合分析单因素实验中各因素影响,选取丙酮浓度、料液比、浸提时间和温度做4因素3水平正交实验,确定最佳提取工艺。
1.5 硅胶柱层析法纯化岩藻黄质
1.5.1 TLC法定性分析 吸取一定量裙带菜提取岩藻黄质溶液,点样于硅胶G板右侧,同时取岩藻黄质标准溶液,点样于左侧。石油醚-乙酸乙酯体系(80∶20,60∶40)和正己烷-乙醚体系(85∶15,80∶20)分别作展开剂。由于类胡萝卜素本身具有非常明显的颜色,可以无需喷显色剂而直接收集不同的色带进行光谱分析。
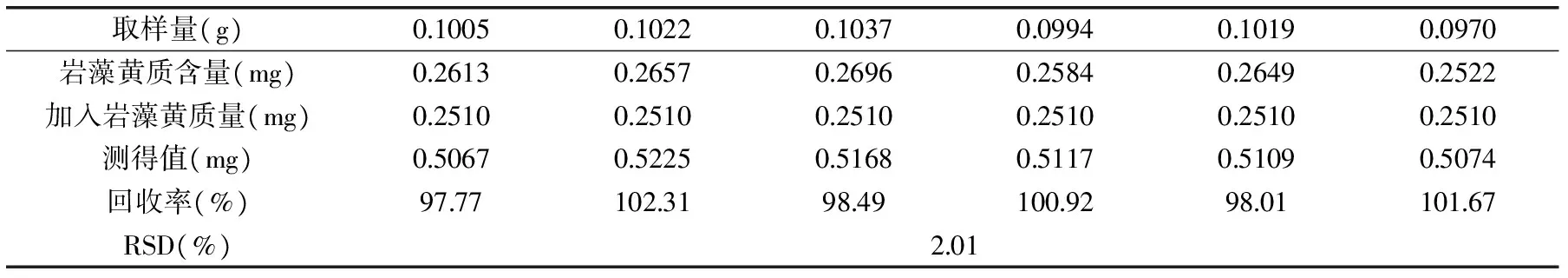
表1 加样回收率实验Table 1 Recovery experiments
1.5.2 硅胶柱的预处理 称取一定量的200目硅胶放在烧杯里,在110℃下烘干4h,室温静置,冷却,干法装入层析柱(内径×高度:30mm×600mm)中,压紧。加入洗脱剂,高于液面2~3cm,平衡,静置。
1.5.3 层析条件的优化 取岩藻黄质粗提样品溶液(含量为0.5%),硅胶为固定相,正己烷-乙醚(85∶15)为洗脱剂。在室温范围内考察洗脱剂流速、进样量等因素对硅胶层析分离效果的影响。
保持相关条件不变,改变层析时洗脱剂流速。洗脱剂流速在0.2BV·h-1时,含量和回收率都相对较低,分离时间长;流速1.8BV·h-1时,平均含量较低,洗脱剂消耗量大,色带拖长。一般而言,流速如果偏低,轴向扩散影响会变大,层析效果就会较差;而流速如果偏大,两相间深度难以达到分配平衡,也会使分离效果变差。
2 结果与分析
2.1 岩藻黄质HPLC标准工作曲线的建立
根据1.2岩藻黄质HPLC方法,分析对照品及裙带菜提取物色谱图见图3和图4,此色谱条件下岩藻黄质分离度良好。
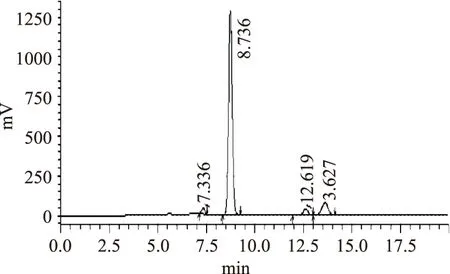
图3 岩藻黄质对照品HPLC图谱Fig.3 Chromatogram of fucoxanthin standard sample

图4 裙带菜提取样品的HPLC图Fig.4 Chromatogram of Undaria pinnatifida extract sample
分别精密吸取岩藻黄质对照品溶液2.0、5.0、8.0、12.0、15.0、20.0μL进行测定,以峰面积为纵坐标,进样量为横坐标,绘制标准曲线,如图5。
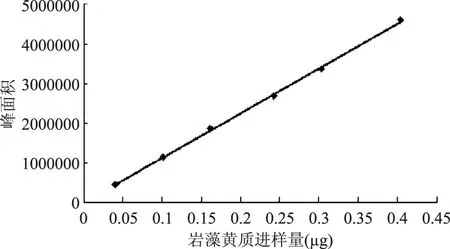
图5 岩藻黄质HPLC标准曲线Fig.5 HPLC standard curve of fucoxanthin
得回归方程为Y=1.1×107X+2038,R2=0.9996;表明岩藻黄质在0.040~0.400μg范围内进样量与峰面积呈良好线性关系。
2.2 岩藻黄质HPLC含量检测的方法学考察
2.2.1 精密度实验 取对照品溶液,按以上色谱条件于同一时间内重复进样5次,测定峰面积,结果RSD为1.49%(n=5)。
2.2.2 稳定性实验 取对照品溶液,按以上色谱条件每隔一定时间进样1针,测定峰面积,结果在20h内供试品溶液峰面积RSD为1.98%。表明供试品溶液在20h内基本无变化,稳定性良好。
2.2.3 重现性实验 取同一批号供试品样品,按供试品制备方法制备5份供试液,测定岩藻黄质的峰面积,并计算岩藻黄质的含量和相对标准偏差。
2.2.4 加样回收率实验 精密称取5份已知岩藻黄质含量的海带提取物粉末各0.2g,分别精密加入岩藻黄质对照品溶液(0.042mg·mL-1)1.0mL,制备供试品溶液,进样量10μL,测定岩藻黄质峰面积,计算岩藻黄质的含量并计算加样回收率,结果见表1。
2.3 裙带菜提取岩藻黄质单因素分析
2.3.1 不同提取溶剂对岩藻黄质得率的影响 如图6。实验结果表明,丙酮的提取效果最佳,提取2次,得率可达到0.072%,其次是95%乙醇,得率为0.036%。石油醚效果最差[7-8]。

图6 不同提取溶剂Fig.6 Different extraction solvent
2.3.2 温度对岩藻黄质得率的影响 如图7。高温有利于岩藻黄质的加速溶出。然而岩藻黄质属于类胡萝卜素,加热条件下稳定性较差,易发生几何异构。同时丙酮的沸点为56℃,浸提温度在50℃时溶剂挥发严重,60℃以上则必须引入热回流装置。因此,综合考虑浸提温度宜控制在40~60℃范围比较好。
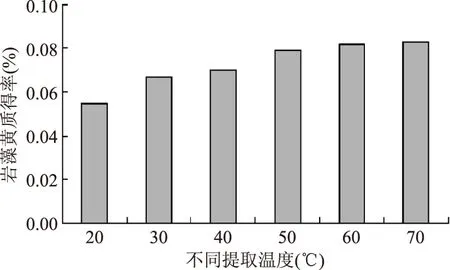
图7 不同提取温度Fig.7 Different extraction temperature
2.3.3 料液比的影响 如图8。实验结果表明,随着料液比的增大,岩藻黄质得率逐渐升高,至料液比超过1∶15后,岩藻黄质得率增加趋于平缓。考虑到实际生产中的溶剂消耗及其成本,1∶10左右的料液比可能更加适宜。
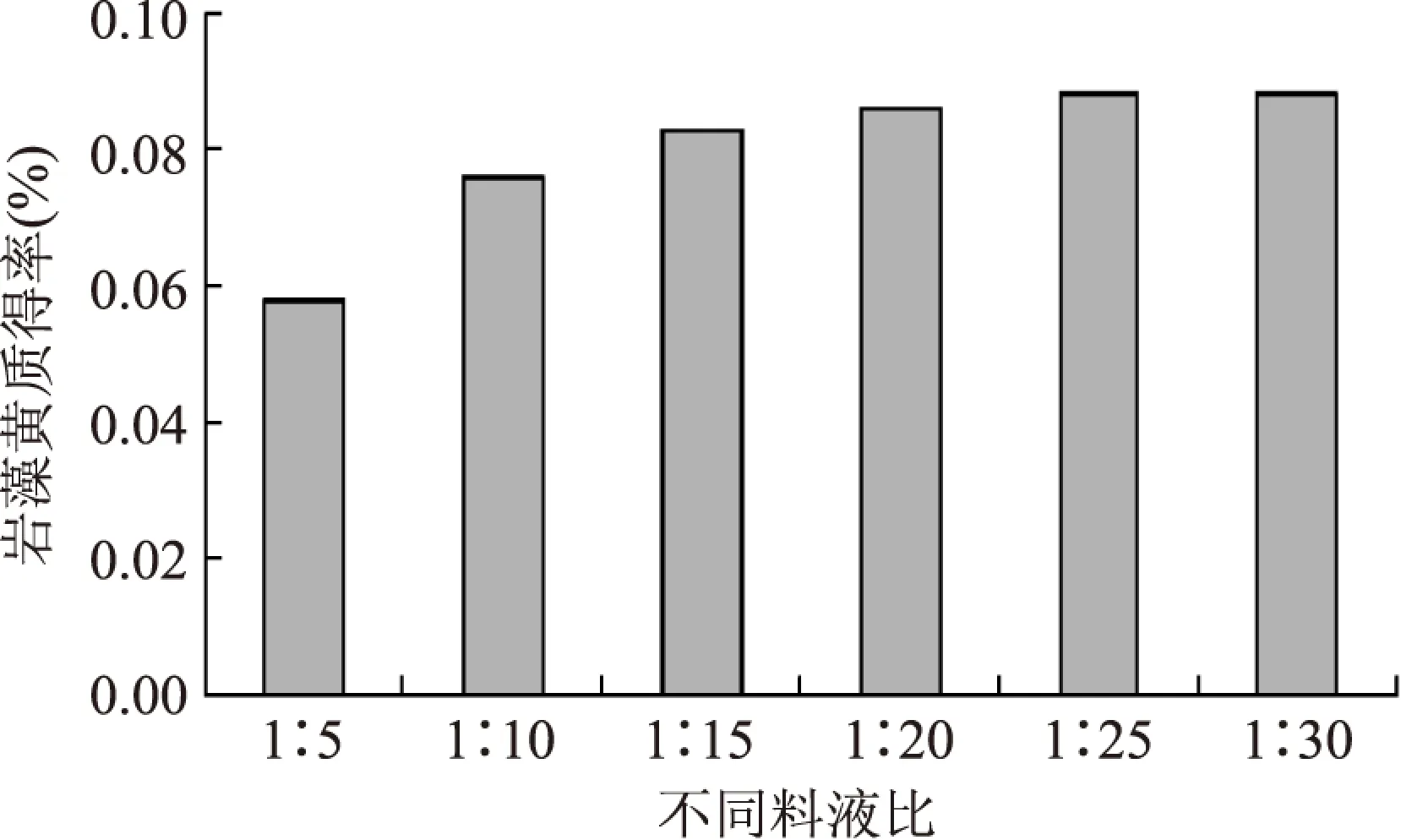
图8 不同料液比Fig.8 Different ratio of material to liquid
2.3.4 提取时间对岩藻黄质得率的影响 如图9。随着提取时间的延长,岩藻黄质得率增大,但变化不明显,超过2.0h后趋于平缓。
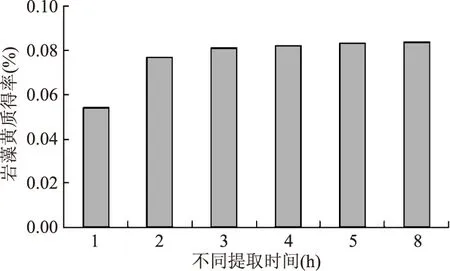
图9 不同提取时间Fig.9 Different extraction time
2.4 岩藻黄质提取工艺正交实验
综合考虑各单因素影响,做4因素3水平正交实验,见表2。
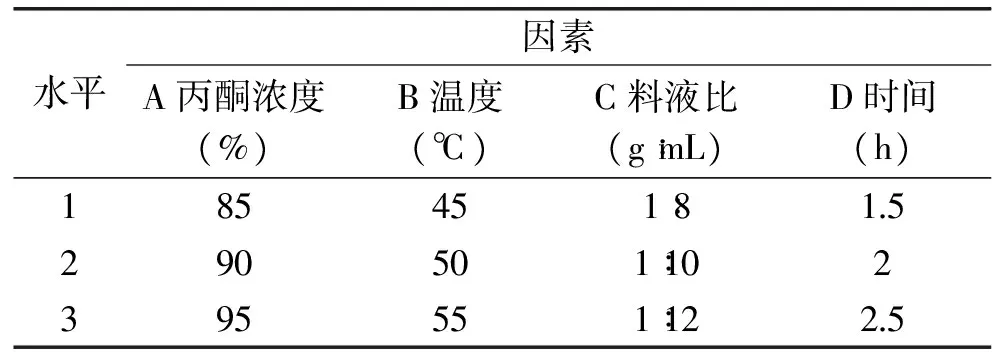
表2 正交实验设计的各因素与水平Table 2 Factors and levels in orthogonal test
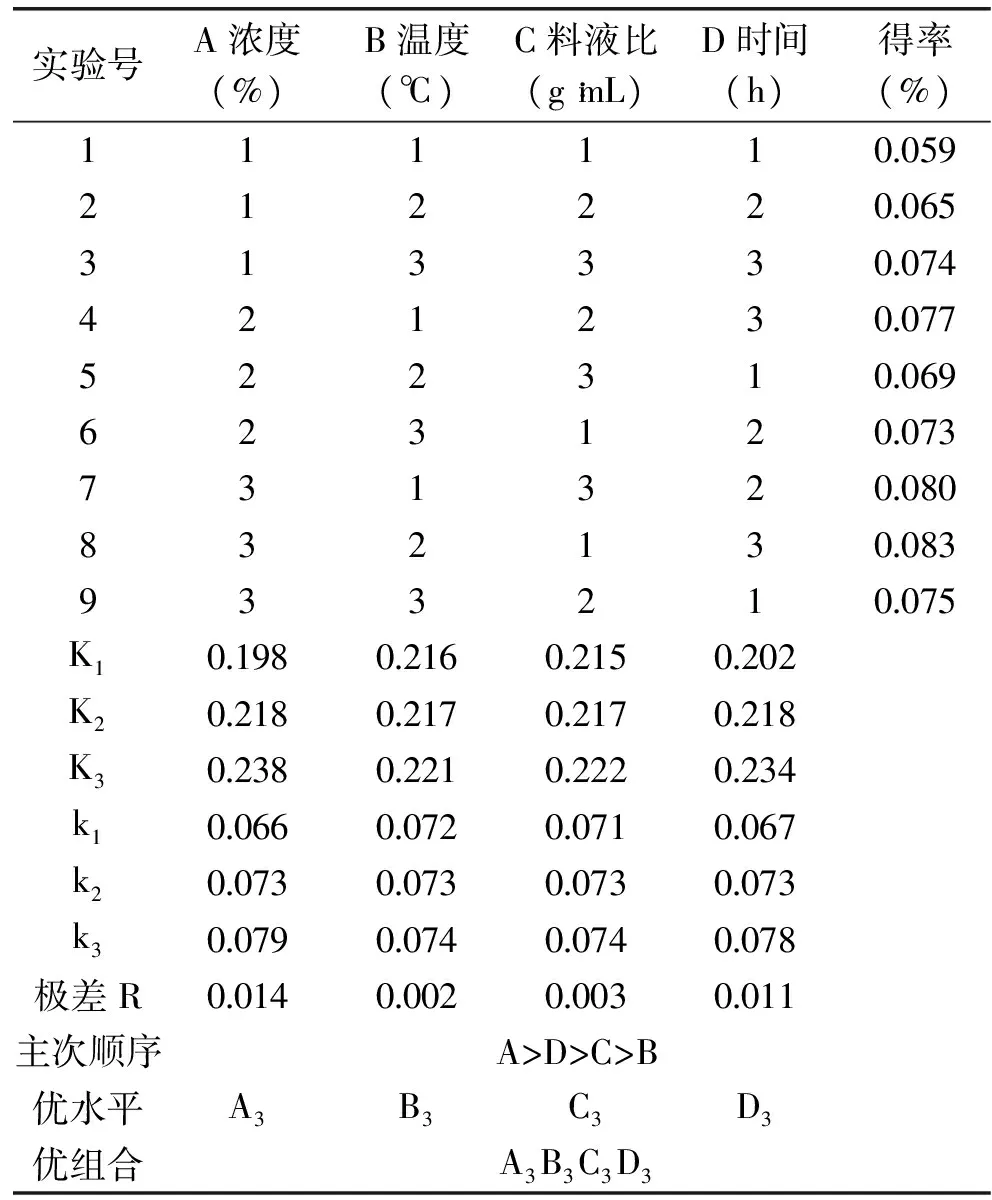
表3 正交实验提取裙带菜中岩藻黄质方案和结果Table 3 Orthogonal test method and result of fucoxanthin extraction from Undaria pinnatifida
由正交实验分析,理论最优组合为A3B3C3D3,即丙酮浓度95%,浸提温度55℃(引入热回流装置),料液比为1∶12,浸提时间为2.5h。在此条件下做验证实验,得率为0.088%,样品进行HPLC色谱分析,即每100g裙带菜可提取岩藻黄质粗品3.82g,含量为2.31%。
2.5 硅胶柱层析法纯化岩藻黄质
2.5.1 TLC法定性分析 如图10。4份薄层板中,左侧均为岩藻黄质标准品色谱带,右侧为裙带菜提取样品色谱带,可以非常清晰地观察到提取样品中岩藻黄质的位置。
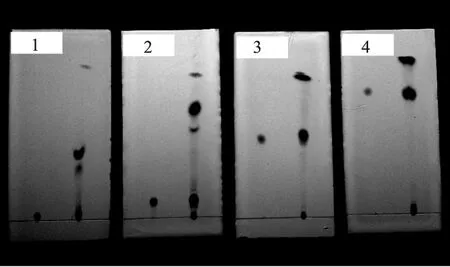
图10 不同展开剂的TLC层析图谱Fig.10 TLC chromatogram from different developing solvent注:1.石油醚∶乙酸乙酯=80∶20;2.石油醚∶乙酸乙酯=60∶40; 3. 正己烷∶乙醚=85∶15,4. 正己烷∶乙醚=80∶20。
分析TLC图谱,记靠近岩藻黄质斑最近的上侧斑为A,靠近岩藻黄质斑最近的下侧斑为B,分别计算Rf值,如表4。
TLC层析显示石油醚-乙酸乙酯和正己烷-乙醚两种洗脱剂的薄层层析比移值差别非常大。一般来讲,在选择洗脱剂时,既要保证溶质适当的溶解性,又要考虑其选择性。因此,根据岩藻黄质斑的Rf值和组分斑点之间的相对距离,很容易筛选出正己烷∶乙醚(85∶15)为本次TLC柱层析实验的最佳洗脱剂。
李丹彤等[6]也曾对裙带菜中提取岩藻黄质进过TLC分析,他们分离出5条色谱带,推测5条色谱带分别为β-胡萝卜素、脱镁叶绿素a、叶绿素a、岩藻黄素和叶绿素c。本实验由于条件限制,尚无法对此5条色带带进行一一验证,但在TLC图谱趋势上与李丹彤实验是吻合的。
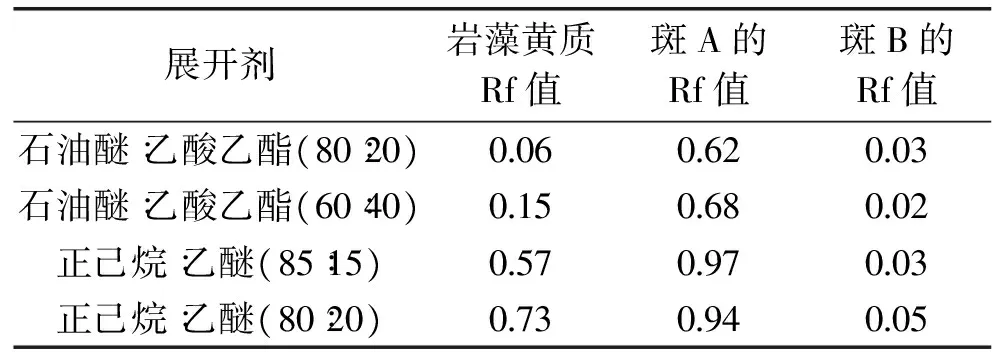
表4 不同展开剂的TLC层析结果Table 4 TLC results from different developing solvent experiments
2.5.2 层析条件的优化 保持相关条件不变,改变层析时洗脱剂流速,结果如图11。洗脱剂流速在0.2BV·h-1时,含量和回收率都相对较低,分离时间长;流速1.8BV·h-1时,平均含量较低,洗脱剂消耗量大,色带拖长。一般而言,流速如果偏低,轴向扩散影响会变大,层析效果就会较差;而流速如果偏大,两相间深度难以达到分配平衡,也会使分离效果变差。根据图11,最终选择洗脱剂流速为0.6BV·h-1。
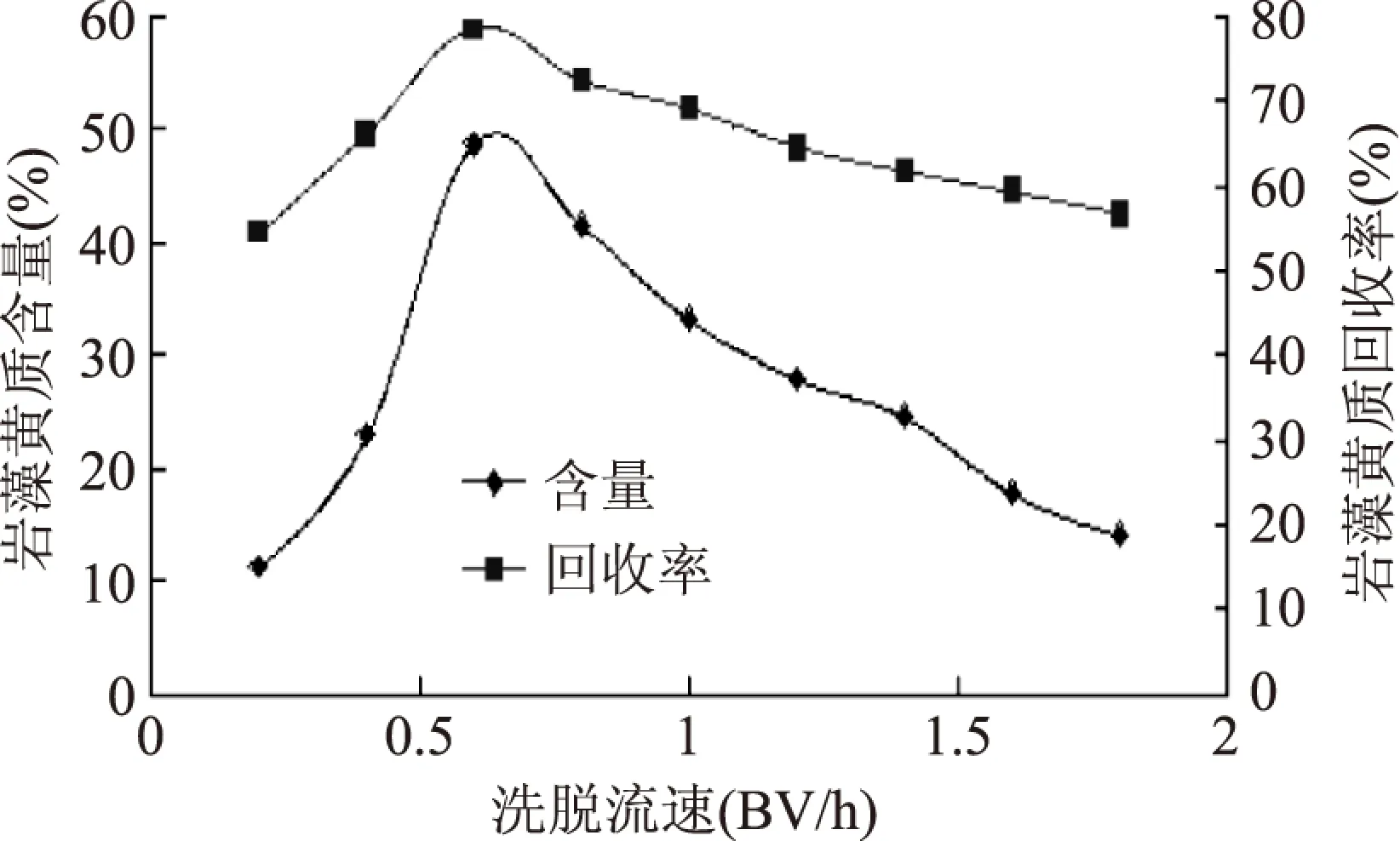
图11 不同流速的硅胶层析效果Fig.11 Effects of different folw rate on column purification注:进样4.0 g,床层体积320mL。
保持相关条件不变,改变进样量,结果如图12。在进样量较小(2.0g,6.25mg·mL-1)时,有较高的含量和较低的回收率,岩藻黄质和其他组分能得到较好的分离,但进样量小时相对损失较大;随着进样量的加大,混合物各组分在层析柱中峰形部分重叠,岩藻黄质含量显著下降,此时相对回收率先升后降。考虑到当前主流市场对岩藻黄质的含量要求并不高,只在5%,比较含量与回收率二因素,回收率显得相对更为优先,同时较小的进样量也不利于提高大生产时的工作效率,综合考虑,单次进样量8.0g,相当于25.0mg·mL-1柱体积为宜。
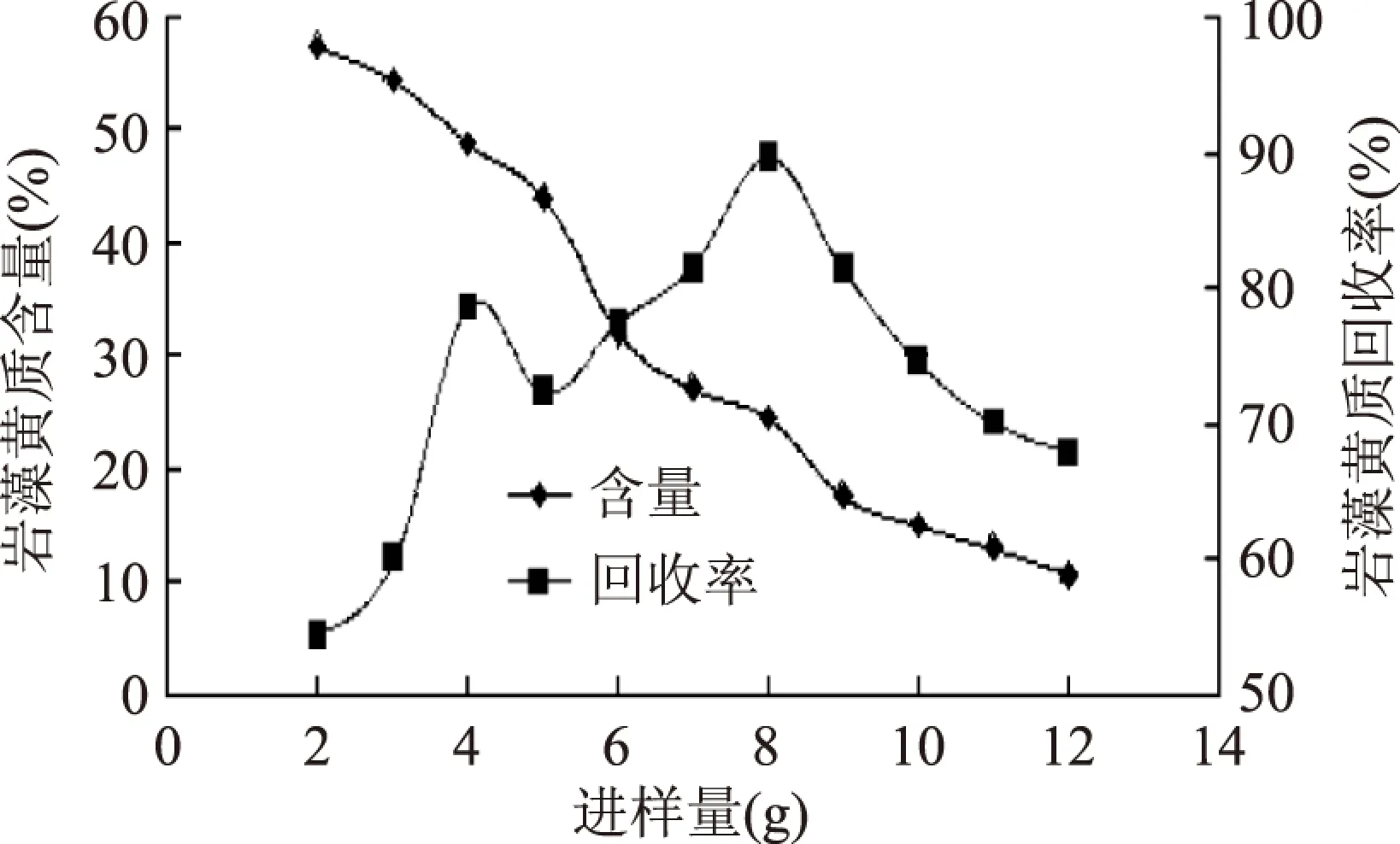
图12 不同进样量的硅胶层析效果Fig.12 Effect of different inject volume on column purification注:洗脱流速0.6BV·h-1,床层体积320mL。
确定优化层析条件,洗胶剂流速0.6BV·h-1,进样量25.0mg·mL-1床层体积,在此条件下,测定硅胶柱层析过程的流出曲线,如图13。

图13 优化条件下的层析效果Fig.13 Column purification result in optimized condition注:洗脱流速0.6BV·h-1,进样量25.0mg·mL-1柱体积。
收集含量较高的2.8~4.8BV洗脱组分,合并旋蒸,冷冻干燥,HPLC检测岩藻黄质含量为24.2%,回收率90.9%。
2.5.3 层析柱的再生 层析完成后,柱中残留较多杂质,柱体变为淡绿色。层析柱用乙醇洗脱2倍床层体积(640mL),再用洗脱剂3倍床层体积(960mL),重复进样。按照选定的操作条件,重复进行6次层析分离,如图14。
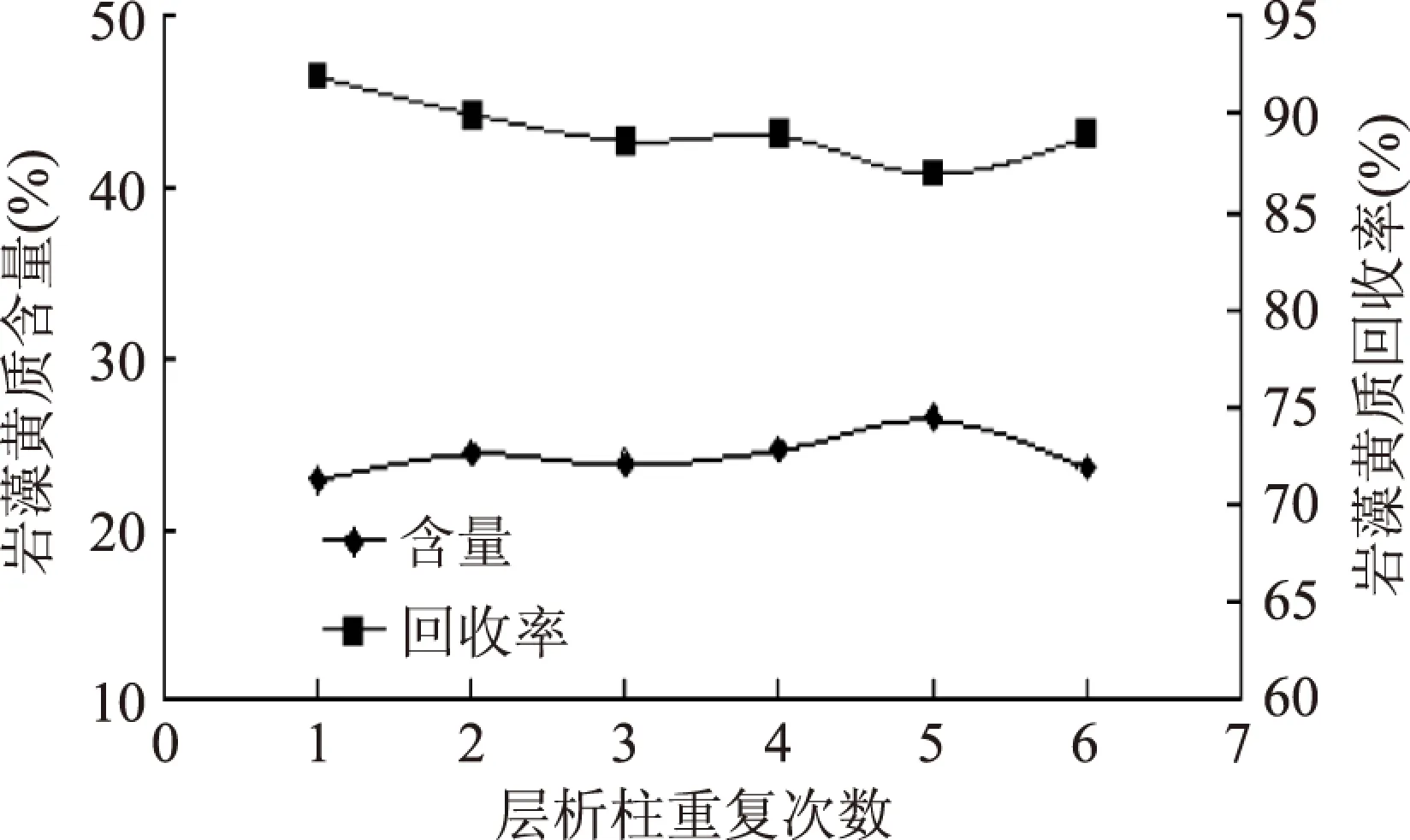
图14 优化条件下6次重复层析效果比较Fig.14 6 different chromatography comparison in optimized condition
重复6次结果表明,每次层析得到岩藻黄质的含量和回收率基本相同,重复性较好,层析柱再生效果较好。乙醇极性较大,能有效地洗脱硅胶柱吸附的极性杂质成分,使层析柱恢复到初始状态。乙醇再生,流动相平衡可以使层析柱重复利用多次。
进行验证实验,每100g裙带菜可制备岩藻黄质0.33g,HPLC色谱分析,含量为24.2%,如图15。
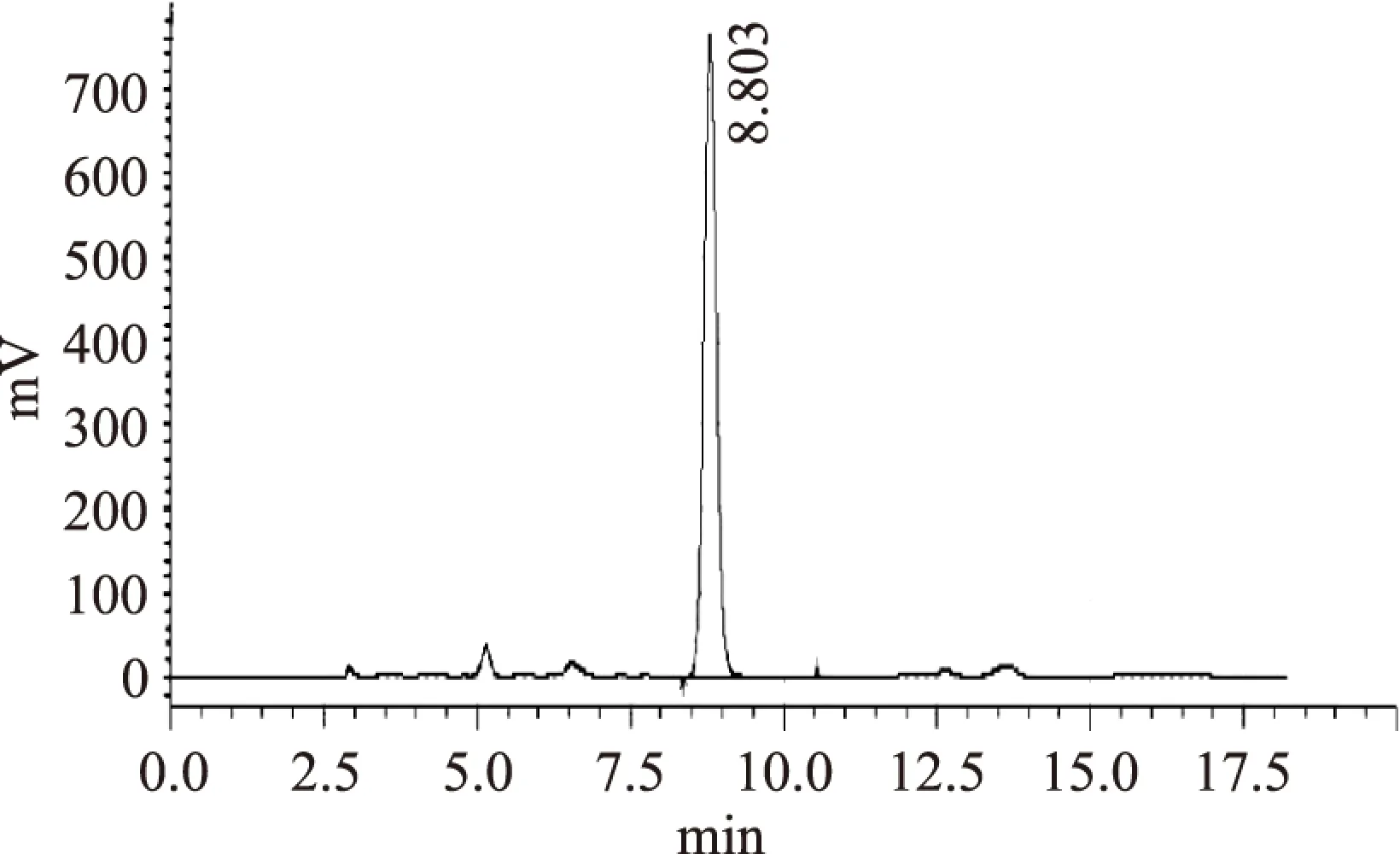
图15 柱层析纯化岩藻黄质样品色谱图Fig.15 HPLC chromatogram of purified fucoxanthin sample
3 结论
3.1 裙带菜提取岩藻黄质的高效液相色谱分析,可选用色谱柱Shim-pack VP-ODS C18(5μm,25mm×4.6mm);流动相:乙腈-磷酸溶液(90∶10);流速:1.0mL·min-1;柱温:35℃;检测波长:450nm。色谱显示岩藻黄质分离良好,进样量在0.040~0.400μg范围内与峰面积是良好的线性关系。本实验表明该方法简便、精确度高、分离效果好、专属性强,可作为裙带菜中岩藻黄质成分的定量检测方法。
3.2 通过单因素实验,确定以丙酮为岩藻黄质提取的最佳溶剂,复提3次最为经济效率。同时选定正交实验的合理设计因素应包括提取丙酮浓度、温度、
料液比、提取时间等。
3.3 通过正交实验,得出最佳浸提工艺为:提取溶剂为95%丙酮,料液比1∶12,温度55℃(可引入热回流装置),提取时间为2.5h。进行回收验证实验,裙带菜中岩藻黄质粗品的得率为0.088%,即每100g裙带菜可提取岩藻黄质粗品3.82g,含量为2.31%。
3.4 硅胶柱层析法可达到进一步纯化的目的,正己烷∶乙醚(85∶15)为洗脱溶剂,洗胶剂流速0.6BV·h-1,进样量25.0mg·mL-1床层体积,岩藻黄质得率为0.080%,回收验证实验,每100g裙带菜可制备岩藻黄质0.33g,HPLC含量为24.2%。经过硅胶柱层柱工艺,岩藻黄质损失率为9.1%,属于可承受损失范围。
[1]徐戎,张悦,王倩,曾繁典,等. 岩藻黄质(Fucoxanthin)抗肺癌作用及其机制研究[J]. 中国药理学通报,2009,10(25).
[2]张文竹,刘红兵,管华诗.裙带菜的化学成分及其生物活性研究进展[J].海洋科学,2009,33(4):72-75.
[3]Fumiaki Beppu,Masashi Hosokawa,Yoshimi Niwano,etal. Effects of dietary fucoxanthin on cholesterol metabolism in diabetic/obese KK-Ay mice[J]. Lipids In Health and Disease,2012,11:112.
[4]Tsukui T,Baba N,Hosokawa M,etal.Enhancement of hepatic docosahexaenoic acid and arachidonic acid contents in C57BL/6J mice by dietary fucoxanthin[J]. Fishery Science,2009,75:261-263.
[5]肖策.海带中岩藻黄质、岩藻甾醇、甘露醇和褐藻糖胶的综合提取纯化工艺研究[D]. 西安:西北大学. 2008:25-27.
[6]李丹彤,陈国栋,张玲丽,等.裙带菜岩藻黄素的提取分离及对人肝癌细胞HepG2的抑制作用研究[J].辽宁师范大学学报:自然科学版,2012,(3):383-389.
[7]尹尚军,徐涛,刘丽平,等.羊栖菜的提取工艺研究[J].食品工业科技,2011,4(32):272-275.
[8]李丹彤,陈国栋,张玲丽,等.裙带菜岩藻黄素的提取分离及对人肝癌细胞 HepG2 的抑制作用研究[J].辽宁师范大学学报:自然科学版,2012,35(9):383-388.
Extraction and purification of fucoxanthin fromUndariaPinnatifida
ZHOU Wei-song1,YANG Yan1,2,LIU Ming-she1
(1.Ningbo Tianhong Biotech Co.,Ltd,Ningbo 315800,China;2.North University of China,Taiyuan 030051,China)
With single factor experiment and orthogonal test,this study aimed to extract fucoxanthin fromUndariapinnatifida,silica gel column chromatography as further purification. The experimental results showed that,12 times 95% acetone,2.5h,55℃,extracting for 3 times,were more efficient and economic. The purity of fucoxanthin could be improved from 2.31% to more than 24.2% after silica gel column purification.
Undariapinnatifida;fucoxanthin;HPLC;column chromatography
2014-04-29
周卫松(1983-),男,工程硕士,研究方向:天然药物提取分离纯化。
TS255.1
B
1002-0306(2015)03-0260-06
10.13386/j.issn1002-0306.2015.03.046

