低聚果糖对干酪乳杆菌生长和代谢的影响
张晓峰,李 婉,李文杰,时宝庆,王 旗
(郑州大学公共卫生学院营养与食品卫生学系,河南郑州 450001)
低聚果糖对干酪乳杆菌生长和代谢的影响
张晓峰,李 婉,李文杰,时宝庆,王 旗
(郑州大学公共卫生学院营养与食品卫生学系,河南郑州 450001)
为研究干酪乳杆菌体外利用低聚果糖的生长代谢过程,分别以0.5%、1.5%、3%低聚果糖替代0.5%葡萄糖作为培养基碳源,取0、4、8、12、18、24h发酵液测pH、菌落数、代谢产物。结果表明:随着培养时间的延长,培养基中pH降低;0.5%低聚果糖培养基中干酪乳杆菌数量在8h时达到最高值,增加低聚果糖浓度到1.5%,干酪乳杆菌的数量随之增加;继续增加低聚果糖浓度到3%,干酪乳杆菌数量没有明显差异(p>0.05)。干酪乳杆菌代谢低聚果糖在4h时乙酸产量达到最高值,且3%低聚果糖培养基中乙酸产量是0.5%、1.5%低聚果糖的2倍;乳酸产量随着培养时间的延长逐渐积累,3%低聚果糖培养基中乳酸产量最多,干酪乳杆菌利用低聚果糖的主要代谢产物为乙酸和乳酸。
低聚果糖,干酪乳杆菌,代谢
低聚果糖(Fructooligosaccharide,FOS),又称蔗果低聚糖,是指1~4个果糖基和蔗糖的D-果糖基以β-2,1糖苷键结合生成的蔗果三糖、蔗果四糖、蔗果五糖和蔗果六糖等的混合物[1]。FOS天然存在洋葱、芹菜、大蒜、芦笋、香蕉等植物中;FOS甜度低,产能低,防龋齿,被认为是可溶性膳食纤维;它不能被人体内特定水解α-糖苷键的消化酶所水解,从而直接进入结肠,被肠道微生物代谢,降低肠道pH,促进铁和钙等矿物质的吸收;低聚果糖还具有调节肠道菌群,增强免疫力,预防疾病的作用[2-5]。在体外研究肠道细菌利用低聚果糖发酵时发现乳酸菌数量增加[6];研究乳双歧杆菌和乳酸菌菌株体外发酵低聚糖的性能时,结果表明低聚果糖能够促进乳酸菌增殖[7]。干酪乳杆菌(Lactobacilluscasei)属于乳杆菌属(Lactobacillus),作为益生菌常被用于酸乳、干酪和奶油等乳制品的发酵剂和辅助发酵剂,干酪乳杆菌作为一种生物保护因子,具有防止酸奶中真菌生长和延长保质期的作用[8]。干酪乳杆菌进入人体后,能够耐受口腔中的酶、胃液的低pH以及小肠中的胆汁酸,在肠道内大量存活。摄入干酪乳杆菌可调节人体肠道菌群平衡,增加肠道双歧杆菌等益生菌数量和有机酸含量[9];干酪乳杆菌具有低血清胆固醇的功效[10];它可以通过改善血脂异常,免疫调节和氧化应激来降低糖尿病及其并发症发生风险[11];干酪乳杆菌还具有提高机体免疫力,抗肿瘤的作用[12]。研究表明低聚果糖能够体外增殖乳酸菌并产生挥发性脂肪酸和乳酸,但是有关单一菌株利用低聚果糖的代谢情况并不明确[6-7,13]。干酪乳杆菌(Lactobacilluscasei,CICC 23185)对其宿主营养、免疫、防病等具有显著的益生功效,本实验采用体外培养的方法对其利用低聚果糖的生长过程进行研究,并分析其代谢产短链脂肪酸和乳酸以进一步了解干酪乳杆菌的糖利用代谢状况。
1 材料与方法
1.1 实验材料
干酪乳杆菌(Lactobacilluscasei,CICC 23185) 中国工业微生物菌种保藏管理中心;低聚果糖:纯度95% 上海劲马生物科技有限公司;冰乙酸标准品、乳酸标准品 阿拉丁试剂;MRS肉汤 北京路桥化学试剂有限公司;葡萄糖、牛肉膏、蛋白胨、酵母粉 天津科密欧化学试剂有限公司。
1.2 实验仪器
SW-CJ型超净工作台 苏州安泰;PNP-9082型恒温培养箱 上海精宏;HVE-50型高压蒸汽灭菌锅 HIRAYAMA;DELTA 320型pH计 梅特勒-托利多;XK97-A型菌落计数器 姜堰新康;GC-6890N型气相色谱仪 Agilent。
1.3 实验方法
1.3.1 干酪乳杆菌体外培养 菌种活化:称取MRS肉汤5.24g,加热溶解于100mL蒸馏水中,115℃高压灭菌15min,冷却至室温,接种干酪乳杆菌冻存液1mL,37℃度培养9h,调整菌种活化液活菌数为107CFU/mL,备用。
基础培养基成分(g/100mL):牛肉膏1g,蛋白胨1g,酵母粉0.5g,CaCO32g,吐温80 0.1g,葡萄糖0.5g,盐溶液5mL。盐溶液组成成分(g/100mL):乙酸钠10g,柠檬酸氢二铵4g,K2HPO44g,MgSO4·7H2O 0.4g,MnSO4·H2O 0.1g,调节pH至6.8。
三种低聚果糖培养基:分别用0.5、1.5、3.0g低聚果糖替代基础培养基中的葡萄糖,配制成0.5%、1.5%、3.0%果糖培养基。
单独取每种培养基9mL于20mL西林瓶中,每瓶接种活化菌液1mL,调整pH至6.8,加盖胶塞,用胶带密封,37℃培养。在0、4、8、12、18、24h六个时间段各取出3瓶培养液,4℃冷藏,待测。
1.3.2 pH的测定 测四种培养基在0、4、8、12、18、24h六个时间段培养液pH,每样3个重复。
1.3.3 干酪乳杆菌数量的测定 按国标GB4789.35-2010进行计数,计算出每毫升培养液中的活菌数(CFU/mL),结果换算成以10为底的对数进行统计比较。
1.3.4 干酪乳杆菌主要代谢产物的测定 根据参考文献[14]进行实验。
1.3.4.1 干酪乳杆菌代谢短链脂肪酸的测定 短链脂肪酸的测定:取2mL培养液,置于5mL离心管,在4000r/min条件下离心10min;在1.5mL离心管加入1mL上清液、5微升0.75mol/L的HCl混匀,放置10min后,在13000r/min条件下离心5min;取上清液,经0.45μm滤膜过滤于1.5mL离心管中,密封,进行乙酸、丙酸、丁酸等短链脂肪酸的气相色谱分析。
短链脂肪酸的色谱条件:毛细管柱:Agilent DB-WAX(30m×250μm,液膜厚度0.25μm);进样量:1μL;载气和流速:空气:400mL/min,H2:40mL/min,N2:25mL/min;检测器温度:250℃;分流比:30∶1;柱前压:15.5kPa;柱温:以10℃/min由80℃至110℃,维持1min;再以5℃/min升至135℃,维持1min;最后以5℃/min升至145℃,维持1min。
1.3.4.2 干酪乳杆菌代谢乳酸的测定 乳酸的测定:取2mL培养液,置于10mL离心管,加体积分数为50%的硫酸溶液0.5mL,甲醇2.0mL,混匀,在58℃条件下水浴30min,冷却至室温。加水和三氯甲烷各1.0mL,振摇3min;在4000r/min条件下离心5min,弃去上层的水溶液,取下层的三氯甲烷层,经过0.45μm滤膜,过滤至1.5mL离心管,密封,进行气相色谱分析。
乳酸的色谱条件:毛细管柱:Agilent DB-WAX(30m×250μm,液膜厚度0.25μm);进样量:1μL;载气和流速:空气:400mL/min;H2:40mL/min;N2:25mL/min;检测器温度:250℃;分流比:30∶1;柱前压:15.5kPa;柱温:140℃维持3min。
1.4 数据统计与处理
实验数据均以平均值±标准差表示,采用软件SPSS12.0进行t检验和方差分析,检验水准α=0.05。
2 结果与分析
2.1 不同培养基对pH变化的影响
不同碳源培养基对干酪乳杆菌发酵液pH的影响见图1。
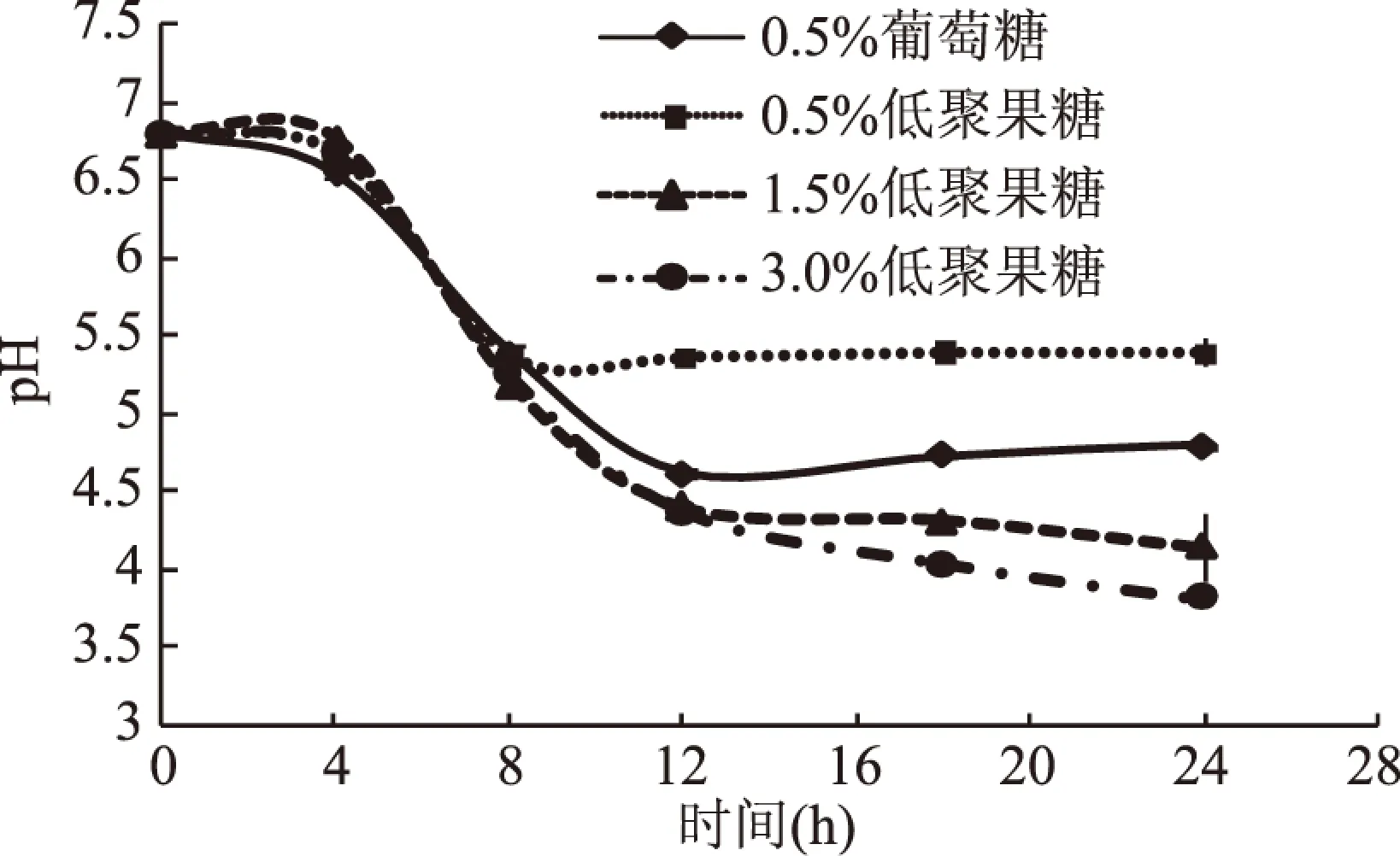
图1 不同培养基pH的变化Fig.1 pH changes of different culture medium
图1表示不同碳源培养基对干酪乳杆菌发酵液pH影响。由图1可知,培养基初始pH为6.80,随着培养时间的延长,0.5%低聚果糖培养基pH在8h内快速下降,其它三种培养基pH在12h内快速下降,之后进入平稳期。结果表明,干酪乳杆菌可以利用培养基中低聚果糖产生酸性物质,使培养基pH迅速降低。12h以后培养基中pH:3.0%低聚果糖<1.5%低聚果糖<0.5%葡萄糖<0.5%低聚果糖,这表明干酪乳杆菌利用0.5%低聚果糖产酸量少于0.5%葡萄糖,但随着低聚果糖浓度的增大,干酪乳杆菌在低聚果糖培养基中代谢活力增强,产酸增加,使培养基呈酸性环境。
2.2 不同培养基对干酪乳杆菌数量的影响
表1 不同培养基中干酪乳杆菌的数量Table 1 The number of lactobacillus casei in different culture ±SD,n=3)(lgCFU/mL)
注:G:葡萄糖,F:低聚果糖;a,b表示同一培养基不同时间段显著水平;A,B表示同一时间段不同培养基显著水平;标有不同字母者表示组间差异显著(p<0.05),相同字母者表示组间差异不显著(p>0.05),表2、表3同。

表2 不同培养基中乙酸含量Table 2 Acetic acid content in different culture ±SD,n=3)(mmol/L)
由表1可知,培养4h后,0.5% F培养基中,干酪乳杆菌数量显著增加,8h后进入平稳期;其它三种培养基中,干酪乳杆菌数量在前12h增加显著,之后进入平稳期。表明低聚果糖对干酪乳杆菌生长有促进作用,Endo等[15]的研究结果也显示低聚果糖能够使干酪乳杆菌增殖。
8h时,三种低聚果糖培养基中干酪乳杆菌数量均比0.5% G中的多,且差异具有统计学意义(p<0.05)。这表明,干酪乳杆菌能够快速利用低聚果糖增殖。
12h时,不同培养基干酪乳杆菌数量:0.5% F<0.5%G<1.5% F、3% F,而1.5% F和3% F之间差异无统计学意义(p>0.05)。这说明随着培养时间的延长,干酪乳杆菌利用0.5% G增殖的能力优于0.5% F,增加低聚果糖添加量,1.5% F中干酪乳杆菌的生长情况优于0.5% G,但继续增加培养基中低聚果糖的添加量到3%,干酪乳杆菌的生长情况与1.5% F没有明显差异。这表明,培养基中低聚果糖添加量对干酪乳杆菌的生长有一定的影响。
2.3 不同培养基对干酪乳杆菌代谢产物的影响
2.3.1 不同培养基对干酪乳杆菌代谢短链脂肪酸的影响 短链脂肪酸标准品和样品气相色谱图见图2和图3。
图2 短链脂肪酸气相色谱图(标准品)Fig.2 The gas chromatogram of the short chain fatty acid(Standars)
图3 短链脂肪酸气相色谱图(样品)Fig.3 The gas chromatogram of short chain fatty acid(samples)
干酪乳杆菌体外代谢低聚果糖的短链脂肪酸产物只检测到乙酸,并未检测到丙酸和丁酸,这与Fukuda等[16]研究中双歧杆菌代谢糖类的短链脂肪酸产物只有乙酸的结果一致。乙酸是肠道乳酸菌等益生菌降解未被吸收的淀粉和非淀粉型多糖的产物,能够维持肠道酸性环境,抑制有害菌的生长。乙酸进入末梢循环被外围组织所代谢,能够增加结肠血流量,增强回肠能动性,降低胃肠道功能紊乱的风险[17-18]。
由表2可知,4h时,三种低聚果糖培养基中乙酸含量显著增加,达到最高值,且均高于0.5% G中乙酸含量;三种低聚果糖培养基中乙酸含量组间比较,差异均有统计学意义(p<0.05),且3% F中乙酸含量是其他两种低聚果糖培养基中的2倍多。说明干酪乳杆菌能够较快利用低聚果糖产生乙酸,且适量增加低聚果糖的浓度能够使乙酸的产量增加。随着培养时间的延长,三种低聚果糖培养基中乙酸含量逐渐减少,这与高颖等[19]研究唾液乳杆菌代谢低聚果糖中代谢产物乙酸的变化趋势一致,这可能跟菌株的生长情况有关。
8h时,培养基中乙酸含量组间比较,1.5% F、0.5% F<0.5% G<3% F,且差异具有统计学意义(p<0.05),0.5% F和1.5% F之间无差异(p>0.05)。12h时,培养基中乙酸含量组间比较,1.5% F<0.5% F<0.5% G、3% F,其中0.5% G和3% F之间差异无统计学意义(p>0.05)。12h之后低聚果糖培养基中乙酸含量趋于稳定,这可能与培养基中干酪乳杆菌的数量变化有关。

表3 不同培养基中乳酸含量Table 3 Lactic acid content in different culture ±SD,n=3)(mmol/L)
2.3.2 不同培养基对干酪乳杆菌代谢乳酸的影响 由表3可知,与0h相比,12h内3% F培养基中乳酸含量显著增加,8h内其他培养基中乳酸含量显著增加。表明干酪乳杆菌能够利用低聚果糖代谢产生乳酸,使培养基呈酸性环境。每个时间段,三种低聚果糖培养基中乳酸含量均比0.5% G中高,且差异具有统计学意义(p<0.05)。4h时三种低聚果糖培养基中乳酸含量均是0.5%G中的2倍多。表明干酪乳杆菌代谢低聚果糖产生乳酸的能力比葡萄糖强。
图4 乳酸气相色谱图(标准品)Fig.4 The gas chromatogram of lactic acid(Standars)
图5 乳酸气相色谱图(样品)Fig.5 The gas chromatogram of lactic acid(samples)
组间比较,8h时,1.5% F和3% F中乳酸含量是0.5% F中的1.7倍;12h时,1.5% F中乳酸含量是0.5% F中的近2倍,而3% F中乳酸含量是0.5% F中的近3倍。随着培养时间的延长,低聚果糖培养基中乳酸的含量逐渐积累,Rycroft等[20]在研究中也得到相同的结果。随着低聚果糖添加量的增大,培养基中乳酸含量增多。这表明低聚果糖添加量的大小对干酪乳杆菌乳酸产量有一定的影响。
3 结论
干酪乳杆菌能够利用低聚果糖体外生长,主要代谢产物为乙酸和乳酸,使培养基pH降低;干酪乳杆菌代谢低聚果糖在4h时乙酸产量达到最高值,乳酸产量随时间逐渐积累,增加低聚果糖浓度会增加代谢产物产量。
[1]Sabater-Molina M,Larqué E,Torrella F,etal. Dietary fructooligosaccharides and potential benefits on health[J]. Journal of Physiology and Biochemistry,2009,65,(3):315-328.
[2]Bouhnik Y,Achour L,Paineau D,etal. Four-week short chain fructo-oligosaccharides ingestion leads to increasing fecal bifidobacteria and cholesterol excretion in healthy elderly volunteers[J]. Nutrition Journal,2007,6:42-48.
[3]Hess J,Birkett A,Thomas W,etal. Effects of short-chain fructooligosaccharides on satiety responses in healthy men and women[J]. Appetite,2011,56:128-134.
[4]Grethel T,Rodolfo T,Dirce L,etal. Yacon(Smallanthus sonchifolius)-derived fructooligosaccharides improves the immune parameters in the mouse[J]. Nutrition Research,2012,32:884-892.
[5]Seyed H,Mohsen K,Hosseinali K,etal. Dietary galactooligosaccharide affects intestinal microbiota,stress resistance,and performance of Caspian roach(Rutilus rutilus)fry[J]. Fish & Shellfish Immunology,2013,35:1416-1420.
[6]Philippeau C,Respondek F,Julliand V.Invitroeffects of fructo-oligosaccharides on bacterial concentration and fermentation profiles in veal calf ileal contentsAnimal[J]. Feed Science and Technology,2010,162:83-90.
[7]Sims I,Ryan J,Kim S.Invitrofermentation of prebiotic oligosaccharides by Bifidobacterium lactis HN019 and Lactobacillus spp[J].Anaerobe,2014,25:11-17.
[8]Li H J,Liu L,Zhang S W,etal. Potential use of Lactobacillus casei AST18 as a bioprotective culture in yogurt[J].Food Control,2013,34(2):675-680.
[9]Matsumoto K,Takada T,Shimizu K,etal. Effects of a probiotic fermented milk beverage containing Lactobacillus casei strain Shirota on defecation frequency,intestinal microbiota,and the intestinal environment of healthy individuals with soft stools[J].Journal of Bioscience and Bioengineering,2010,110(5):547-552.
[10]李永,陈有亮,胡徐登,等. 干酪乳杆菌21008体外降胆固醇活性研究[J]. 食品工业科技,2014,35(2):171-174.
[11]Chen P,Zhang Q X,Dang H,etal. Antidiabetic effect of Lactobacillus casei CCFM0412 in high-fat-fed,streptozotocin-induced type 2 diabetic mice[J]. Nutrition,2014.
[12]Aragóna F,Carinob S,Perdigóna G,etal. The administration of milk fermented by the probiotic Lactobacilluscasei CRL 431 exerts an immunomodulatory effect against a breasttumour in a mouse model[J].Immunobiology,2014,219:457-464.
[13]Ningegowda M,Gurudutt P.Invitrofermentation of prebiotics by Lactobacillus plantarum CFR 2194:selectivity,viability and effect of metabolites on b-glucuronidase activity[J]. World J Microbiol Biotechnol,2012,28:901-908.
[14]王尤丽. 低聚半乳糖调节小鼠肠道菌群的作用[D].郑州:郑州大学,2012:22-24.
[15]Endo H,Tamura K,Fukasawa T,etal. Comparison of fructooligosaccharide utilization by Lactobacillus and Bacteroides species[J]. Biosci Biotechnol Biochem,2012,76(1):176-179.
[16]Fukuda S,Toh H,Hase K,etal. Bifidobacteria can protect from enteropathogenic infection through production of acetate[J]. Nature,2011,469:543-547.
[17]Vinolo M,Rodrigues H,Nachbar RT,etal. Regulation of Inflammation by Short Chain Fatty Acids[J]. Nutions,2011,3(10):858-876.
[18]Hijova E,Chmelarova A. Short chain fatty acids and colonic health[J]. Bratisl Lek Listy,2007,108(8):354-358.
[19]高颖,于海龙,周永强,等. 唾液乳杆菌利用低聚果糖的代谢过程研究[J]. 中国酿造,2010,225(12):114-117.
[20]Rycroft C,Jones M,Gibson G,etal. Fermentation properties of gentio-oligosaccharides[J]. Letters in Applied Microbiology,2001,32(3):156-161.
Effect of fructooligosaccharides on the growthand metabolism ofLactobacilluscasei
ZHANG Xiao-feng,LI Wan,LI Wen-jie,SHI Bao-qing,WANG Qi
(Department of Nutrition and Food Hygiene,College of Public Health,Zhengzhou University,Zhengzhou 450001,China)
The growth and metabolism of fructooligosaccharides(FOS)byLactobacilluscaseiinvitrowere discussed. The carbon source of 0.5% glucose was replaced by 0.5%,1.5%,3% proportion of FOS.The pH,the number of colonies and the metabolites of the fermented liquid were detected at 0,4,8,12,18,24h. The results showed that,the pH dropped with the time. The number ofLactobacilluscaseiin the 1.5% supplementation of FOS reached to the top at 8h. As the concentration increased to 1.5%,the number ofLactobacilluscaseiincreased,but increase the concentration to 3%,there were no significant difference(p>0.05). The production of acetic acid reached to the top at 4h,and the production in the 3%FOS was 2 times of 0.5% FOS,1.5% FOS. The production of Lactic acid gradually accumulated with the time while 3% FOS was the best,and the main metabolites ofLactobacilluscaseiwere acetic acid and lactic acid.
Fructooligosaccharide;Lactobacilluscasei;metabolism
2014-06-11
张晓峰(1973-),女,博士,副教授,研究方向:食品营养学。
TS236
A
1002-0306(2015)03-0363-05
10.13386/j.issn1002-0306.2015.03.070

