全身热疗联合XELOX化疗方案应用于晚期胃癌疗效观察
耿炜 曹海英 张建宇 马震宇
[摘要] 目的 观察全身热疗联合XELOX方案治疗晚期胃癌的近期疗效、不良反应及安全性。 方法 选取40例晚期胃癌患者,在治疗前与患者沟通,取得同意后,将其分为联用组和对照组。其中联用组21例,采用全身热疗同步XELOX方案(奥沙利铂+卡培他滨)化疗的治疗方法;对照组19例,单用XELOX化疗方案。治疗2周期后评价疗效。 结果 联用组和对照组客观有效率分别为71.43%和31.58%,两组比较差异有统计学意义(P<0.05)。联用组与对照组1、2年生存率分别为38.10% vs 15.79%、28.57% vs 5.26%,差异均具有统计学意义(P<0.05)。联用组骨髓抑制和胃肠道反应的发生率与对照组比较,差异无统计学意义(P>0.05)。 结论 全身热疗联合XELOX方案化疗应用于晚期胃癌疗效肯定,不良反应可以耐受,有临床应用价值。
[关键词] 晚期胃癌;全身热疗;卡培他滨;奥沙利铂
[中图分类号] R735.2 [文献标识码] B [文章编号] 1673-9701(2015)28-0034-03
胃癌是我国发病率和死亡率均居第三位的恶性肿瘤[1]。据世界卫生组织统计,2012年我国胃癌发病人数40万,死亡人数32万。胃癌患者确诊大多已属于晚期,复发和转移是影响预后的主要因素,其五年生存率不足20%[2]。晚期胃癌患者已无法手术治疗,全身化疗虽为主要治疗手段,但通常不太敏感,疗效甚微,因而晚期胃癌的综合治疗意义尤为重要。全身热疗对化療具有多种协同作用,因此其配合化、放疗治疗晚期胃癌成为综合治疗的又一重要补充途径。我院肿瘤中心2009年1月~2012年12月采用全身热疗联合XELOX方案治疗晚期胃癌患者,取得较好疗效,现报道如下。
1 资料与方法
1.1 一般资料
选择本院2009年1月~2012年12月晚期胃癌患者40例,年龄34~76岁,平均(55.1±4.8)岁,治疗期间联用组中14例出现自觉症状,13例对照组患者有自觉症状,不良反应表现为胃肠道不适和骨髓抑制等。
病例纳入标准:①所有病例均为镜下活检或手术后,经病理明确诊断为胃癌的患者;②KPS≥70分,预计生存期>6个月;③患者血常规、肝肾功能、电解质、心电图、肺功能正常,无热化疗禁忌证;④有可测量的肿块,测量方法采用CT或MRI,测得长径及横径;⑤无上消化道出血、胃肠穿孔、重度感染等严重并发症;⑥无脑转移和严重心肺疾病;⑦患者或家属签署治疗知情同意书。
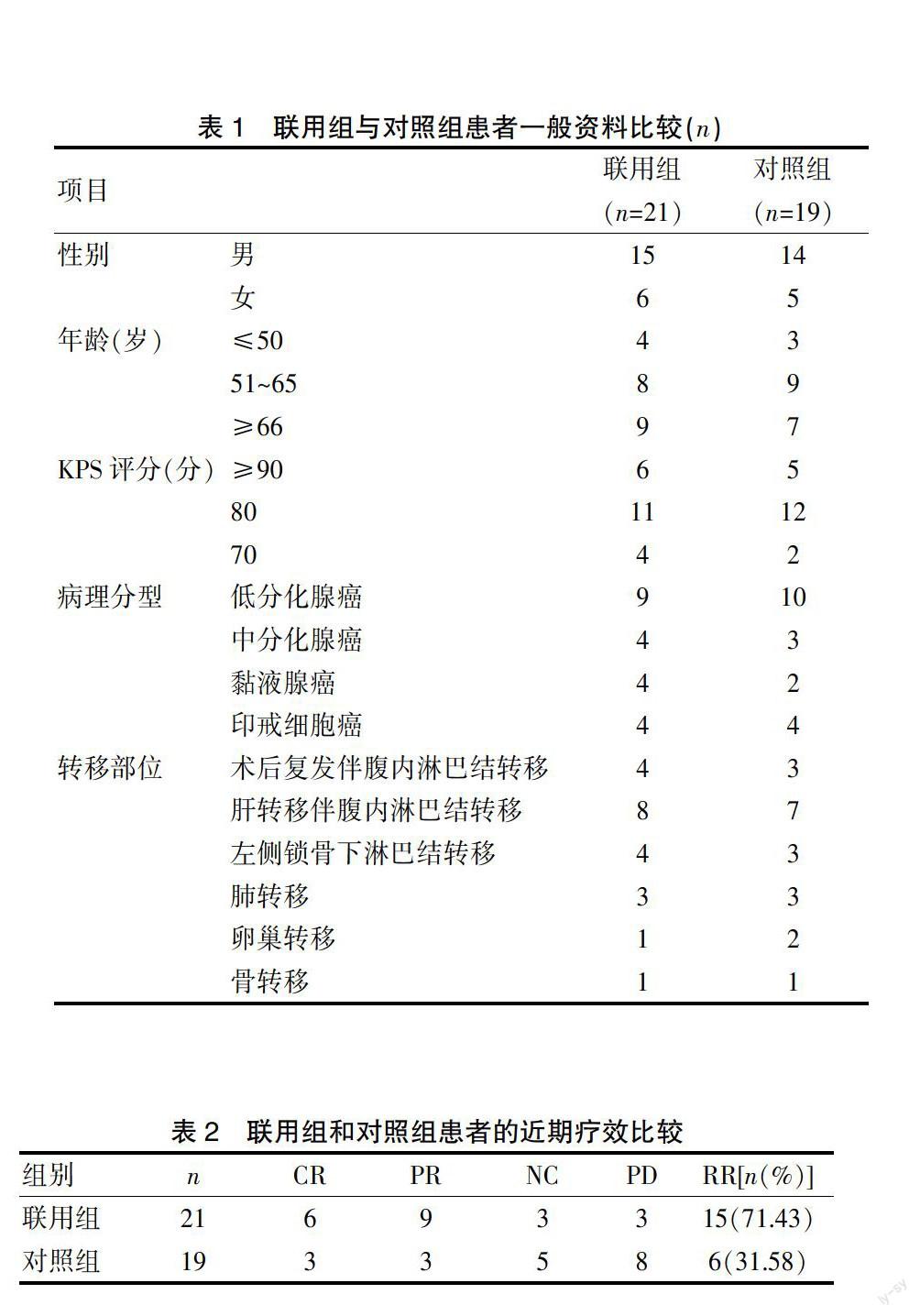
40例患者中低分化腺癌19例,中分化腺癌7例,黏液腺癌6例,印戒细胞癌8例;胃癌术后复发伴腹内淋巴结转移7例,肝转移伴腹内淋巴结转移15例,左侧锁骨下淋巴结转移7例,肺部转移6例,卵巢转移3例,骨转移2例。在治疗前与患者沟通,取得同意后,随机分为联用治疗组和对照组。联用组(n=21)患者采用全身热疗同期XELOX口服化疗;对照组(n=19)患者单独给予XELOX口服化疗。两组患者的一般资料具有可比性(P>0.05)。见表1。
表1 联用组与对照组患者一般资料比较(n)
1.2 治疗方法
联用组患者采用全身热疗同期XELOX方案化疗;对照组患者单独给予XELOX方案化疗。每2个周期后复查,评价治疗效果。
1.2.1 热疗方法 ①前期准备:前1 d晚上肠道准备,治疗前晚餐以流质为主;常规检查,包括:血尿常规、肝肾功能及电解质、血糖、心电图、肺功能、腹部彩超、胸部CT;治疗前1 d晚上和当天早上清洁灌肠,治疗当天禁食及导尿。②全身热疗过程:治疗前导尿、静脉置管。心电、血压及脉氧监测。热疗在ET-SPACE远红外线全身热疗机中进行,固定体表温度传感器,全身静脉麻醉,气管插管,体内放置食管、头部及直肠温度传感器,准备升温。③升温步骤:初期全功率加热,食管内温度至39℃时予以奥沙利铂化疗药物85 mg/m2静滴;中期80%~90%的功率加热升温至食管内39℃~40.5℃。晚期系统自动控制功率达恒温至40.5℃以上,1~2 h 后开仓降温。
1.2.2 化疗方案 XELOX化疗方案为:奥沙利铂 85 mg/m2静脉滴注2 h,d1,每3周重复。卡培他滨1000 mg/m2,口服,每日2次,连续14 d,休息7 d后重复。化疗为4周期方案,每2个周期后复查,评价治疗效果。
1.3疗效评价
评价短期疗效、远期生存及副反应,短期疗效遵循WHO评定实体瘤疗效标准[3]:完全缓解(CR)、部分缓解(PR)、无变化(NC)、进展(PD),客观有效率(RR)=CR+PR,长期疗效对照两组患者的1~2年生存率。疗程完毕后定期复查以影像学检查为主,首年间隔3个月,次年间隔4个月。副反应遵循WHO抗肿瘤药物常见副反应标准分级。
1.4统计学方法
采用PASW Statistics 18统计软件包进行数据录入和分析;用χ2检验或Fisher确切概率法进行构成比和率的比较分析,比较两组临床资料特点、近期疗效以及毒副反应;采用Kaplan-Meier法进行生存分析,比较两组患者生存率并绘制生存曲线。P<0.05为差异有统计学意义。
2 结果
2.1 短期疗效
2个周期方案化疗后观察疗效指标,4个周期后及疗程完毕后次月再次复查影像学检查,评价短期疗效。结果:联用组CR 6例,PR 9例,NC 3例,PD 3例;对照组CR 3例,PR 3例,NC 5例,PD 8例。其中治疗组客观有效率为71.43%,对照组为31.58%,因联用组NC和PD值<5,因此采用Fisher确切概率法结果,两组客观有效率比较差异有统计学意义(P<0.05)。见表2。
表2 联用组和对照组患者的近期疗效比较
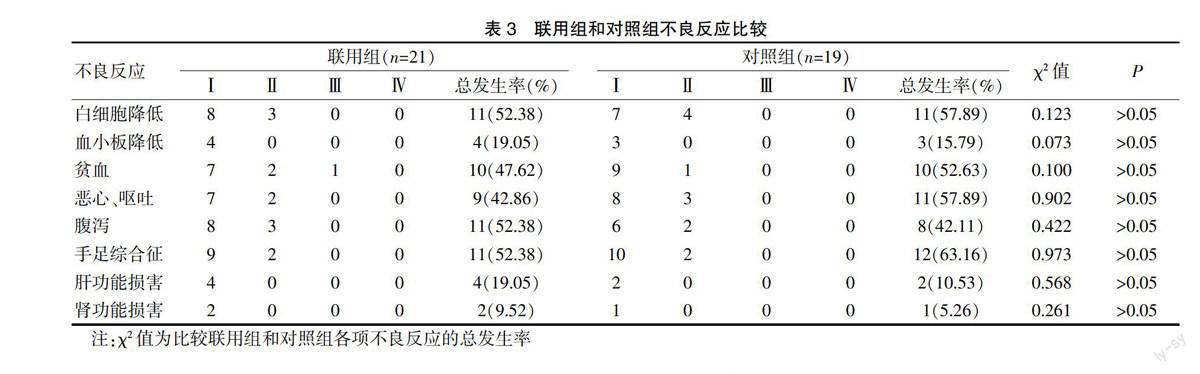
2.2 两组不良反应比较
两组患者的不良反应均为骨髓抑制(白细胞、红细胞、血小板三系减少)、胃肠道不适(恶心、 呕吐和腹泻)、手足综合征和肝肾损害。经统计,联用组和对照组患者的各项不良反应发生率差异均无统计学意义(P>0.05)。见表3。
2.3 生存分析
随访截至2014年12月31日,所有患者随访2年, 联用组及对照组中各有1例患者失访,随访率达95.0%。随访完毕后联用组中有14例死亡,6例生存;对照组中有17例死亡,1例生存。两组患者1、2年生存率各為38.10%和15.79%、28.57%和5.26%,两组生存率比较,差异有统计学意义(P<0.05),见封三图1。
3 讨论
手术、化疗、放疗是治疗胃癌的主要手段。早期胃癌可通过手术方式切除局部肿瘤病灶,晚期胃癌因广泛浸润及转移,不能手术,因此以放化疗等综合治疗手段为主。所以全身化疗是进展期胃癌姑息治疗的主要途径,但因胃癌对化疗药物不太敏感,其治疗效果尚不能令人满意,晚期胃癌患者中位生存期只有不到一年的时间[4]。
近20年来,全身热疗(whole body hyperthermia,WBH)已发展为继手术、放化疗等传统肿瘤治疗手段之后的又一肿瘤治疗的重要途径。其与全身化疗的协同作用主要体现在以下方面:①全身热疗时体温升高,肿瘤血管扩张,肿瘤组织的血流量增加,提高了肿瘤部位化疗药物的灌注,局部药物浓度增加[5];②肿瘤局部血管的通透性增加,化疗药物的渗透性得到增强[6];③药物与靶点的结合作用得以促进,药效增强;④化疗药损伤癌细胞后的修复作用降低;⑤肿瘤细胞中的P-糖蛋白以及多药耐药相关蛋白的基因表达受热作用抑制,从而使其耐药性被逆转和减少。
顺铂+氟尿嘧啶方案治疗晚期胃癌有效率为40%左右,是晚期胃癌传统常用方案,该方案中氟脲嘧啶药物半衰期较短,对于耐药和复发的难治患者,疗效不明显。郑鸿等[7]报道应用全身热疗联合FOLFOX方案治疗21例晚期胃癌患者取得近期57.12%的缓解率。沈青等[8]应用局部深部热疗联合FOLFOX4方案化疗治疗晚期胃癌近期疗效可达60%,不良反应能耐受。
卡培他滨是一种口服并有选择性针对肿瘤细胞的细胞毒性制剂,其结构可在肿瘤所在部位通过胸苷磷酸化酶的转化,成为具有细胞毒性的5-氟尿嘧啶,从而尽可能的降低对人体正常细胞的损伤。Xu等[9]在2007年ASCO年会上宣布,通过奥沙利铂+希罗达(XELOX)的联合使用治疗45例晚期胃癌患者,结果有效率为46.7%,并可耐受副反应。另一些作者用希罗达联合奥沙利铂治疗局部进展期胃癌也具有较好的疗效和良好的耐受性[10-15]。
目前关于全身热疗联用XELOX方案治疗胃癌的相关研究尚无报道。因此,本研究选择XELOX方案作为全身热疗联用化疗方案综合治疗晚期胃癌进行疗效观察研究。结果显示单独XELOX方案治疗晚期胃癌有效率为31.58%,与Xu等[9]报道XELOX单方案化疗晚期胃癌的有效率接近,而采用XELOX化疗与全身热疗联用的方案,其短期疗效为71.43%,优于单一化疗,且不良反应未见加重,同时长期生存率显著优于对照组,提示化疗同步全身热疗对晚期胃癌治疗效果肯定,不良反应可耐受。当然,本研究是否适合临床广泛应用推广还需要扩大样本量进行随机对照研究。
[参考文献]
[1] Zilberstein B,Jacob CE,Cecconello I. Gastric cancer trends in epidemiology[J]. Arq Gastroenterol,2012,49(3):177-178.
[2] Kunz PL,Gubens M,Fisher GA,et al. Long-term survivors of gastric cancer:A California population-based study[J]. J Clin Oncol,2012,30(28):3507-3515.
[3] 孙燕. 内科肿瘤学[M]. 北京:人民卫生出版社,2001:1994.
[4] De Vita F,Giuliani F,Silvestris N,et al. Current status of targeted therapies in advanced gastric cancer[J]. Expert Opin Ther Targets,2012,16(Suppl 2):S29-S34.
[5] Mohamed F,Marchettini P,Stuart OA,et al. Thermal enhancement of new chemotherapeutic agents at moderate hyperthermiaI[J]. Ann Surg Oncol,2003,10(4):463-468.
[6] kong G,Braun RD,Dewhirst MW,et al. Characterization of the effect of hyperthermia on nanoparticle extravasation from tumor vasculature[J]. Cancer Res,2001,61(7):3027-3032.
[7] 郑鸿,李勇. 热疗联用FOLFOX化疗方案治疗21例晚期胃癌[J]. 中国癌症杂志,2006,16(7):581-583.
[8] 沈青,王中奇. 热疗联合FOLFOX4方案治疗晚期胃癌疗效观察[J]. 同济大学学报(医学版),2012,33(5):94-97.
[9] Xu R,Han B,Shi Y,et al. Phase II clinical trial of XELOX as first line treatment for patients with unresectable or metastatic gastric cancer[J]. J Clin Oncol,2007,25(18): 150-162.
[10] Xiang XJ,Zhang L,Qiu F,et al. A phase II study of capecitabine plus oxaliplatin as first-line chemotherapy in elderly patients with advanced gastric cancer[J].Chemotherapy,2012,58(1):1-7
[11] Bang YJ,Kim YW,Yang HK,et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy(CLASSIC):A phase 3 open-label,randomised controlled trial[J]. Lancet,2012,379(9813):315-321.
[12] 赵群,李勇,檀碧波,等. 奥沙利铂联合卡培他滨新辅助化疗方案对进展期胃癌手术切除率及预后的影响[J].中华肿瘤杂志,2013,35(10):773-777.
[13] 黄慧云,黄兵,李兵,等. 奥沙利铂联合卡培他滨治疗晚期胃癌的价值分析[J]. 中国医药,2014,9(12):1765-1767.
[14] 李晓琴,姬发祥,林民哲,等. 卡培他滨联合奥沙利铂治疗进展期老年胃癌的临床观察[J]. 重庆医学,2013, 42(7):795-796.
[15] Xu HB,Hang F,Su R,et al. Capecitabine plus oxaliplatin (XELOX) compared with 5-fluorouracil/leucovorin plus oxaliplatin(FOLFOXs)in advanced gastric cancer:Meta-analysis of randomized controlled trials[J]. Eur J Clin Pharmacol,2015,71(5):589-601.
(收稿日期:2015-06-01)

