长引物PCR法构建白念珠菌SCH9-MYC融合菌
徐秋荣 吕权真 隋雪,3 王晓娟,4 阎澜 姜远英,
(1.福建中医药大学药学院中药学教研室,福州 350108;2.第二军医大学药学院新药研究中心,上海200433;3.沈阳药科大学生命科学与生物制药学院,沈阳110016;4.中国药科大学药学院,南京210009)
白念珠菌是一种条件性致病真菌,现在仍然是一种人体最重要的病原真菌,通常寄生在人体黏膜表面,对免疫力缺陷的患者造成致命的系统感染[1]。白念珠菌强大的适应宿主的能力依赖于它的细胞形态转变能力,特别是在不同环境中快速地进行酵母态与菌丝态之间的转变[2-3]。TOR通路(The targets of the rapamycin complex)通过感知外界环境中不同应激条件来调控与应激相关的基因转录表达,同时也感受外界环境中的营养物质来调控细胞生长[4-5]。目前研究发现白念珠菌Sch9p与菌丝形成相关,影响细胞生长,同时也是白念珠菌的致病力因子 在酿酒酵母中Sch9p是TORC1复合物的主要作用靶点蛋白[7]。因此我们推测白念珠菌Sch9p可能也是TORC1复合物的主要作用靶点蛋白。本实验通过设计长引物,采用长引物PCR扩增同源重组的方法快速构建白念珠菌SCH9-MYC融合菌,以便下一步考察白念珠菌Sch9p与TORC1之间的关系。
1 材料和方法
1.1 菌株和质粒
白念珠菌SN152(亲本菌为RM1000#2,基因型为 arg4Δ/arg4Δleu2Δ/leu2Δhis1Δ/his1ΔURA3/ura3Δ::imm434IRO1/iro1Δ::imm434),白 念 珠 菌Ca323(亲 本 菌 为 SN152,基 因 型 为 leu2Δ/leu2Δhis1Δ/his1ΔURA3/ura3ΔARG4/arg4Δ::imm434IRO1/iro1Δ::imm434),含有 MYC标签和 ARG4筛选标记的质粒是pFA-MYC-ARG4。
1.2 培养基和试剂
培养基 按照配方配制Spider培养基,酵母浸膏蛋白胨葡萄糖 (YPD)培养基、SC-leu-选择性培养基、Lee’s培养基、10%FBS 培养基。
试剂 Goldview核酸染料购自北京赛百盛基因技术有限公司,DNA polymerase、DNA Maker DL2000购自Takara公司,Yeast Transformation System 2购自Clontech公司,PCR产物纯化试剂盒购自天恩泽公司,YeaStar Genomic DNA kit购自Zymo research公司,琼脂糖购自Biowest公司,雷帕霉素(Rapamycin)购自上海研生实业有限公司,氟康唑(Fluconazole,FLC)注射液购自上海信谊金朱药业有限公司,十二烷基磺酸钠 (sodium dodecyl sulfate,SDS)购自上海君尔医药科技发展有限公司,氯化锂 (lithium chloride,LiCl)购自Sigma公司。
1.3 实验仪器与装置
Gene Quant II核酸定量分析仪,PCR仪 (东胜科技有限公司),HZQ-F160恒温振荡培养箱(江苏省太仓市实验设备厂),SW-CT-IF型超净化工作台(苏州安泰空气技术有限公司),FR-200紫外与可见分析装置 (上海复日科技有限公司),Eppendorf 5417R高速冷冻离心机(Eppendorf)。
1.4 白念珠菌SCH9-MYC融合菌的构建及鉴定[8]
抽提质粒pFA-MYC-ARG4的DNA,采用一对120 bp长引物序列(20 bp引物序列用于扩增质粒序列、100 bp引物序列是白念珠菌SCH9基因ORF的C末端同源重组序列)扩增含有MYC标签和ARG4筛选标记的质粒pFA-MYC-ARG4的序列,然后采用醋酸锂转染法把扩增的含有MYC标签和ARG4筛选标记的DNA序列同源重组到白念珠菌SN152的SCH9基因ORF的C末端,再用SC-Leu-选择性培养基筛选阳性克隆,然后抽提转染子的基因组进行PCR验证。
1.5 生长曲线测定
挑取少量PCR验证正确的转染菌、白念珠菌SN152和白念珠菌323,划线接种在YPD固体培养基上,30℃孵育培养48 h后,挑取少量菌接种到1 mL YPD液体培养液中,放在30℃恒温培养箱震荡培养16 h后,用新鲜的YPD培养液调整各菌的OD值为0.1,以零时为起点,每隔2 h测定各株菌的OD值,若OD值大于0.7,则用新鲜的YPD培养液稀释菌的OD值0.7以下,稀释后所测定的OD值乘以相应的稀释倍数作为该菌的最终OD值,共计12 h,绘制时间生长曲线并计算各菌的倍增时间。
1.6 Spot assay 实验[9]
制备好各种含药的YPD培养基,然后挑取各种菌少量 PCR验证正确的转染菌、白念珠菌SN152和白念珠菌323,划线接种在YPD固体培养基上,30℃孵育培养48 h后,挑取少量菌接种到1 mL YPD液体培养液中,放在30℃恒温培养箱震荡培养16 h后,用新鲜的YPD培养液调整各菌的OD 值为0.37~0.39,再依次 10 倍稀释 5 个浓度梯度,每个浓度取3μL点于相应的含药培养基上,放在30℃恒温培养箱静置培养48 h后观察菌落生长状态[9]。
1.7 菌丝诱导实验[10]
制备好菌丝诱导培养基:Spider培养基、Lee’s培养基和10%FBS培养基。挑取各种菌的少量菌落,接种到1 mL YPD液体培养液中,放在30℃恒温培养箱中震荡培养16 h后,转移至离心管中室温离心后,用PBS洗涤3次离心后,再用相应的培养液调整菌的OD值为0.1,然后再稀释1 000倍,取3μL点于相应的固体培养基上,37℃培养。
2 结 果
2.1 白念珠菌SCH9-MYC融合菌的基因组PCR鉴定
在SC-Leu-选择性固体培养基上挑取阳性克隆,接种到1 mL YPD液体培养液中,放在30℃恒温培养箱中振荡培养16 h后达到对数生长后期,离心后抽提这些转染子的基因组DNA,再用相应的引物扩增筛选鉴定出3株正确的白念珠菌SCH9-MYC融合菌单克隆菌株,分别命名为:白念珠菌SCH9-MYC-1、白念珠菌SCH9-MYC-2和白念珠菌SCH9-MYC-3,PCR验证这些正确的融合菌菌株结果如图1,所用引物见表1。

表1 实验中的引物序列Tab.1 Primers sequence used in the study
2.2 生长曲线测定
各个菌株的时间生长曲线如图2所示,白念珠菌SCH9-MYC-1和SCH9-MYC-2融合菌的生长速度与亲本菌SN152的生长速度基本一致,倍增时间为1.36 h,而白念珠菌SCH9-MYC-3融合菌的生长速度非常缓慢,明显滞后其他两株融合菌,倍增时间为 1.91 h。
2.3 Spot assay 实验
进一步鉴定经PCR验证正确的3株白念珠菌SCH9-MYC融合菌菌株的MYC标签对SCH9基因功能无影响的菌株,通过Spot assay实验考察3株融合菌、亲本菌SN152和白念珠菌Ca323对雷帕霉素 (Rap)、LiCl、FLC和SDS处理的敏感性,实验结果如图3所示:融合菌SCH9-MYC-3对雷帕霉素和LiCl敏感,而对SDS耐受。其他两株融合菌与亲本菌SN152和 Ca323对雷帕霉素、LiCl、SDS和 FLC的处理表型一致。
2.4 菌丝诱导实验
3株融合菌、亲本菌SN152和白念珠菌Ca323分别在菌丝诱导培养基Spider、Lee’s和FBS培养基中进行菌丝诱导实验,结果见图4:融合菌SCH9-MYC-3在这3种菌丝诱导培养基中菌丝无法形成,菌丝形成能力有缺陷;而其他两株融合菌和亲本菌SN152以及Ca323一样能够形成菌丝。
3 讨 论
白念珠菌是一种重要的人体条件性病原真菌,是人体的皮肤、胃肠道和泌尿生殖系统的菌落群的天然组成成员,能够引起人体鹅口疮、阴道念珠菌病,对免疫力有缺陷的患者造成致命的系统性感染,如今念珠菌感染已经是公共健康关注的焦点之一[11]。由于白念珠菌能够定居在不同的生物材料上,并很容易形成稠密复杂的生物被膜,对许多常用的抗真菌药物产生耐药性,同时白念珠菌的真核生物的属性与人非常相似,因此,对白念珠菌的研究既具有重要的临床研究意义又具有重要的科学研究价值[12]。
科研工作者投入了大量精力去寻找治疗白念珠菌的新药作用靶点,运用了各种生物化学方法、细胞生物学方法和基因组学去研究白念珠菌基因以及基因所编码的蛋白,深入理解白念珠菌特定的蛋白复合物的组装方式,以此来辅助寻找新药作用靶点。串联亲和纯化技术(TAP)能够大范围的分析蛋白复合物,抗原表位标签技术 (HA和MYC)已经用于标记特定蛋白,从而对这些特定蛋白进行免疫沉淀或免疫共沉淀实验来验证蛋白复合物的形成[13]。本研究通过设计长引物 (引物序列总长为120 bp,其中20 bp引物序列用于扩增含有MYC标签和ARG4筛选标记的质粒序列,另外100 bp引物序列用于将扩增出的质粒序列通过转染的方式同源重组到白念珠菌SCH9开放阅读框的C末端),PCR扩增出含有MYC标签和ARG4筛选标记的质粒序列通过同源重组的方法构建白念珠菌SCH9-MYC融合菌。目前普遍使用的质粒酶切与连接的方法构建含有MYC标签和ARG4筛选标记连接目的基因侧翼序列的质粒,然后再通过酶切和转染的方式构建白念珠菌SCH9-MYC融合菌的方法,整个过程至少需要1周的时间。采用酶切和连接的方法构建白念珠菌SCH9-MYC融合菌是费时的方法,而采用长引物PCR同源重组构建白念珠菌SCH9-MYC融合菌的方法是非常快速简便的,整个过程只需要3 d时间。
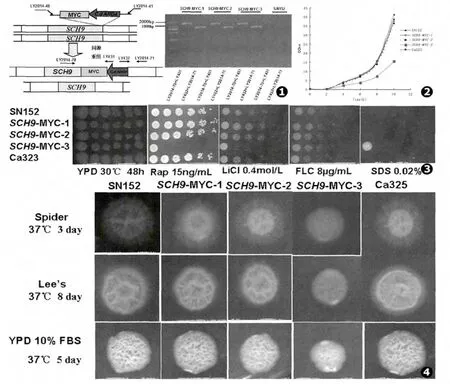
图1 白念珠菌SCH9-MYC融合菌株的构建及鉴定 图2 白念珠菌SN152、白念珠菌SCH9-MYC融合菌和白念珠菌Ca323在YPD培养基中的生长曲线 图3 白念珠菌SN152、白念珠菌SCH9-MYC融合菌和白念珠菌Ca323在YPD培养基中的药物敏感实验结果 图4 白念珠菌SN152、白念珠菌SCH9-MYC融合菌和白念珠菌Ca323在不同固体培养基中菌丝诱导实验结果Fig.1 The construction and identification of the C.albicans SCH9-MYCfusion strains Fig.2 The time-growth curve of the C.albicans SN152,SCH9-MYC fusion strains and Ca323 in the YPDmedium Fig.3 The drug sensitivity assays of the C.albicans SN152,SCH9-MYCfusion strains and Ca323 in the YPD medium Fig.4 The hyphal outgrowth of the C.albicans cells on solid Spider,Lee’s and YPD containing 10%FBSmedia
通过对在SC-Leu-选择性培养基上生长的阳性克隆进行基因组PCR验证得到3株验证正确的白念珠菌SCH9-MYC融合菌,然后再对这3株融合菌进行测定时间生长曲线实验、药物敏感spot assay实验和菌丝诱导实验筛选出白念珠菌SCH9-MYC-1和白念珠菌SCH9-MYC-2融合菌的表型与亲本菌SN152一致,而白念珠菌SCH9-MYC-3的表型与亲本菌SN152不一致。白念珠菌SCH9-MYC-3融合菌中的Sch9p的蛋白活性降低,可能是因外源序列MYC标签和ARG4筛选标记的质粒序列插入影响Sch9p蛋白的活性。通过长引物PCR法构建白念珠菌SCH9-MYC-1融合菌和SCH9-MYC-2融合菌可以用于下一步实验考察白念珠菌Sch9p与TOR通路关系的实验。
[1] Wu N,Lin J,Wu L,et al.Distribution of Candida albicans in the oral cavity of children aged 3-5 years of Uygur and Han nationality and their genotype in caries-active groups[J].Genet Mol Res,2015,14(1):748-757.
[2] Chauhan N,Latge JP,Calderone R.Signalling and oxidant adaptation in Candida albicans and Aspergillus fumigatus[J].Nat Rev Microbiol,2006,4(6):435-444.
[3] Cottier F,Muhlschlegel FA.Sensing the environment:response of Candida albicans to the X factor[J].FEMS Microbiol Lett,2009,295(1):1-9.
[4] Crauwels M,Donaton MC,Pernambuco MB,et al.The Sch9 protein kinase in the yeast Saccharomyces cerevisiae controls cAPK activity and is required for nitrogen activation of the fermentablegrowth-medium-induced(FGM)pathway[J].Microbiology,1997,143(Pt 8)2627-2637.
[5] Roosen J,Engelen K,Marchal K,et al.PKA and Sch9 control a molecular switch important for the proper adaptation to nutrient availability[J].Mol Microbiol,2005,55(3):862-880.
[6] Liu W,Zhao J,Li X,et al.The protein kinase CaSch9p is required for the cell growth,filamentation and virulence in the human fungal pathogen Candida albicans[J].FEMS Yeast Res,2010,10(4):462-470.
[7] Urban J,Soulard A,Huber A,et al.Sch9 is a major target of TORC1 in Saccharomyces cerevisiae[J].Mol Cell,2007,26(5):663-674.
[8] Lavoie H,Sellam A,Askew C,et al.A toolbox for epitope-tagging and genome-wide location analysis in Candida albicans[J].BMC Genomics,2008,9:578.
[9] Reuss O,Vik A,Kolter R,et al.The SAT1 flipper,an optimized tool for gene disruption in Candida albicans[J].Gene,2004,341:119-127.
[10] Lee CM,Nantel A,Jiang L,et al.The serine/threonine protein phosphatase SIT4 modulates yeast-to-hypha morphogenesis and virulence in Candida albicans[J].Mol Microbiol,2004,51(3):691-709.
[11] Berman J,Sudbery PE.Candida albicans:a molecular revolution built on lessons from budding yeast[J].Nat Rev Genet,2002,3(12):918-930.
[12] Colombo AL,Perfect J,Dinubile M,et al.Global distribution and outcomes for Candida species causing invasive candidiasis:results from an international randomized double-blind study of caspofungin versus amphotericin B for the treatment of invasive candidiasis[J].Eur JClin Microbiol Infect Dis,2003,22(8):470-474.
[13] Jarvik JW,Telmer CA.Epitope tagging[J].Annu Rev Genet,1998,32:601-618.

