不同光敏剂孵育时间在白念珠菌光动力抑制效应中的实验研究
徐辉 陈虹霞 邹先彪
(1.解放军医学院,北京100853;2.解放军总医院第一附属医院皮肤科,北京100048)
白念珠菌作为常见的条件致病菌,能引起皮肤或黏膜甚至全身系统的感染,近年来白念珠菌耐药性不断增强,这使得人们不断寻求新的治疗手段和方案。5-ALA-PDT是近年来兴起的一种治疗皮肤病的光化学技术,被证明可以有效杀死细菌、酵母和真菌等微生物[1]。在抑制芽管和生物膜形成、降低念珠菌对口腔上皮细胞黏附性方面效果明显[2]。由于各国的研究者所使用的ALA的浓度、激光光源、孵育时间、总能量都有所不同,导致对 ALAPDT的疗效评价缺乏一致性[3]。本研究通过测定白念珠菌与5-ALA不同孵育时间下生成PpIX的水平及5-ALA-PDT抑菌率,探求PpIX峰值出现时间及规律,为临床治疗局部真菌感染选择最佳孵育时间提供理论依据。现将研究结果报道如下。
1 材料和方法
1.1 菌株与试剂
白念珠菌临床菌株取自304医院皮肤科实验室,5-ALA由上海复旦张江生物医药股份有限公司提供。临用前以生理盐水配制成ALA溶液。PBS缓冲液、HyClone改良型RPMI 1640液体培养基、沙堡氏培养基由Gibico公司提供;MTT购自武汉亦新生物技术有限责任公司;二甲基亚砜(DMSO)购自西陇化工股份有限公司。
1.2 主要仪器
LD600-A型半导体激光治疗机,波长为635 nm,最大输出功率密度为100 mW/cm2,由武汉亚格光电技术有限公司提供。RT-3000全自动洗板机,DNM-9602酶标分析仪 (由北京普朗新技术有限公司生产),空气浴振荡器 (哈尔滨东联电子技术开发有限公司制造);TCSSPII型激光共聚焦显微镜(德国Leica公司产品);倒置显微镜 (奥林帕斯,日本)。
1.3 方法
白念珠菌悬液的制备 将白念珠菌在新鲜配制的沙氏培养基上连续转种两次,35℃培养24 h后,取生长良好的菌落5个加入放有50 mL YPD液体培养基的150 mL锥形瓶中,置于37℃恒温摇床摇动培养(100 r/min)24 h获得菌液用1640培养液稀释。通过血细胞计数板调整含菌量,使菌悬液含菌量为1×106CFU/mL(CFU:集落形成单位)。
白念珠菌的分组 实验分组:治疗组,共8组,往96孔细胞培养板中加入ALA溶液,使每孔的ALA的终末浓度100 mmol/L。每组6个培养孔,3个用于测定PpIX,以平均值计算胞内PpⅨ水平;3个用于测定光动力处理后的MTT测定。并于35℃避光分别孵育 15、30、45、60、90、120、150、180 min。设3个对照组:a.单纯的白念珠菌悬浮液组;b.菌悬液加200 mg/mL ALA不照光组;c.菌悬液不加ALA照光组。对照组孵育时间均为60 min。
照光 半导体激光照射,激光头与培养板的垂直距离为2 cm,刚好能覆盖培养孔上口,照射的能量密度为27 J/cm2。照光时间3 min。
激光共聚焦显微镜观察 将孵育不同时间段的混悬培养物滴加在准备好的干净的载玻片,用盖玻片盖片,吸水纸吸除周边液体,直接放置在激光共聚焦荧光显微镜观察,用随机自带软件进行荧光强度定量分析。取图靠近盖玻片中央位置,取图参数设置一致以减少误差。
菌落计数 光照后,立即将各组菌悬液用PBS进行倍比稀释,分别取样100μL转到另一张无菌培养板上,35℃避光培养24 h后进行菌落计数。
MTT法测定不同孵育时间下ALA-PDT抑制率光动力处理结束后,每孔加入20μL MTT(5 mg/mL),100 ML PBS培养液培养4 h。终止培养后小心吸去孔内培养液。每孔加入150μL DMSO,37℃温箱孵育10 min。之后用酶标仪检测OD490 nm各孔的吸光度 (A)值。计算白念珠菌细胞活力=(实验组A值-调零孔A值)/(对照孔A值-调零孔A值)×100%,从而得出抑制率。
1.4 统计学分析
采用SPSS 13.0统计软件分析,计量资料数据以均数±标准差,采用多个样本均数的方差分析。
2 结 果
2.1 定量分析
在实验中,固定药物浓度和照光剂量,随着孵育时间延长,实验组白念珠菌体内PpⅨ水平增加,实验组每两组进行比较,P<0.05,差异有统计学意义,对照组CLSM未检测到PpIX砖红色荧光。定量分析结果提示 (见表1):各对照组均没有产生PPIX。治疗组PPIX荧光强度从30 min后开始显著累积,直到90 min开始下降,在孵育30~90 min期间PpIX达到一个高峰平台,随后开始降低。
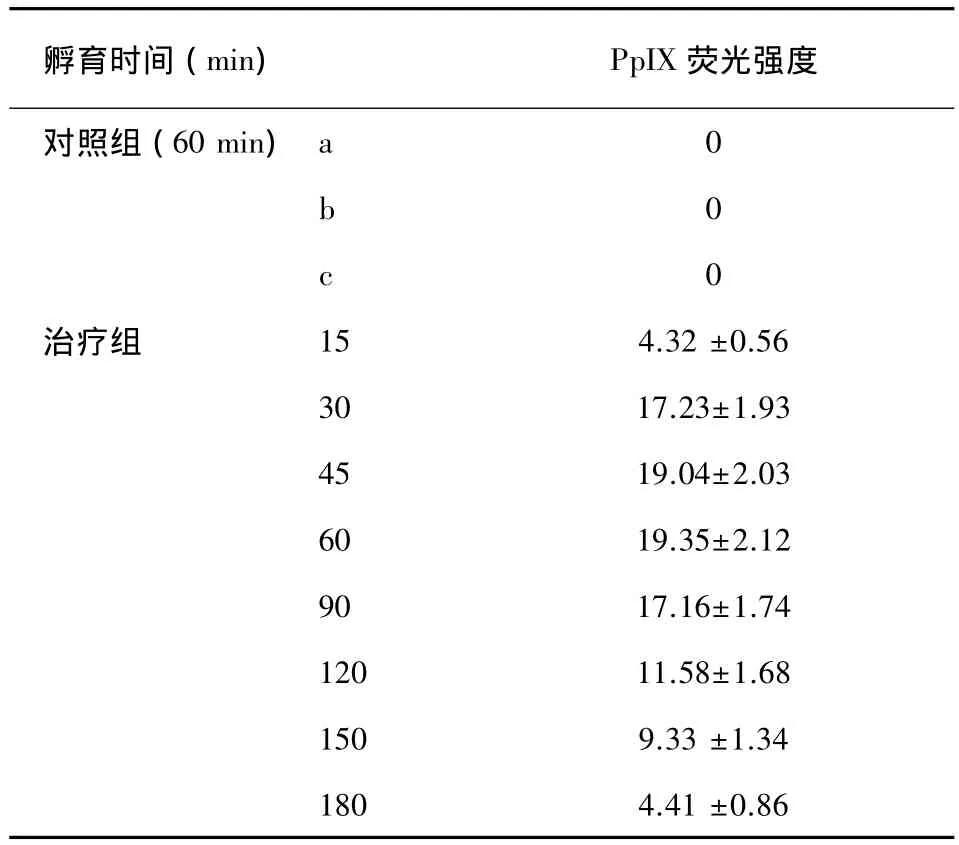
表1 5-ALA(100 mmol/L)与白念珠菌35℃避光共孵育不同时间点产生的PpIX荧光强度Tab.1 Different time of PpIX fluorescence intensity after Candida albicans incubated with 100 mmol/L of 5-ALA solution at 35℃in dark room
2.2 倒置显微镜观察

图 1 A、B、C、D、E、F、G、H、I分别为孵育 15、30、45、60、90、120、150、180 min及对照组PDT处理后倒置显微镜下图像Fig.1 Different time of inverted microscope image after 5-ALA-PDT solution with 100 mmol/L of ALA(A.15 min,B.30 min,C.45 min,D.60 min,E.90 min,F.120 min,G.150 min,H.180 min,I.control group)
不同孵育时间5-ALA-PDT处理后倒置显微镜观察见图1。相对于对照组,各实验组光动力均有效果。孵育15 min后PDT镜下观察孢子和菌丝相对对照组减少,在30~90 min孵育时间内进行光动力治疗,菌丝基本不见生长,只有零星孢子存在。孵育时间120 min、150 min、180 min镜下观察和孵育15 min孢子和菌丝量很接近。
2.3 MTT法测定ALA-PDT抑制率
随着孵育时间的延长,抑菌率上升,30~90 min达到一个高峰平台(见表2)。30、45、60、90min各组之间两两比较P>0.05无统计学意义。15 min和180 min组比较P>0.05无统计学意义,30、45、60、90 min 各组与15 min、180 min 比较 P<0.01,统计学有显著差异。30、45、60、90 min 各组与120 min组、150 min组两两比较 P<0.05有统计学差异。120 min组和150 min组比较P>0.05无统计学意义。孵育1 h抑制率最高达到(73.32±3.54)%。
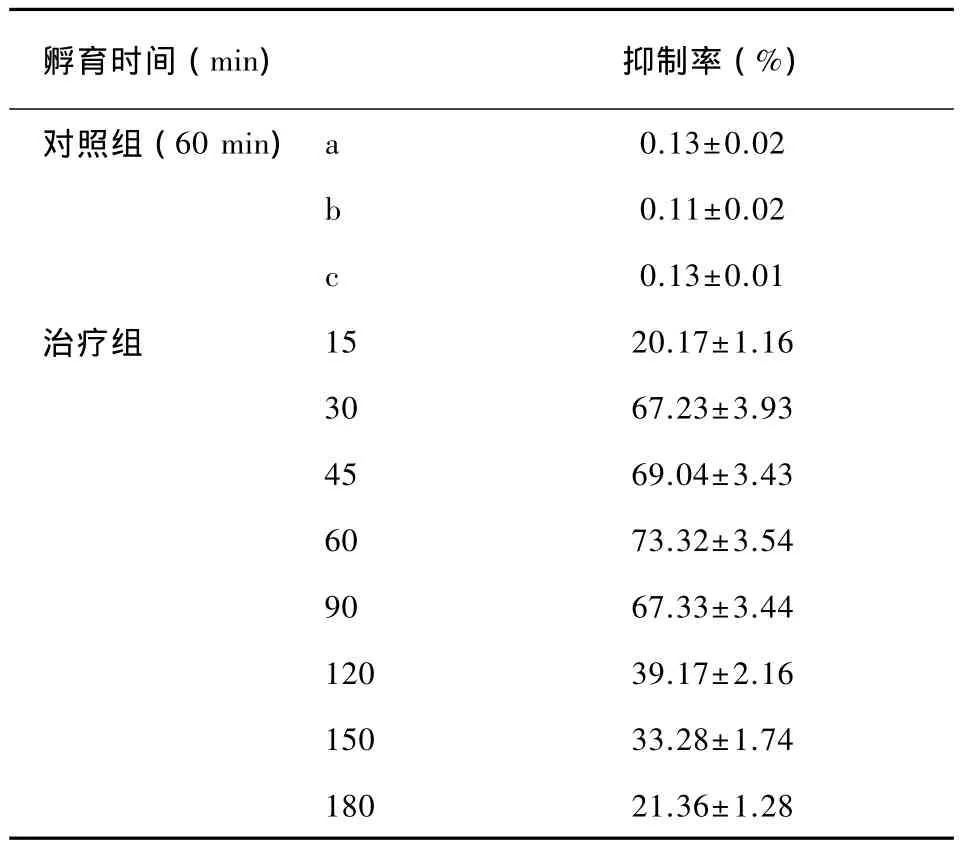
表2 MTT法测定不同孵育时间下ALA-PDT抑制率Tab.2 Used by MTT method to determine the inhibition rate of ALAPDT
2.4 菌落计数
不同孵育时间内,PDT处理后的菌落计数不同,30~90 min孵育时间内,白念珠菌残留菌落最少 (见表3)。各治疗组与对照各组比较P<0.05,有统计学意义。30、45、60、90 min各组之间两两比较P>0.05无统计学意义。15 min和180 min组比较 P>0.05 无统计学意义,对照各组和 30、45、60、90 min 各组与 15 min、180 min 比较 P<0.01,统计学有显著差异。30、45、60、90 min各组与120 min组、150 min组两两比较P<0.05有统计学差异。
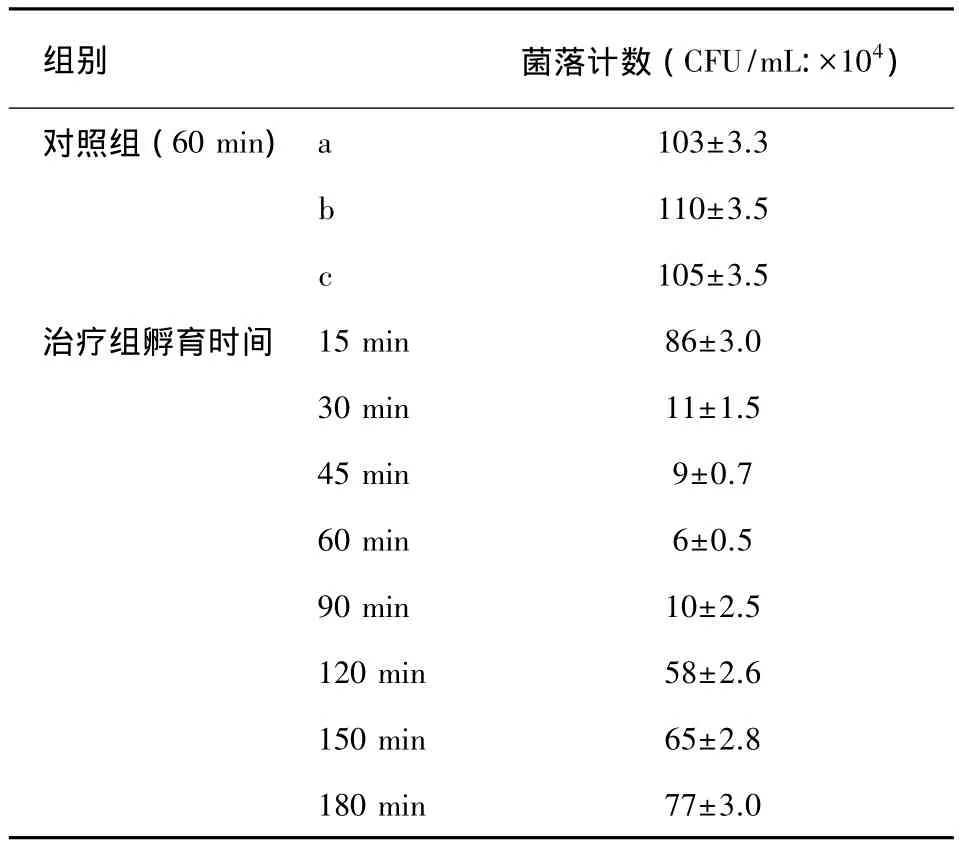
表3 不同孵育时间后ALA-PDT处理后菌落计数Tab.3 The inhibition of Candida albicans growth of ALA-PDT(Mean±SD)
3 讨 论
随着激素、广谱抗生素和免疫抑制剂在临床上广泛应用,真菌感染的发病率不断上升,75%女性一生有过1次感染[4-5],其中5%~10%的有过复发[6],系统感染死亡率达 50%[7-8],临床抗真菌药物治疗副作用大加上真菌耐药性日趋严重,使得抗真菌药物治疗面临的挑战越来越大。5-ALA-PDT是一种联合应用5-ALA及相应光源,通过光动力学反应生成具有杀伤细胞作用的单态氧(102),选择性破坏病变组织的全新技术。广泛用于治疗光化性角化病、基底细胞癌、鳞状细胞癌、鲍恩病等皮肤癌前病变和肿瘤[9-11],以及尖锐湿疣、痤疮等其他感染性皮肤病,取得较好的疗效,应用前景值得期待[12-15]。5-ALA作为一种内源性的生化物质,利用内在的细胞血红素生物合成途径最终转化为光活性的 PpIX。早在 1981年,ItoT[16]就研究表明,当血卟啉衍生物的浓度达到一定程度时,白念珠菌被有效杀死,其原理可能是在光照的作用下,血卟啉改变了菌体细胞膜的通透性,进而破坏菌体促使菌体加速死亡。光动力抗菌化学疗法的疗效取决于真菌体内PpIX的生成水平,而PpIX在真菌体内的合成受游离血红蛋白浓度的反馈调节,当外源性ALA过量时,在真菌细胞会产生过量的PpIX,如不发生光动力学反应,PpIX将在体内亚铁螯合酶催化下与铁离子结合生成血红素[17],从而使PpIX水平下降。本次实验中,随孵育时间延长,PpIX荧光强度不断升高,但是90 min后,荧光强度开始下降,孵育15 min和孵育180 min测定荧光强度基本一致的原因就是PpIX在体内与铁离子结合生成了血红素,使得白念珠菌体内产生的PpIX水平下降。实验中采用粉红色1640培养液,与砖红色的PpIX荧光色彩接近,镜下观察不易清楚分辨,所以实验中利用共聚焦显微镜直接测量荧光强度的方法来判定PpIX水平的高低。
本实验中,从孵育30 min开始,PpIX开始快速累积,峰值在60 min,在90 min后PpIX强度开始下降,这同光动力处理后对白念珠菌抑制率以及残留菌落CFU值的规律性相一致。这也和Donnelly[18]、黄望强[19]等实验基本吻合,Donnelly 认为白念珠菌可以在2 h内将PpIX代谢合成为血红素,以致于ALA孵育2 h后的PDT效果较孵育0.5 h差,其认为PpIX峰值出现的时间是0.5 h;梁义[20]在5-ALA-PDT抑制白念珠菌实验中采用孵育2 h的方案PpIX产生达到峰值,这和本次实验有出入,本次实验中30 min到90 min中出现了PpIX平台期,这在国内外文献中未曾报道过,究其原因可能和选用的培养基不同有关,培养基不同,直接影响白念珠菌菌丝的形成,从而间接对PpIX转归发生作用。但是否和培养温度、培养菌株等有关尚不明确。如何在临床上充分利用这个平台期抗菌治疗值得探讨。从倒置显微镜图片可以看出光动力疗法不光针对白念珠菌的孢子相起作用,对菌丝相同样起到杀伤作用。这点在临床工作中非常重要,因为临床损害中往往这两种形态同时存在。
不同孵育时间后,PDT处理后的菌落计数不同,30~90 min孵育时间内,白念珠菌残留菌落最少。PpIX强度的高低直接影响到光动力的杀伤作用,但菌落计数只能靠人工计数,费时费力,误差较大。
MTT是测定真核细胞活性的重要工具。其原理是活细胞中线粒体琥珀酸脱氢酶还原与MTT结合,生成蓝紫色结晶可在酶标仪上读取吸光度值,并以此反映细胞的代谢活性。Levitz等[21]最早使用MTT方法测定真菌细胞的活力,其方法简单易操作,本实验中通过测定吸光度值计算出光动力治疗对真菌生长的抑制率。随着孵育时间的延长,抑菌率上升,30 min到90 min抑制率最高。因为MTT法只能测定活细胞的相对数,和菌落计数相互配合,相互补充,抑制率的结果和PpIX产生强度的规律及菌落计数结果前后呼应,证实了平台期的存在。
4 小 结
本研究采用体外实验对5-ALA与白念珠菌菌悬液孵育时间不同所产生PpIX水平的规律性进行研究,在此基础上进行抑菌实验研究。综合考虑经济及治疗的方便性,ALA浓度选择200 mg/mL比较合适,其光动力效应也最为显著。由于体外培养条件下白念珠菌增殖及感染深度等与体内实际情况存在差别,因此,今后我们将采用动物实验进一步研究ALA-PDT抗菌效应,为临床治疗局部真菌感染提供更完善的理论依据。
[1] Smijs TG,vander HR,Lugtenburg J,et al.Photodynamic treatment of the dermatophyte Trichophyton rubrum and its microconidia with Porphyrin photosensitizers[J].Photochem photobiol,2004,80(2):197-202.
[2] Soares BM,Resende MA,Silva DL,et al.In vitro photodynamic inactivation of Candida spp.growth and adhesion to buccal epithelial cells[J].JPhotochem Photobiol B,2009,94(1):65-70.
[3] Qiao JJ,Li RY,Ding YG,et al.Photodynamic therapy in the treatment of superficial mycoses:an evidence-based evaluation[J].Mycopathologia,2010,170(5):339-343.
[4] Sobel JD.Pathogenesis and epidemiology of vulvovaginal candidi-asis[J].Ann N Y acad Sci,1988,544(1):547-557.
[5] Kent hL.epidemiology of vaginitis[J].Am J Obstet Gynecol,1991,165(4 Pt 2):1168-1176.
[6] Sobel JD.pathogenesis and treatment of recurrent vulvovaginal candidiasis[J].Clin Infect Dis,1992,14(Suppl1):S148-153.
[7] Vazquez Ja,Sobel JD.Mucosal candidiasis.Infect Dis Clin North am,2002,16(4):793-820.
[8] Pfaller Ma,Diekema DJ.epidemiology of invasive candidiasis:a persistent public health problem[J].Clin Microbiol rev,2007,20(1):133-163.
[9] Alexiades-Armenakas M.Aminolevulinic acid photodynamic therapy for actinickeratoses/actinic cheilitis/acne:vascular laser[J].Dermatol Clin,2007,25(1):25-33.
[10] Xiu-Li Wang,Hong-Wei Wang,Min-Xia Guo,et al.Treatment of skin cancer and pre-cancer using topical ALA-PDT-A single hospital experience[J].Photodiagnosis and photodynamic,2008,5(2):127-133.
[11] Xiu-Li Wang,Hong-Wei Wang,Min-Xia Guo,et al,Combination of immunotherapy and photodynamic therapy in the treatment of Bowenoid papulosis[J].Photodiagnosis and photodynamic 2007,4(2):88-93.
[12] Wang XL,Wang HW,Wang HS,et al.Topical 5-aminolevulinic acid photodynamic therapy for the treatment of urethral condylomata acuminata[J].Br JDermatol,2004,151(4):880-885.
[13] Kacerovska D,Pizinger K,KumpovaM,et al.Genital warts treated by photodynamic therapy[J].Skinmed,2007,6(6):295-297.
[14] Nestor MS.The use of photo dynamic therapy for treatment of acne vulgaris[J].Dermatol Clin,2007,25(1):47-57.
[15] Horfelt C,Stenquist B,Larko O,et al.Photodynamic therapy for acne vulgaris:a pilot study of the dose-response and mechanism of action[J].Acta Derm Venereol,2007,87(4):325-329.
[16] Ito T.Photodynamic action of hematoporphyrin on yeast cell:a kinetic approach[J].Photochem Photobiol,1981,34(4):521-524.
[17] 麦浩山.铁螯合剂增强5-氨基酮戊酸光动力诊疗进展[J].北方药学,2014,11(5):103-104.
[18] Donnelly RF,McCarron PA,Lightowler JM.Bioadhesive patchbased delivery of 5-aminolevulinic acid to the nail for photodynamic therapy of onychomycosis[J].J Control Release,2005,103(2):381-392.
[19] 黄望强,史赢,雷铁池,等.5-氨基酮戊酸光动力疗法对体外培养三株嗜角质真菌杀伤效应的实验研究[J].武汉大学学报 (医学版),2012,33(3):345-349.
[20] 梁义,卢丽明,陈勇,等.5-氨基酮戊酸光动力疗法对白念珠菌抑制效应的实验研究[J].海南医学,2013,24(10):1405-1406.
[21] Levitz SM,Diamond RD.A rapid eolorimetric assay of fungal viability with the tetrazolium salt MTT[J].Infect Dis,1985,152(5):938-945.

