含依诺沙星微球的改性明胶膜的制备及体外释药性研究
吴宏霞, 林 媚
含依诺沙星微球的改性明胶膜的制备及体外释药性研究
吴宏霞1, 林媚2
摘要:目的制备含有依诺沙星微球的改性明胶膜,并研究其体外释药性。方法以乳化交联法制备依诺沙星明胶微球,以微球粒径、载药量、包封率为指标,应用正交试验优选微球的最佳制备工艺后,将载药微球分散到改性明胶膜中,对比普通载药膜测定其在pH 7.4磷酸盐缓冲液中的释放性。结果以最优工艺制备的依诺沙星微球外观圆整,分布均匀,平均粒径为(3.04±0.25)μm,>80%微球粒径分布在1~6 μm,微球平均载药量为(11.8±1.02)%,平均包封率为(78.24±3.18)%,载药微球膜和普通药膜中依诺沙星累积释放约80%各需96 h和8 h。结论依诺沙星微球制备工艺稳定可行,载药微球改性明胶膜体外释放缓慢,有望开发为具有长效抗菌效果的创伤性敷料。
关键词:依诺沙星; 微球体; 明胶; 膜剂; 药用制剂/代谢
天然生物材料明胶是由动物皮和骨所含有的胶原蛋白温和断裂后制得的大分子蛋白质,具有良好的生物相容性和生物降解性、促进细胞粘附和生长、止血促凝等优势,在医药领域用途广泛。明胶单独或与其他材料复合制成创伤敷料也成为研究热点[1-2]。由明胶等亲水胶态微粒形成的水胶体类敷料含水量高,能保持创面湿润。敷料与组织接触时可发生水合作用,有效吸收伤口渗出液,具有清创、密闭创面作用[3]。此外,在明胶薄膜敷料中掺入抑菌剂、表皮生长因子等生物活性物质,可更好地发挥抗菌防腐及促进创面愈合作用[4-6]。研究表明,明胶作为创伤敷料的不足在于明胶膜质脆,力学性能差,限制了其广泛应用,经交联后可提高在生理条件下的抗吸水性、机械性能以及药物缓释性能[7-9]。
依诺沙星为第三代喹诺酮类抗菌药物,具有抗菌谱广,组织穿透性好和毒性低等特点,临床上多用于泌尿系统感染、伤寒、肠炎以及皮肤和软组织感染的治疗。笔者将依诺沙星制成明胶微球后分散于戊二醛交联的明胶膜中,制成依诺沙星微球-改性明胶薄膜(简称载药微球膜),发挥微球和改性明胶薄膜的双重控释作用,长时间内维持创面的有效抑菌浓度,促进创面愈合,减少敷料更换次数,为开发具有长效抗菌效果的新创伤敷料提供了参考。
1材料与方法
1.1材料
1.1.1试剂依诺沙星(批号:20110916,国药集团化学试剂有限公司);明胶(Type B,美国Sigma公司);戊二醛(25%)、Span 80、Tween 80(国药集团化学试剂有限公司),其他试剂均为分析纯。
1.1.2仪器荧光倒置可拍摄显微镜(IX70,日本奥林巴斯公司);电子天平(BSA124S,北京赛多利斯仪器系统有限公司);紫外分光光度计(UV-2000,尤柯上海有限公司);高速台式离心机(TGL-10B,上海安亭科学仪器厂);精密增力电动搅拌器(JJ-1)及恒温振荡仪(SHA-B,常州国华电器有限公司)。
1.2方法
1.2.1乳化分散交联法制备依诺沙星微球称取依诺沙星适量,溶解于0.1 mol/L氢氧化钠溶液3 mL中;将一定浓度的明胶溶液15 mL与依诺沙星溶液混匀保温于50 ℃水浴中。搅拌下将水相逐滴加入含乳化剂(Span 80与Tween 80的混合乳化剂,HLB=4.5)的50 mL液体石蜡中,50 ℃水浴下乳化一定时间后改成冰浴,逐滴加入1%戊二醛2.5 mL搅拌固化3 h。将得到的混悬液高速离心,弃去上清液,得沉淀。用无水乙醚、异丙醇交替洗涤沉淀2次,真空干燥24 h,得淡黄色粉末状固体微球。同法制备空白微球。
1.2.2正交设计优选微球处方根据预实验及文献查阅,以微球粒径、包封率、载药量为指标,选取对微球质量影响较大的4个因素,即明胶质量浓度(A)、搅拌速率(B)、乳化剂/油相比例(C)、乳化时间(D),每个因素取3个水平,通过L9(34)正交设计优选制备工艺[9]。因素水平见表1。
1.2.3微球形态、粒径的观察与测定取少量微球,置于载玻片上,滴加少量液体石蜡分散,置于荧光倒置显微镜下观察,拍摄分布在载玻片上5个以上不同区域的微球,并测量其粒径,微球不少于500个,获得微球的平均粒径和粒径分布图。
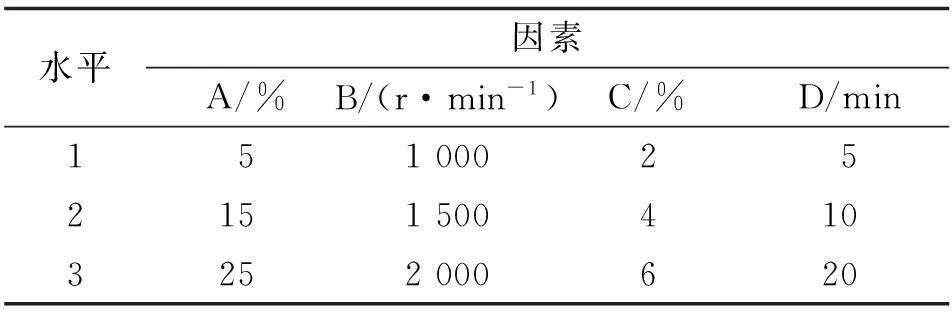
表1 L9(34)正交实验因素及水平表
A:明胶浓度;B:搅拌速率;C:乳化剂/油相;D:乳化时间.
1.2.4微球中药物含量、包封率和载药量的测定采用紫外分光光度法[10],以0.1 mol/L氢氧化钠溶液溶解,再以0.1 mol/L磷酸盐缓冲液(PBS)稀释成依诺沙星系列浓度的溶液。依处方用量将辅料配制成溶液,各溶液于200~400 nm波长下进行紫外扫描,发现依诺沙星最大吸收波长为268 nm,且辅料无干扰,故选择268 nm为检测波长测定吸光度(A)。以A对浓度(C)线性回归,计算回归方程,作为药物含量测定的依据。
微球中药物含量及包封率测定方法:将载药微球研成粉末,精确称取粉末样品,加入0.1 mol/L氢氧化钠溶液,100 ℃回流1 h,以0.45 μm微孔滤膜过滤后,紫外测定滤液A。按下列式(1)和式(2)计算载药量和包封率。
(1)载药量=(微球中依诺沙星量/微球总重量)×100%
(2)包封率=(微球中依诺沙星量/所投依诺沙星总量)×100%
1.2.5载药微球膜的制备精确称取按优选工艺制备的依诺沙星干燥微球50 mg,置于10 mL PBS中,高速分散1 min,将1 g明胶粉末加入微球溶液中,于40 ℃磁力搅拌至明胶完全溶解,滴加5%的戊二醛溶液1 mL交联[11]。待体系黏度开始变稠时,迅速倒入10 cm培养皿中静置流平,明胶胶凝后,置于30 ℃烘箱恒温干燥24 h。以同等含药量的依诺沙星代替依诺沙星微球同法制成普通载药膜,另制备不含药物的空白微球膜作为对照。
1.2.6载药微球膜的体外释放性考察采用PBS释放体系模拟体液环境,研究载药微球膜作为皮肤用敷料在皮肤创伤表面的释药特性。采用动态透析法,精密称取约200 mg载药膜3份,置于盛有PBS(pH=7.4)10 mL的透析袋中,扎紧两端,封口后置于含20 mL PBS溶液作为释放液的带盖容器中,置恒温水浴振荡器中(37 ℃,50 r/min)。定时(1,2,4,8,10,24,48,72,96 h)取样3 mL,立即过滤(0.45 μm),同时补充3 mL新鲜的恒温缓冲液,以空白微球膜释放液为对照,268 nm处测定吸光度,根据标准曲线计算各时间点药物浓度Ci,并依据式(3)计算各时间点药物累积释放百分率(Q)。同法测定普通载药膜的药物累积释放百分率。
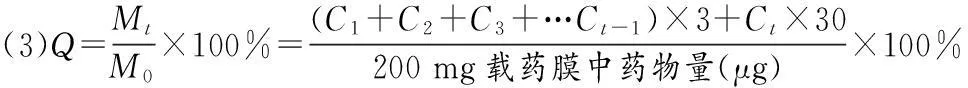
其中,Mt为t时间,药物累积释放总量;M0为初始载药膜中药物总量。
2结果
2.1药物的标准曲线方程以紫外分光光度法在268 nm波长处测定系列浓度(C)、吸光度(A),得到A与C的回归方程为:A=0.093 2C-0.013 1,r=0.999 8,表明依诺沙星在2~20 μg/mL范围内线性关系良好。
2.2微球工艺条件优选以微球的包封率(S1)、载药量(S2)、平均粒径(S3)等指标的求和值来衡量,求和值S=S1+S2-S3,S值越大,表明微球质量越好,同时考察微球圆整度和黏连性,实验结果见表2和表3。由表2可知,四因素对微球质量的影响排序为:A>B>C>D。最佳处方为A2B3C2D2,即:明胶浓度为15%,搅拌速率为2 000 r/min;混合乳化剂的用量为4%,乳化时间为10 min。
按照最佳制备工艺条件重复制备依诺沙星微球3批,所得微球平均粒径为(3.04±0.25)μm,平均载药量为(11.8±1.02)%,平均包封率为(78.24±3.18)%。该结果优于正交试验条件下的实验结果,表明该工艺条件制备明胶微球稳定可行。
2.3微球形态按最优工艺制备的依诺沙星微球,肉眼观察呈淡黄色粉末状,光学显微镜下观察,微球外形圆整,表面光滑,分散性好,粘连极少(图1)。

图1 依诺沙星微球显微镜图( ×100)Fig 1 Optical micrograph of Enoxacin microspheres( ×100)
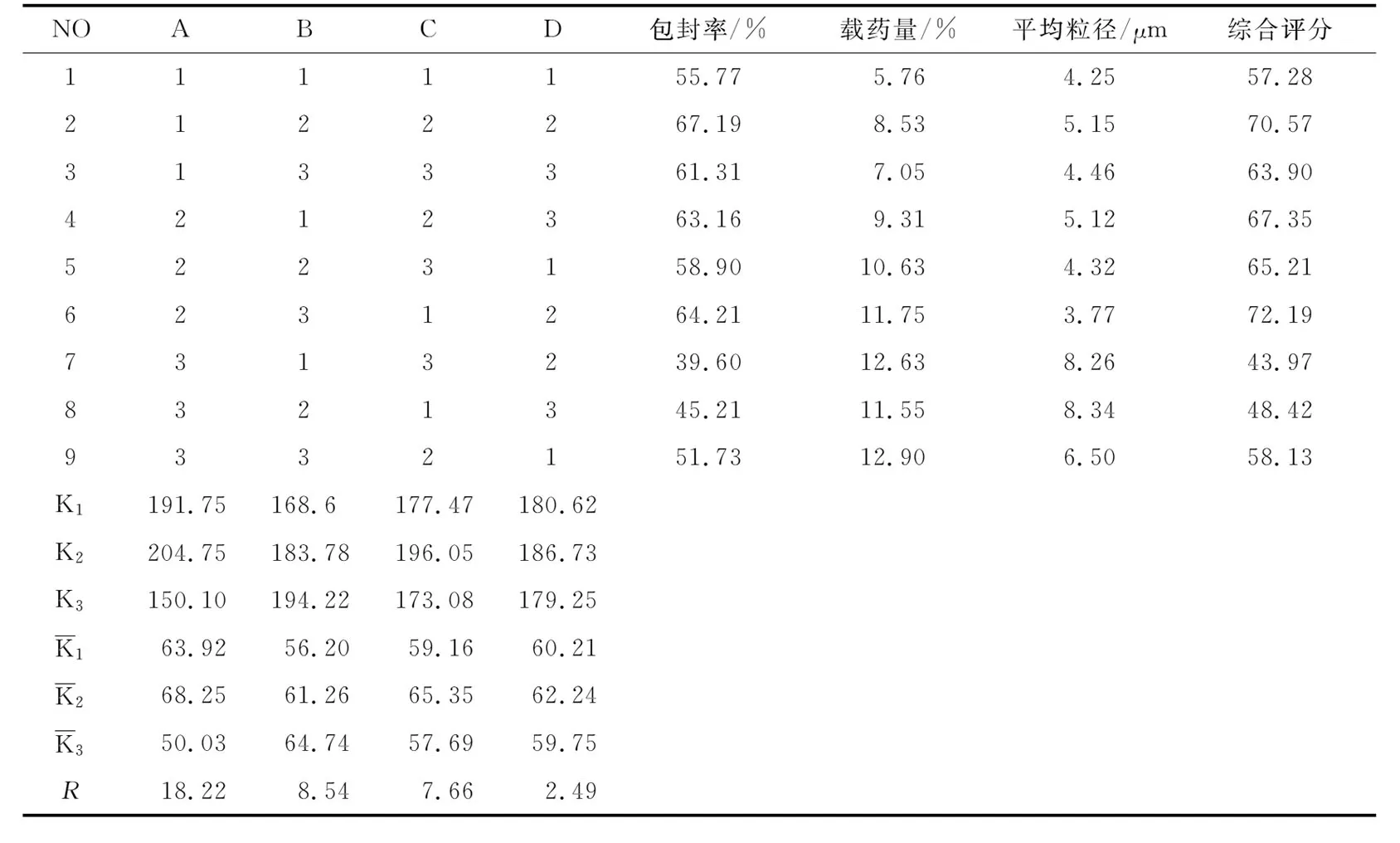
NOABCD包封率/%载药量/%平均粒径/μm综合评分1111155.775.764.2557.282122267.198.535.1570.573133361.317.054.4663.904212363.169.315.1267.355223158.9010.634.3265.216231264.2111.753.7772.197313239.6012.638.2643.978321345.2111.558.3448.429332151.7312.906.5058.13K1191.75168.6177.47180.62K2204.75183.78196.05186.73K3150.10194.22173.08179.25K163.9256.2059.1660.21K268.2561.2665.3562.24K350.0364.7457.6959.75R18.228.547.662.49
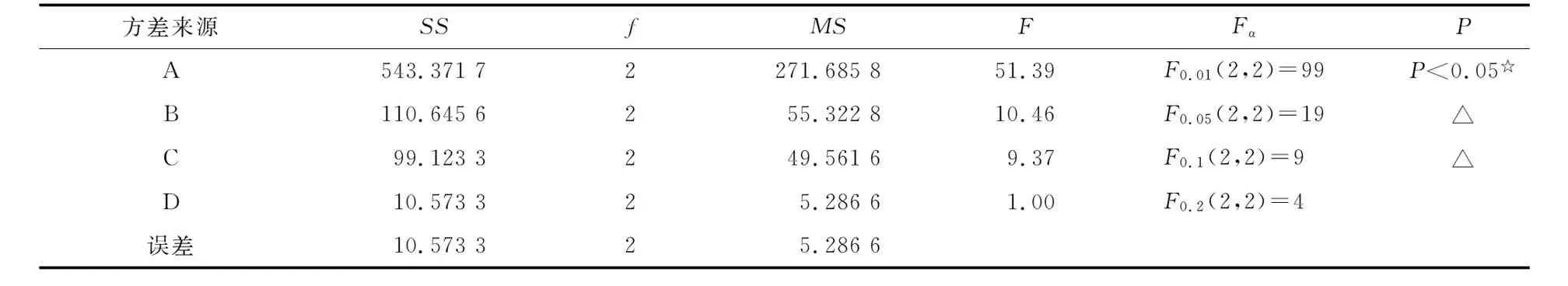
表3 综合评分方差分析
SS:离均差平方和;f:自由度;MS:均方;F:方差比;Fα:α水平的F临界值;P:方差分析作出错误判断的概率.
2.4微球粒径大小及粒径分布按照最佳工艺条件制备的依诺沙星明胶微球,平均粒径为(3.04±0.25)μm,其中粒径为1~6 μm的微球>80%,粒径分布窄,基本符合正态分布(图2)。
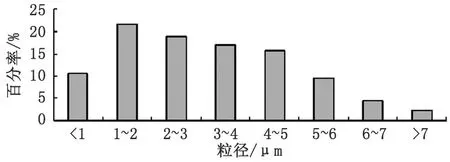
图2 依诺沙星微球粒径分布图Fig 2 Diameter distribution of Enoxacin microspheres
2.5载药微球膜的体外释药载药微球膜中的依诺沙星的释放分为2个过程:首先,依诺沙星从微球中扩散到溶胀后的明胶凝胶层;其次,依诺沙星从凝胶层扩散到缓冲溶液的介质中。普通载药膜中药物仅需从凝胶层扩散到介质中。
载药微球膜和普通载药膜的体外累积释药曲线见图3。普通依诺沙星明胶膜释药迅速,8 h累积释放百分率达到了80%。载药微球膜初始释药较快,这主要是由微球表面的依诺沙星从凝胶层扩散到缓冲溶液介质中引起的突释。大约10 h后突释结束,药物平稳而缓慢地释放,96 h释药约80%,载药微球膜具有比普通载药膜更优越的释放性能。

图3 载药微球膜体外累积释放百分率Fig 3 Accumulated release curve of drug-loaded microsphere galetin film
3讨论
正交设计优选工艺结果表明,明胶浓度对微球的质量影响最大。明胶浓度太低,载药量偏低;过高浓度的明胶制备的微球圆整度较差,粒径变大,包封率降低。微球的粒径与分布很大程度上也受搅拌速度和乳化剂种类与用量的影响。在不产生过多泡沫的前提下,乳化过程中搅拌速度增加,微球粒径变小且粒径分布变窄。乳化剂用量过少,不足以降低表面张力,用量过大则与明胶形成混合胶束,致使戊二醛进入胶束中固化后形成形状各异的杂质,影响微球的外观和质量。本实验中采用4%复合乳化剂获得的微球圆整光滑、分散性好,粘连少,这可能是亲水、亲油性乳化剂形成的混合膜与油相和水相都有较强的亲和力,可以兼顾这两方面的需求。实验表明,乳化时间对微球影响不是很大,当乳化时间足够时,乳液分散均匀,微球粒径小且分布窄。
进一步方差分析可知,在选取的因素水平下,仅明胶溶液浓度对微球质量有显著影响,搅拌速度、乳化剂浓度影响不显著。但数理统计证实,F检验只有当f较大时检验的灵敏度才高,正交试验中,如果f≤5,计算的F值介于F0.1与F0.2之间的,因素对指标也有一定影响,标以△[12]。因此本实验中,搅拌速度和乳化剂浓度对微球综合评分仍有一定的影响。
在微粒给药系统的质量评价中,包封率、载药量和粒径均是重要的考察项目。包封率越高,药物利用率越高,为微球质量的主要评价指标;载药量越高,同样重量的微球中药物含量越高;粒径越小则表面积越大,释放速度稍快而稳定,可防止因微球和明胶薄膜的双重缓释导致释放过慢。本试验中的这3个指标里,包封率的数值相对较大,直接加和求值S可体现出包封率的权重最大。S越大,则微球质量越好。
载药微球膜的体外释放受药物扩散、聚合物的溶胀、水合、蚀解、生物降解等多种机制影响,本实验在pH=7.4的PBS环境中没有溶菌酶,不易发生降解、蚀解过程,故微球内药物以扩散和聚合物水合、溶胀为主。明胶自身具有很强的吸水溶胀性,与戊二醛交联后水溶性显著下降,戊二醛的加入量与改性明胶的溶胀性密切相关,故微球和改性膜中的明胶的交联程度直接影响着体外缓释性能,药物释放速度与明胶交联度的关系有待在后续实验中进一步研究。
本研究通过正交试验优化依诺沙星微球制备工艺,得到的微球粒径均一,包封率高,工艺简单稳定。将载药微球包封依诺沙星后分散于改性明胶膜中制成的生物创伤敷料,不仅具有良好的生物相容性、较好的吸水性、透气性和抗菌止血效果,且缓释长达4 d以上,较普通载药膜具有更优越的缓释效果,可极大地延长药效、减少敷料更换次数和提高患者顺应性等,为开发新型的长效缓释抗菌伤口敷料提供一定的参考。
参考文献:
[1]Draye J P,Delaey B,van de Voorde A,etal.Invitroandinvivobiocompatibility of dextran dialdehyde cross-linked gelatin hydrogel films[J].Biomaterials, 1998,19(28):1677-1687.
[2]Mei L,Sheng M,Wei Z,etal. Novel drug-loaded gelatin film and their sustained-release performance[J].JBiomedMaterResB, 2009,90B:939-944.
[3]赵广建. 几种皮肤生物敷料的生物相容性评价[J].中国组织工程研究与临床康复, 2008,12(14):2701-2704.
[4]Kavoosi G, Dadfar S M, Purfard A M,etal. Mechanical, physical, antioxidant, and antimicrobial properties of gelatin films incorporated with thymol for potential use as nano wound dressing[J].FoodSci, 2013,78:244-250.
[5]Kevadiya B D, Rajkumar S, Bajaj H C,etal. Biodegradable gelatin-ciprofloxacin-montmorillonite composite hydrogels for controlled drug release and wound dressing application[J].ColloidsSurfBBiointerfaces, 2014,122:175-183.
[6]Ulubayram K, Nur Cakar A, Korkusuz P,etal. EGF containing gelatin-based wound dressings[J].Biomaterials, 2001,22(11):1345-1356.
[7]Coardin T, Bah S, Livage J. Gelatine/silicate interactions:from nanoparticles to composite gels[J].ColloidsandSurfacesB:Biointerfaces, 2004,35:53-58.
[8]Young S, Wong M, Tabata Y,etal. Gelatin as a delivery vehicle for the controlled release of bioactive molecules[J].ControlRelease, 2005,109:256-274.
[9]姜丹, 唐召军, 姜云垒, 等. 生物可降解明胶微球的制备及体外降解[J]. 吉林大学学报, 2008,46(1):143-147.
[10]刘一品, 杨小钢, 李常胜, 等. 紫外分光光度法测定依诺沙星含量的改进[J]. 武汉大学学报:医学版, 2001,22(4):367-369.
[11]Bigi A, Cojazzi G, Panzavolta S,etal. Mechanical and thermal properties of gelatin films at different degrees of glutaraklehyde cross-linking[J].BiomaterialsControlRelease, 2001,22:763-768.
[12]何为, 薛卫东, 唐斌. 优化试验设计方法及数据分析[M]. 北京:化学工业出版社, 2012:42-43.
(编辑:何佳凤)

Preparation of a Modified Gelatin Film with Enoxacin Microspheres and Release Behaviour in vitro
WU Hongxia1, LIN Mei2
1.Center for Comprehensive Experimental Pharmacy, Fujian Medical University,Fuzhou 350108, China;2.Department of Medicinal Chemistry,School of Pharmacy, Fujian Medical University, Fuzhou 350108, China
ABSTRACT:ObjectiveTo prepare a modified gelatin film with Enoxacin microspheres and to research its drug release in vitro.MethodsEnoxacin gelatin microspheres were prepared by using emulsion crosslinking method.The optimum technology conditions were selected by orthogonal design method, with the diameter of the microballoon drug-bearing amount, encapsulation rate as the indexes.The microspheres loaded Enoxacin were dispersed into modified gelatin film.The release properties were studied in comparison with unmodified drug-loaded filmin phosphate buffered solution (pH=7.4).ResultsThe optimally prepared Enoxacin microspheres were shaped spherical, evenly distributed with mean diameter of (3.04±0.25) μm.The diameters of 80% of the particles were 1~6 μm.The loading amount of Enoxacin was (11.8±1.02)% and the encapsulation efficiency was (78.24±3.18)%.96 hours and 8 hours were needed to reach the cumulative release of approximately 80% from microspheres film and unmodified drug film, respectively, in phosphate buffered solution.ConclusionsThe technology of Enoxacin microspheres was stable and feasible, and the gelatin film loaded microspheres showed sustained-release evidently in vitro.The modified gelatin film with Enoxacin microspheres has the hope of becoming a novel wound dressing with sustained-released antibacterial effect.
KEY WORDS:Enoxacin; microspheres; gelatin; membranae; pharmaceutical preparations/metabolism
作者简介:吴宏霞(1977-),女,讲师,药学硕士. Email: whxfmu@126.com
基金项目:福建省教育厅科技A类项目(JA13148)
收稿日期:2014-10-27
中图分类号:R341.26; R451; R943.41; R977.6
文献标志码:A
文章编号:1672-4194(2015)01-0011-05
作者单位: 福建医科大学 药学院,福州 3501081.实验中心;2.药物化学系

