新生霉素衍生物FM-NOV17抑制Her2+乳腺癌细胞的作用及其机制
柯春林, 林 帅, 田 崛, 柯 方, 吴丽贤
新生霉素衍生物FM-NOV17抑制Her2+乳腺癌细胞的作用及其机制
柯春林1, 林帅2, 田崛2, 柯方3, 吴丽贤2
摘要:目的研究新生霉素衍生物FM-NOV17对乳腺癌Skbr3细胞的作用,并探讨该作用是否与其干扰热休克蛋白90(Hsp90)分子伴侣的功能从而促进Her2降解有关。方法用蛋白免疫印迹法检测Her2的含量,采用免疫共沉淀的方法研究FM-NOV17对乳腺癌细胞Hsp90分子伴侣功能的影响。用免疫共沉淀的方法将Her2与其分子伴侣复合物沉淀下来,用免疫印迹法检测沉淀物中与Her2结合的Hsp90和辅伴侣Hsp70含量的变化。结果FM-NOV17能降低乳腺癌细胞Skbr3中Her2的蛋白水平,FM-NOV17使Her2与Hsp90和Hsp70的结合减少,降低Her2蛋白水平,诱导细胞周期阻滞和凋亡。结论FM-NOV17通过干扰Hsp90伴侣功能,减少Her2与Hsp90和辅伴侣的结合,降低Her2蛋白量,最终抑制乳腺癌细胞增殖。
关键词:新生霉素; 蛋白质类; Hsp90热休克蛋白质类; 热休克蛋白质类; 分子监控蛋白类; 乳腺肿瘤/细胞学
热休克蛋白90(Hsp90)是细胞中高度保守的一类蛋白,作为分子伴侣对正常细胞和恶性肿瘤细胞中众多蛋白的构象成熟和功能活性进行调控,该分子伴侣功能受Hsp90与辅伴侣的相互作用所调节[1]。在肿瘤细胞中,Hsp90的活性比正常细胞高100倍,与肿瘤细胞高速增殖的需要相匹配,已确定的客户蛋白(client protein)超过100个[2]。Her2是乳腺癌的主要致病相关基因,20%~30%的乳腺癌患者存在Her2过度表达。Her2基因扩增是乳腺癌预后差的独立评估因子,不论淋巴结是否阳性,Her2阳性的乳腺癌患者术后复发风险远高于其他人群[3]。由于Her2是Hsp90的客户蛋白之一,因此,通过抑制Hsp90的分子伴侣功能从而促进Her2蛋白降解就很有可能同时阻断Her2激活的多条与乳腺癌增殖、转移、复发相关的信号传导通路,如Her2-PI3K-AKT通路。
由于Hsp90在肿瘤增殖、侵袭、转移及其预后都扮演着重要的角色,具有“一靶多效”的作用,因此近年来Hsp90已成为抗肿瘤药物作用的重要靶点,许多大制药公司纷纷针对Hsp90设计和合成新化合物,有些已经进入临床研究[4]。按照结合和作用的位点不同,Hsp90抑制剂可分为N-末端抑制剂、C-末端抑制剂、结合位点未明确的抑制剂、调节辅伴侣功能的抑制剂和调节Hsp90翻译后修饰的抑制剂[5]。新生霉素(NOV)是香豆素类抗生素,具有较好的水溶性,除了有抗菌作用,NOV还是Hsp90的C-末端抑制剂,在体内外还能够抑制多种癌细胞的增殖,但其活性较低[6-9],对白血病K562细胞的半数抑制浓度(IC50)高达500 μmol/L[10]。为了提高NOV的抗肿瘤活性,合成具有药用价值的新型化合物,本课题组以NOV为母体化合物进行各种方式的改造,获得一系列新型衍生物,通过体外肿瘤细胞抗肿瘤活性的筛选,获取了活性较强的几个化合物,其中FM-NOV17活性和溶解性均较好,具有一定的成药性。本研究以Hsp90经典抑制剂格尔德霉素(Geldanamycin, GA)为阳性对照药,试图探讨FM-NOV17能否下调Her2高表达的人乳腺癌细胞株Skbr3,并进一步分析该作用机制是否与其阻断Hsp90伴侣功能、促进Her2降解有关,试图进一步为FM-NOV17的体内抗乳腺癌的研究奠定基础。
1材料与方法
1.1材料化合物FM-NOV17由本课题组合成,合成过程如下:在氮气保护下,在50 mL反应瓶中依次加入1.480 g(10 mmol)邻苯二甲酸酐、0.75 g(10 mmol)甘氨酸,于20 mL水中100 ℃反应1 h,冷却至室温后,抽滤,得2.000 g白色固体2-[(羧甲基)氨基甲酰]苯甲酸,产率90%。然后在100 mL反应瓶中依次加入1.67 g(10 mmol)5-硝基水杨醛、2.230 g(10 mmol)2-[(羧甲基)氨基甲酰]苯甲酸、1.641 g(20 mmol)无水乙酸钠和30 mL乙酸酐,120 ℃反应4 h,冷却至室温后,抽滤,得3.186 g白色固体NOV17,产率90%,纯度96%以上,溶解于DMSO,制备成10 mmol/L的母液备用。阳性对照药GA(美国Stressgen公司)溶解于二甲基亚砜(DMSO)中,配成储存液1 mmol/L备用;称取250 mg MTT(美国Sigma公司),加入50 mL PBS (0.01 mol/L,pH=7.4)搅拌30 min后,4 ℃避光储存。Hsp90单克隆抗体(美国Stressgen公司),Hsp27、p23、p60HOP、Hsp70单克隆抗体(美国Cell Signal公司),Her2、p-AKT、AKT、β-Actin单克隆抗体(美国Santa Cruz公司)。
1.2方法
1.2.1细胞培养人乳腺癌细胞株Skbr3培养条件为含体积分数为10%的胎牛血清DMEM,青霉素(100 IU/mL)和链霉素(100 μg/mL),在37 ℃,体积分数为0.05的CO2孵育箱中培养。取对数生长期细胞用于实验,接种细胞浓度为5×105mL-1。
1.2.2MTT法观察FM-NOV17对乳腺癌细胞增殖的抑制作用参照文献[10],实验设空白对照组、阳性对照组、不同浓度加药组,每组设3个复孔,实验重复3次,计算IC50。
1.2.3免疫共沉淀法参照文献[10],收集1×107Skbr3细胞裂解,取上清液,即为细胞总蛋白。从总细胞蛋白中分离Her2/Hsp90/Hsp70蛋白复合物。40 μL Protein A-agarose用RIPA液洗涤3次,加入30 μL(200 mg/L)单抗,4 ℃摇床孵育过夜,离心,二级复合物洗涤3次,加入细胞总蛋白与该复合物4 ℃摇床孵育,收集三级复合物,与Her2偶联的Hsp90和Hsp70也一起沉淀下来,所得蛋白复合物用Western-blot检测。
1.2.4免疫印迹法检测蛋白含量变化参照文献[10],提取药物处理后的细胞总蛋白,定量,加等量蛋白于SDS聚丙烯酰胺凝胶中进行电泳,或用免疫共沉淀法所得样品电泳。电泳后转膜,加入封闭液封闭1 h后,加Her2、Hsp90、Hsp70、Hsp27、p23、p60HOP、p-AKT、AKT或β-Actin单抗室温作用1 h或者过夜,洗去未结合的一抗,以Western-blot试剂盒加二抗,染色,拍照。
1.2.5FM-NOV17对乳腺癌细胞周期和细胞凋亡的影响取对数生长期的Skbr3细胞,不同浓度的FM-NOV17处理Skbr3细胞48 h,收集Skbr3细胞;用75%冰冷的乙醇-20 ℃固定,用含50 μg/mL RNA酶和50 μg/mL碘化丙啶(PI)的PBS重悬细胞,避光孵育30 min,流式细胞仪检测,采用Modifit软件分析各个细胞周期时相的百分率。收集FM-NOV17处理的Skbr3细胞,用含有5 μL Annxin V-FITC和5 μL PI 的Binding Buffer避光孵育15 min,流式细胞仪检测凋亡百分率。
2结果
2.1FM-NOV17对Skbr3细胞的抑制作用FM-NOV17的化学结构如图 1A所示。用MTT法检测FM-NOV17处理24 h对Skbr3细胞的增殖抑制率,用GraphPad Prism 5软件计算IC50。随着药物浓度的增加,细胞增殖抑制率也增加,呈量效关系,IC50为0.827 μmol/L(图1B)。提示FM-NOV17对Her2阳性乳腺癌具有较强的抑制作用。

A:FM-NOV17 的化学结构(354 Da);B:FM-NOV17对Skbr3细胞作用24 h的量效关系. 图1 FM-NOV17的化学结构及其对Skbr3细胞的作用Fig 1 Chemical structure of FM-NOV17 and its effect on growth of Skbr3 cells
2.2FM-NOV17对Skbr3细胞中Her2蛋白及其下游AKT信号通路的影响FM-NOV17 1 μmol/L处理细胞24 h,可见Skbr3细胞中Her2蛋白明显减少;其下游信号通路的AKT和p-AKT均减少(图2)。说明FM-NOV17能够有效减少Her2蛋白水平从而抑制其下游的AKT信号通路。
2.3FM-NOV17对Skbr3细胞中Her2/Hsp90/Hsp70复合物的影响
2.3.1FM-NOV17对Skbr3细胞中Her2/Hsp90结合的影响FM-NOV17短时间处理6 h可明显抑制Her2/Hsp90蛋白复合物含量,使得与Hsp90结合的Her2减少。反之,用Her2单抗免疫共沉淀Her2/Hsp90复合物,得到相似的结果(图3)。结果表明,在Her2蛋白含量减少之前,FM-NOV17就可抑制Hsp90伴侣功能,使Her2和Hsp90之间的相互结合减少,很可能使得Her2蛋白失去Hsp90的保护后被蛋白酶体迅速降解。

1.CTL;2.FM-NOV17 1 μmol/L;3.GA 5 μmol/L. 药物处理Skbr3细胞24 h,用蛋白免疫印迹法检测细胞内Her2蛋白及其下游AKT信号水平.图2 FM-NOV17对Skbr3细胞Her2蛋白及AKT的影响Fig 2 Effects of FM-NOV17 on Her2 protein level and AKT signal in Skbr3 cells
2.3.2FM-NOV17对乳腺癌Skbr3细胞Her2/Hsp70结合的影响FM-NOV17短时间处理6 h后,Her2蛋白和Hsp70蛋白的结合减少,这点作用也与N-末端抑制剂不同,GA可使Skbr3细胞中Her2和Hsp70的结合增加(图3)。提示FM-NOV17对Hsp90伴侣功能的抑制作用与经典的Hsp90 N-末端抑制剂不同。
2.3.3FM-NOV17对乳腺癌Skbr3细胞中Hsp90/Hsp70伴侣复合物的影响免疫共沉淀的结果表明,FM-NOV17可以抑制Hsp90与辅伴侣Hsp70的结合减少,进一步提示Hsp90失去保护客户蛋白的伴侣功能。
2.4FM-NOV17对Skbr3细胞热休克蛋白的影响FM-NOV17对热休克相关蛋白的影响的检测结果表明,FM-NOV17 1 μmol/L处理细胞24 h,可引起Skbr3细胞中Hsp27和p60HOP蛋白减少,而Hsp70蛋白不变,这与经典的Hsp90 N-末端抑制剂不同。如图4所示,阳性对照药GA可引起抗凋亡因子Hsp70明显增加。
2.5FM-NOV17引起Skbr3细胞周期阻滞FM-NOV17处理细胞48 h,可显著引起Skbr3细胞阻滞于S期和G2/M期,S期细胞百分比从48.55%增加到60.16%,G2/M期细胞百分比从13.26%增加到32.08%,提示FM-NOV17可能导致乳腺癌细胞有丝分裂障碍(图5)。
2.6FM-NOV17诱导Skbr3细胞凋亡用含有Annxin V-FITC和PI的缓冲液避光孵育细胞15 min,用流式细胞仪检测FM-NOV17诱导Skbr3细胞凋亡百分率。结果表明,FM-NOV17可以显著诱导Skbr3细胞凋亡,早期凋亡细胞(Annexin V+/PI-)的百分率从3.7%增加至36.9%,晚期凋亡细胞(Annexin V+/PI+)的百分率从0.8%增加至11.4%(图6)。
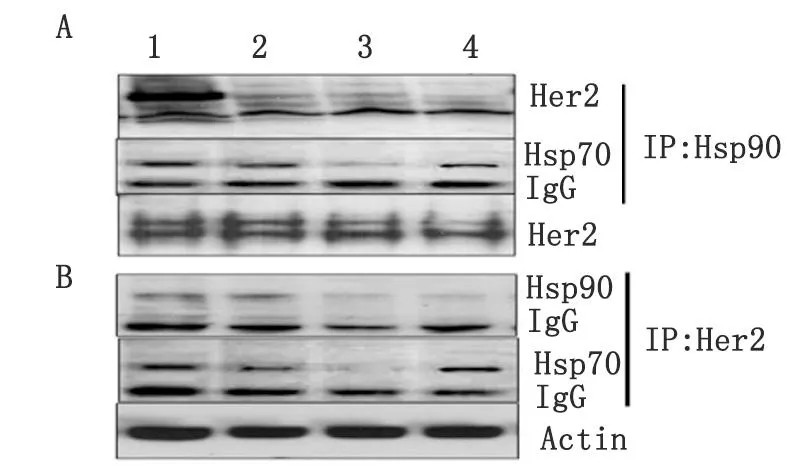
1.CTL;2.FM-NOV17 0.5 μmol/L;3.FM-NOV17 1 μmol/L; 4.GA 5 μmol/L. A:用Hsp90单抗免疫共沉淀与Hsp90结合的客户蛋白及辅伴侣分子;B:用Her2单抗免疫共沉淀与Her2结合的Hsp90及其辅伴侣分子. 药物处理Skbr3细胞6 h,结合使用免疫共沉淀和蛋白印迹法检测Her2/Hsp90/Hsp70复合物形成情况.图3 FM-NOV17对Her2/Hsp90和Hsp90/Hsp70结合的影响Fig 3 Effects of FM-NOV17 on chaperone complexes associated with Hsp90

1.CTL;2.FM-NOV17 1 μmol/L;3.GA 5 μmol/L.药物处理Skbr3细胞24 h,使用蛋白免疫印迹法检测细胞内热休克相关蛋白表达水平.图4 FM-NOV17对Skbr3细胞热休克相关蛋白表达的影响Fig 4 Effects of FM-NOV17 on Hsps in Skbr3 cells
3讨论
Hsp90经典抑制剂GA由于较大的肝毒性及较差的水溶性等缺点,限制了其在临床上的应用。通过化学改造,把17位甲氧基用烯丙胺基取代后得到的衍生物17-烯丙胺-17-去甲氧基格尔德霉素(17-allyamino-17-demethoxygeldanamycin,17-AAG),有更高的抗肿瘤活性和更低的肝毒性,是第一个进入临床试验的Hsp90抑制剂[11-13]。但是17-AAG的水溶性较差,生物利用度有限,对不同类型的肿瘤疗效差异性较大。因此合成更加高效低毒且不易被肿瘤细胞耐药的新型Hsp90抑制剂成为临床的迫切需要。基于此,本课题组以多种母体化合物为基础,通过不同的合成路径,合成并筛选了一系列的Hsp90抑制剂,期望能合成和筛选到成药性较强的新型Hsp90抑制剂。
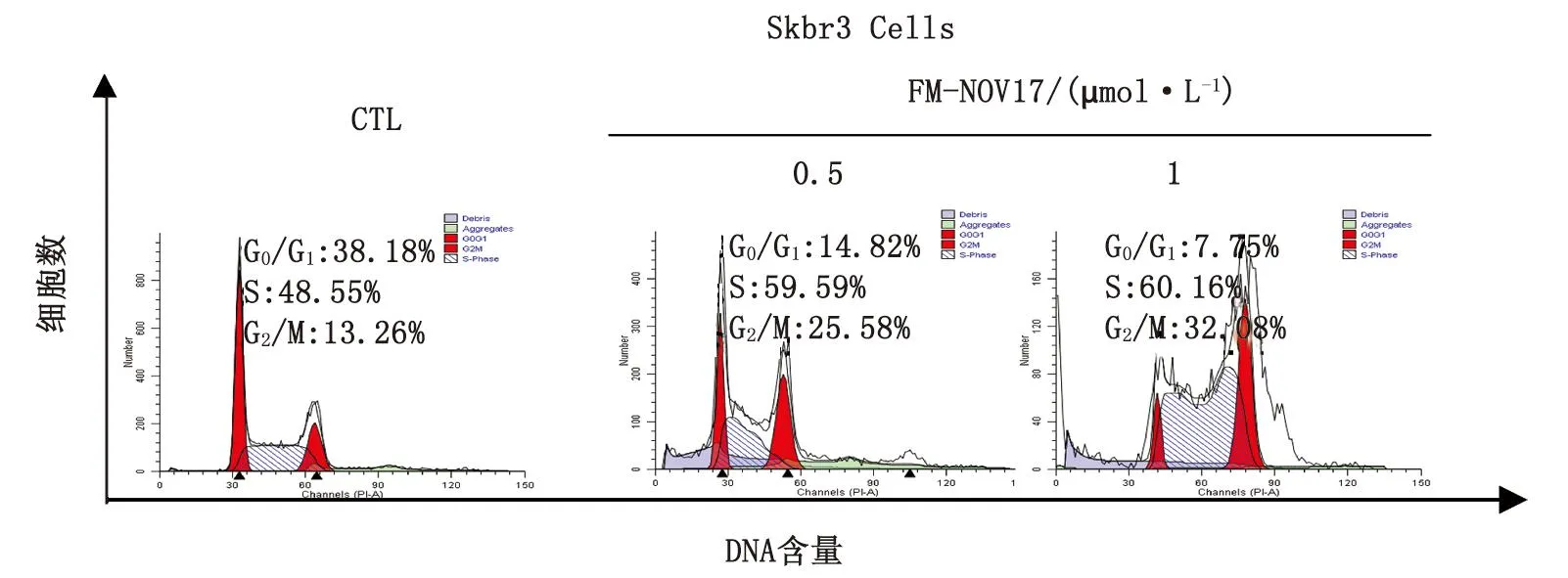
FM-NOV17处理细胞48 h,使Skbr3细胞细胞周期阻滞于G2/M期.图5 FM-NOV17对Skbr3细胞细胞周期进程的影响Fig 5 Effects of FM-NOV17 on cell cycle in Skbr3 cells

FM-NOV17处理细胞48 h,呈剂量依赖性地诱导细胞凋亡.图6 FM-NOV17诱导Skbr3细胞凋亡Fig 6 Apoptosis induced by FM-NOV17 in Skbr3 cells
乳腺癌是发生在乳腺腺上皮组织的恶性肿瘤,是女性最常见的恶性肿瘤之一,发病率占全身各种恶性肿瘤的7%~10%。Her2又称人表皮生长因子受体-2,Her2阳性乳腺癌是“最凶险的乳腺癌”,Her2基因扩增是乳腺癌预后差的独立评估因子。Her2可以激活PI3K-AKT-mTOR、Ras-Raf-MEK-ERK等多条信号传导通路,刺激乳腺癌细胞增殖。因此Her2是乳腺癌治疗的一个重要靶点。尽管Her2的单克隆抗体赫赛汀能一定程度延长患者的生存期,但其作用仍然有限,且有过敏反应等不良反应,而且临床治疗成本高昂。因此寻找成本低、疗效好、毒性低、能抑制Her2激活的信号途径的新化合物成为临床需要。
在Skbr3细胞中,Her2蛋白与Hsp90和辅伴侣分子形成复合物,保护Her2蛋白具有传递增殖信号的活性,不容易被蛋白酶所水解。AKT信号通路是肿瘤细胞增殖的重要信号通路,Her2蛋白能够激活该通路。本研究表明,基于NOV的新型化合物FM-NOV17可使Her2/Hsp90/Hsp70复合物减少,使得Her2失去伴侣分子保护,最终可能被蛋白酶体所降解,从而引起Her2蛋白水平降低。作为下游的信号通路AKT的活性也随之被抑制,表现为AKT和p-AKT减少。
经典的Hsp90抑制剂会诱导抗凋亡因子Hsp70的表达,提示肿瘤细胞可能对经典的N-末端抑制剂容易产生耐药性。为了研究FM-NOV17是否也会像N-末端抑制剂一样诱导Hsp70、Hsp27和p60HOP等热休克相关蛋白的表达,用免疫印迹法分析这些热休克相关蛋白水平。本研究结果表明,FM-NOV17和GA一样都能使Her2和Hsp90结合减少,但是FM-NOV17使与Hsp70结合的Her2和Hsp90均减少,相反,GA使与Hsp70结合的Her2和Hsp90均增加。提示与经典N-末端抑制剂相比,FM-NOV17不容易诱导耐药因子Hsp70的表达,因此可能更不容易诱导肿瘤细胞的化疗耐药性。而且FM-NOV17对Hsp90伴侣功能的影响发生在Her2蛋白减少之前,因此FM-NOV17很可能是通过抑制Hsp90伴侣功能来减少Her2蛋白,是一种新型的Hsp90抑制剂。
细胞凋亡是由基因控制的细胞自主的有序的死亡,不是一个被动的过程,而是主动过程,它涉及一系列信号级联反应。细胞凋亡的早期,膜磷脂酰丝氨酸由脂膜内侧翻向外侧。Annexin V是一种磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,它通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。因此Annexin V是检测细胞早期凋亡的灵敏指标。凋亡晚期,细胞核通透性增加,PI可以进入细胞核。本研究表明,与经典N-末端抑制剂GA能够抑制乳腺癌细胞增殖、诱导凋亡、引起细胞周期阻滞作用相似[14],FM-NOV17能干扰Her2+乳腺癌细胞Hsp90伴侣功能,促进Her2蛋白降解,下调Her2激活的下游细胞信号通路,从而诱导乳腺癌细胞凋亡,最终抑制Her2高表达乳腺癌细胞生长。
参考文献:
[1]Solit D B, Rosen N. Hsp90: a novel target for cancer therapy[J].CurrTopMedChem, 2006,6(11):1205-1214.
[2]Krämer O H, Mahboobi S, Sellmer A. Drugging the HDAC6-HSP90 interplay in malignant cells[J].TrendsPharmacolSci, 2014,35(10):501-509.
[3]Choi J S, Kim H O, Kim E K,etal. HER2 expression in fine needle aspirates of lymph nodes detected by preoperative axillary ultrasound in breast cancer patients[J].PloSOne, 2014,9(11):e113065.
[4]Proia D A, Bates R C. Ganetespib and HSP90: translating preclinical hypotheses into clinical promise[J].CancerRes, 2014,74(5):1294-1300.
[5]Zagouri F, Sergentanis T N, Chrysikos D,etal. Hsp90 inhibitors in breast cancer: a systematic review[J].Breast, 2013,22(5):569-578.
[6]Sidera K, Patsavoudi E. HSP90 inhibitors: current development and potential in cancer therapy[J].RecentPatAnticancerDrugDiscov, 2014,9(1):1-20.
[7]Zhao J, Zhao H, Hall J A,etal. Triazole containing Novobiocin and Biphenyl amides as Hsp90 C-Terminal inhibitors[J].Medchemcomm, 2014,5(9):1317-1323.
[8]Audisio D, Methy-Gonnot D, Radanyi C,etal. Synthesis and antiproliferative activity of novobiocin analogues as potential hsp90 inhibitors[J].EurMedChem, 2014,83:498-507.
[9]Zhao H, Anyika M, Girgis A,etal. Novologues containing a benzamide side chain manifest anti-proliferative activity against two breast cancer cell lines[J].BioorgMedChemLett, 2014,24(15):3633-3637.
[10]Wu L X, Xu J H, Zhang K Z,etal. Disruption of the Bcr-Abl/Hsp90 protein complex: a possible mechanism to inhibit Bcr-Abl-positive human leukemic blasts by novobiocin[J].Leukemia, 2008,22(7):1402-1409.
[11]Kim L S, Kim J H. Heat shock protein as molecular targets for breast cancer therapeutics[J].JBreastCancer, 2011,14(3):167-174.
[12]Schulte T W, Neckers L M. The benzoquinone ansamycin 17-allylamino-17-demethoxygeldanamycin binds to HSP90 and shares important biologic activities with geldanamycin[J].CancerChemotherPharmacol, 1998,42(4):273-279.
[13]Supko J G, Hickman R L, Grever M R,etal. Preclinical pharmacologic evaluation of geldanamycin as an antitumor agent[J].CancerChemotherPharmacol, 1995,36(4):305-315.
[14]Xu W, Yuan X, Jung Y J,etal. The heat shock protein 90 inhibitor geldanamycin and the ErbB inhibitor ZD1839 promote rapid PP1 phosphatase-dependent inactivation of AKT in ErbB2 overexpressing breast cancer cells[J].CancerRes, 2003,63(22):7777-7784.
(编辑:何佳凤)
《福建医科大学学报》
双月刊CN 35-1192/R邮发代号 34-66
欢迎投稿欢迎订阅
Effects of FM-NOV17 on Her2+Breast Cancer Cells And its Mechanisim
KE Chunlin1, LIN Shuai2, TIAN Jue2, KE Fang3, WU Lixian2
1. Department of Radiation Oncology, The First Affiliated Hospital of Fujian Medical University, Fuzhou 350001, China;2. Department of Pharmacology, Fuijan Key Laboratory of Natural Medicine Pharmacology,Fujian Medical University,Fuzhou 350108, China;3. Department of Pharmacochemistry, School of Pharmacy, Fujian Medical University, Fuzhou 350108, China
ABSTRACT:ObjectiveTo confirm the effects of FM-NOV17, one of novobiocin derivatives, on breast cancer cells (Skbr3), and to study the relationship between these effects and the molecular chaperone functions of heat shock protein 90 (Hsp90).MethodsThe quantity of Her2 protein was determined by Western-blot.Molecular chaperone functions of Hsp90 on breast cancer cells were measured by coimmunoprecipitation.After the co-immunoprecipitation of Her2 and its molecular chaperones, the immunoprecipitate was then subjected to Western-blot analysis with anti-Her2 to study changes in quantity of anti-Hsp90, or anti-Hsp70 mAb.ResultsAn exposure of Skbr3 cells to FM-NOV17 led to down-regulation of intracellular Her2 protein levels.FM-NOV17 treatment also decreased the binding of Her2 with Hsp90 and Hsp70.Consequently, apoptosis and cell cycle arrest were induced.ConclusionsThese studies demonstrate that the activities of FM-NOV17 might inhibit breast cancer cells through the disruption of Hsp90 chaperon function, which results in disruption of the binding of Her2 to Hsp90 and cochaperons and the level of Her2 protein.That may be an important mechanism, by which FM-NOV17 mediates its effects on breast cancer cells.
KEY WORDS:novobiocin; proteins; Hsp90 heat-shock proteins; heat-shock proteins; molecular chaperones; breast neoplasms/cytology
通讯作者:吴丽贤. Email: wlx-lisa@126.com
作者简介:柯春林(1977-),男,主治医师
基金项目:国家自然科学基金(81273541);福建省自然科学基金杰出青年项目(2011J06013)
收稿日期:2014-11-21
中图分类号:R329.2;R329.25;R737.9;R977.6;R978.15
文献标志码:A
文章编号:1672-4194(2015)01-0001-06
作者单位: 福建医科大学 1. 附属第一医院 放射治疗科,福州350001;2. 药学院 药理系,福建省天然药物药理学重点实验室,福州350108;3. 药学院 药化系,福州350108

