环形泰勒虫表面抗原Tasp-Spag1基因串联表达及其蛋白生物信息学分析
任 方,易 忠,米晓云,魏 婕,马文戈,郭会玲,苗书魁,汪立群,王 延,薛 英,黄 炯,魏玉荣*(.新疆畜牧科学院兽医研究所,新疆乌鲁木齐830000;.新疆维吾尔自治区动物卫生监督所,新疆乌鲁木齐830063;3.新疆农业大学动物医学学院,新疆乌鲁木齐83005)
环形泰勒虫表面抗原Tasp-Spag1基因串联表达及其蛋白生物信息学分析
任方1,3,易忠1,米晓云1,魏婕1,马文戈1,郭会玲1,苗书魁1,汪立群2,王延1,薛英1,黄炯1,魏玉荣1*
(1.新疆畜牧科学院兽医研究所,新疆乌鲁木齐830000;2.新疆维吾尔自治区动物卫生监督所,新疆乌鲁木齐830063;3.新疆农业大学动物医学学院,新疆乌鲁木齐830052)
摘 要:研究环形泰勒虫表面抗原特性,以原核表达系统串联表达其表面抗原Tasp-Spag1,并对其蛋白进行生物信息学分析。通过PCR技术扩增Tasp-Spag1基因片段后构建重组质粒pET-28a-Tasp-Spag1,IPTG诱导重组蛋白表达,SDS-PAGE、Western blot检测;运用生物信息学软件对Tasp-Spag1基因片段进行分析,并预测其编码蛋白的主要特性与抗原表位。结果显示,扩增得到Tasp-Spag1基因长度为729bp,原核表达后通过SDS-PAGE与Western blot检测显示,得到大小与预期分子质量相当的目的蛋白;生物信息学分析发现,此串联重组蛋白Tasp-Spag1具有236个氨基酸,属于不稳定的非分泌型、非跨膜亲水蛋白,分别具有33个与21个可能的糖基化与磷酸化位点,有三段低复杂性的结构域,并且含有Sorb、NL的同源区域,可能有10个B细胞表位优势区段与7个T细胞表位优势区段,具有两段交叉反应性表位肽。
关键词:环形泰勒虫;串联重组蛋白;原核表达;生物信息学
环形泰勒虫病是由寄生于动物红细胞、淋巴细胞及巨噬细胞内的环形泰勒虫(Theileria annula-
櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙櫙
ta)引发的一种蜱传急性、热性血液原虫病。此病呈地方流行性,不仅发病率与死亡率较高,当病畜耐过此病或治愈后,体内仍存在低水平的虫体,导致抵抗力下降,或其他疾病暴发时再次诱发此病[1-2]。
裂殖体表面抗原(Theileria annulata surface protein,Tasp)与子孢子表面抗原(sporozoite antigen,Spag1)已被确认具有较好的免疫原性,可作为诊断与预防环形泰勒虫病的理想候选抗原[3-4]。环形泰勒虫存在表面抗原的多态性,串联表面优势抗原可为筛选理想的候选抗原提供一条新的思路。
本研究应用PCR方法扩增环形泰勒虫Tasp-Spag1基因片段,并对Tasp-Spag1基因进行原核表达,通过Western blot检测原核表达产物的反应性,通过生物信息学方法分析此串联表面蛋白的主要特性,推测其蛋白可能存在的抗原表位优势区段,为深入研究串联重组蛋白的免疫原性提供理论依据。
1 材料与方法
1.1材料
1.1.1菌株、质粒及细胞 质粒pMD-TaSPSPAG1、pET-28a、BL21(DE3)表达宿主菌由由新疆畜牧科学院兽医研究所传染病研究室保存;pEASY-T1载体、Trans1-T1感受态细胞为北京全式金公司产品。
1.1.2主要试剂 DNA聚合酶、2.5mmol/L的dNTP mixture、10×buffer(Mg2+plus)为宝生物工程(大连)有限公司产品;限制性内切酶BamHⅠ和XhoⅠ、小量质粒提取试剂盒、琼脂糖凝胶回收试剂盒为Promega公司产品;T4DNA连接酶为Bio-Labs公司产品;4×SDS双色加样缓冲液为武汉博士德生物公司产品;牛环形泰勒虫阳性血清为新疆畜牧科学院兽医所提供;HRP标记的兔抗牛IgG为Sigma公司产品。
1.2方法
1.2.1引物的设计与合成 根据质粒pMD-TaSPSPAG1序列,应用Oligo 6软件设计扩增Tasp-Spag1基因片段的引物,由上海生工生物工程技术服务有限公司合成。引物序列如下:TS F:5′-AATGGATCC(BamHⅠ)ATGGAAGATCAACAGCCTTTG-3′;TS R:5′-AACCTCGAG(XhoⅠ)TTAGAGTTTGTTTTTGATCTTTTG-3′。
1.2.2基因片段PCR扩增 以质粒pMD-TaSPSPAG1为模板,扩增Tasp-Spag1基因片段,PCR反应体系25μL:2.5μL 10×buffer(Mg2+plus),4μL 2.5mmol/L dNTPs,20μmol/L上下游引物各1μL,0.3μL模板DNA,0.25μL 5 U/μL TaqHS,15.95μL ddH2O。扩增反应程序分别为:94℃5min;94℃45s,53.4℃30s,72℃42s,30个循环;72℃10min;4℃终止反应。经10g/L琼脂糖凝胶电泳检测正确的目的条带,利用凝胶回收试剂盒回收纯化。
1.2.3pEASY-T1-Tasp-Spag1载体的构建 回收纯化的PCR产物与pEASY-T1载体连接,按试剂盒说明操作后转化至Trans1-T1感受态细胞中。培养后挑取单菌落摇菌提取质粒并鉴定,鉴定正确的质粒命名为pEASY-T1-Tasp-Spag1。
1.2.4重组表达载体的构建与鉴定 pEASY-T1-Tasp-Spag1重组质粒与原核表达载体pET-28a同时用BamHⅠ和XhoⅠ进行双酶切并回收目的片段后,在T4DNA Ligase的作用下连接,按T4Ligase说明操作,将连接产物转化至感受态细胞中培养并提取重组质粒。重组质粒pET-28a-Tasp-Spag1双酶切鉴定后测序,测序正确后,将重组质粒转化至菌株BL21(DE3)中。
1.2.5重组质粒的诱导表达 挑取阳性转化菌落接种于3 mL LB液体培养基(Kan+)中,37℃220r/min震荡培养过夜,次日以1∶100的体积将菌液接种于LB液体培养基(Kan+)中继续震荡培养至OD600nm=0.4~0.8时,加入IPTG至终浓度1mmol/L,诱导表达4h。同时以诱导前的菌液与诱导的转化pET-28a空载体的菌液作为对照。将培养好的菌液5 000r/min离心5min,收集菌体,洗涤后加入灭菌的PBS缓冲液(pH7.4),悬浮菌体后充分超声破碎菌体,待菌体澄清透明后加入上样缓冲液煮沸10min后,取10μL进行120g/L SDS-PAGE电泳检测分析。
1.2.6重组表达蛋白的Western blot检测 表达的蛋白转至NC膜后,用含50g/L脱脂牛奶的PBST封闭4℃过夜,以牛环形泰勒虫阳性血清(1∶100)为一抗,孵育2h,PBST缓冲液洗膜后,以HPR标记的兔抗牛IgG为二抗,孵育1h,用PBST缓冲液洗涤后进行DAB显色后拍照保存。
1.2.7重组蛋白Tasp-Spag的生物信息学分析运用Expasy、TMPRED、SignalIP、SOPMA、CBS、SMART、COMPLUTENSE、ABCpred、SYFPEITHI、NetMHC等在线生物软件,结合DNA Star、DNA Man等生物软件,分析和预测Tasp-Spag1重组蛋白的主要特性、糖基化与磷酸化位点、抗原表位等。
2 结果
2.1Tasp-Spag1基因的PCR扩增
以质粒pMD-TaSP-SPAG1为模板进行PCR扩增,获得与预期相符的长约729bp的目的条带(图1)。
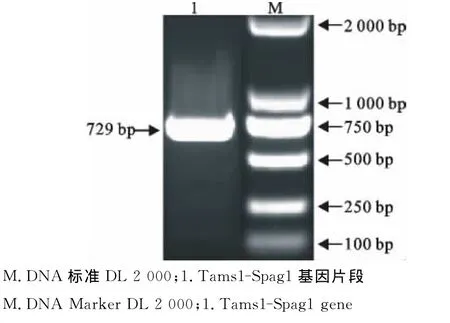
图1 Tasp-Spag1基因的PCR扩增Fig.1 PCR amplilation of Tasp-Spag1gene
2.2Tasp-Spag1基因原核表达载体构建结果
重组质粒pET-28a-Tasp-Spag1经BamHⅠ和XhoⅠ双酶切鉴定得到长约729bp的基因片段与5 369bp的pET-28a载体片段(图2),大小与理论值相符。
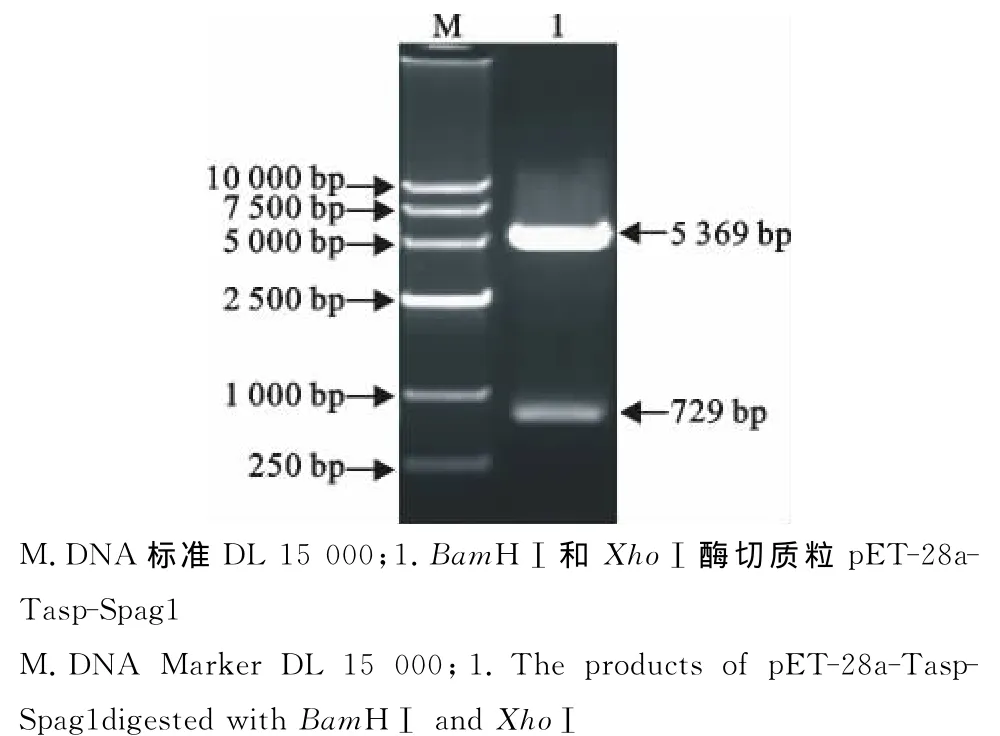
图2重组质粒的酶切鉴定Fig.2 Identification of recombinant plasmid by enzyme digestion
2.3重组质粒的诱导表达结果
用1mmol/L IPTG诱导重组菌,诱导时间为4h后,应用SDS-PAGE电泳检测分析,与对照组相比,得到大小与预期分子质量相当的目的蛋白(图3)。
2.4重组表达蛋白的Western blot检测
用牛环形泰勒虫病阳性血清抗体进行免疫印迹试验,与SDS-PAGE电泳胶相对应的位置出现特异性杂交条带,而对照的表达产物则无此条带(图4),可以确定重组蛋白表达且具有反应原性。
2.5重组蛋白Tasp-Spag1的生物信息学分析
2.5.1Tasp-Spag1重组蛋白的基本性质 重组蛋白TaSP-SPAG1编码236个氨基酸,分子质量为24.97ku。等电点理论值为4.21,半衰期为30h,平均亲水系数为-1.172,不稳定系数为62.62,归类为亲水性不稳定蛋白。
重组蛋白骨架区含有较多的柔韧性区域且分布均匀,可以形成丰富的二级结构(图5);重组蛋白主要区域均位于蛋白亲水区域,表明此区域可能是B细胞表位优势区域(图6)。
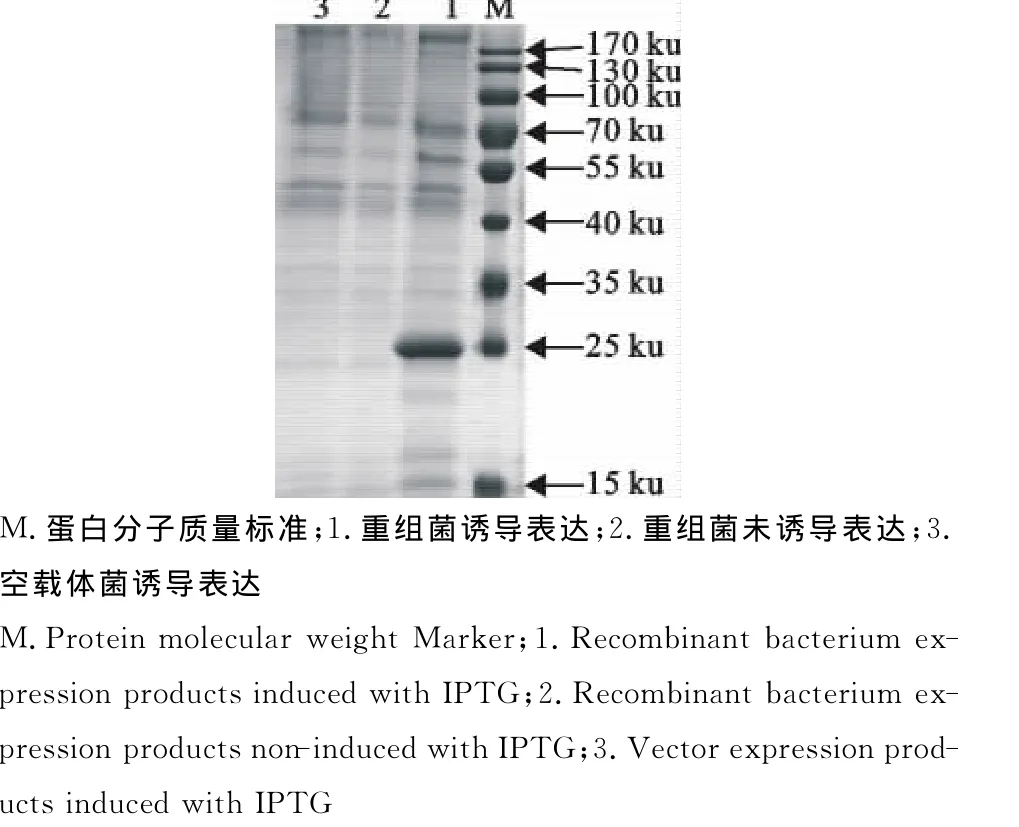
图3 重组蛋白的诱导表达Fig.3 Induced expression of the recombinant protein
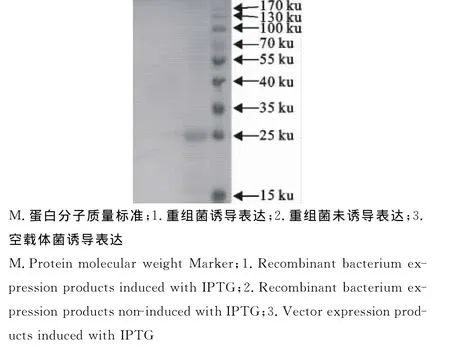
图4 重组蛋白Western blot的检测Fig.4 Western blot analysis of the recombinant protein

图5 重组蛋白Tasp-Spag1柔韧性分析Fig.5 Analysis of the flexibility of the recombinant protein Tasp-Spag1
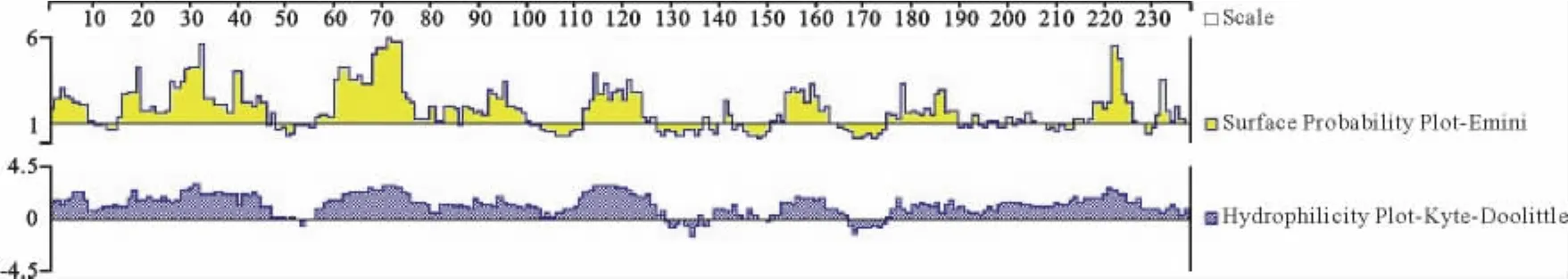
图6 重组蛋白Tasp-Spag1表面可能性、亲水性分析Fig.6 Analysis of the surface probability and hydrophobicity of the recombinant protein Tasp-Spag1
重组蛋白质存在两个疏水区域(图7),具体位置为129-138、167-174。结果显示,亲水性的最高分为-2.989,疏水性的最高分为1.456,整个多肽链分值大部分都大于0,说明这些蛋白属亲水性蛋白。TMPRED分析发现,此蛋白不存在可能的跨膜区域及信号肽。因此,预测重组蛋白Tasp-Spag1属于非分泌型非跨膜蛋白。
2.5.2Tasp-Spag1重组蛋白的翻译后修饰位点 预测可知,Tasp-Spag1重组蛋白氨基酸序列存在1个潜在的N-糖基化位点(Asn 200);31个潜在的O-糖基化位点(Thr26、Thr38、Ser41、Thr48、Thr50、Thr58、Ser59、Ser62、Ser65、Thr66、Thr68、Ser78、Thr92、Ser94、Thr95、Thr97、Ser100、Ser101、Ser102、Thr158、Ser169、Ser180、Thr183、Thr185、Ser188、Thr195、Thr196、Thr202、Thr205、Thr206 和Thr207)。对Tyr、Ser和Thr磷酸化位点进行预测,发现Tasp-Spag1重组蛋白含21个潜在的磷酸化位点(Ser19、Ser29、Ser41、Ser59、Ser62、Ser78、Ser100、Ser101、Ser102、Ser118、Ser123、Ser125、Ser142、Ser152、Ser155、Ser156、Thr58、Thr66、Thr68、Thr95和Thr207)。
2.5.3Tasp-Spag1重组蛋白二级结构的预测 预测Tasp-Spag1重组蛋白二级结构中可能存在40个α螺旋(总长的16.95%),184个无规则卷曲(占77.97%),12个延伸链(占5.08%)(图8)。
2.5.4Tasp-Spag1重组蛋白结构功能域分析Tasp-Spag1氨基酸序列28-83位、110-142位及195-228位间为低复杂性的结构域,且81-120位之间含有Sorb的同源区域,96-121位之间含有NL的同源区域。
2.5.5Tasp-Spag1重组蛋白抗原表位的预测 预测Tasp-Spag1重组蛋白具有6个B细胞抗原表位优势区域(图9和表1)和7个T细胞表位优势区域(表2),综合重组蛋白Tams1-Spag的B细胞及T细胞表位优势区域,重组蛋白Tams1-Spag的T、B细胞联合表位可能的区域为162-171aa(KPAELGPSLV)、87~94(VVDKFSPL)。
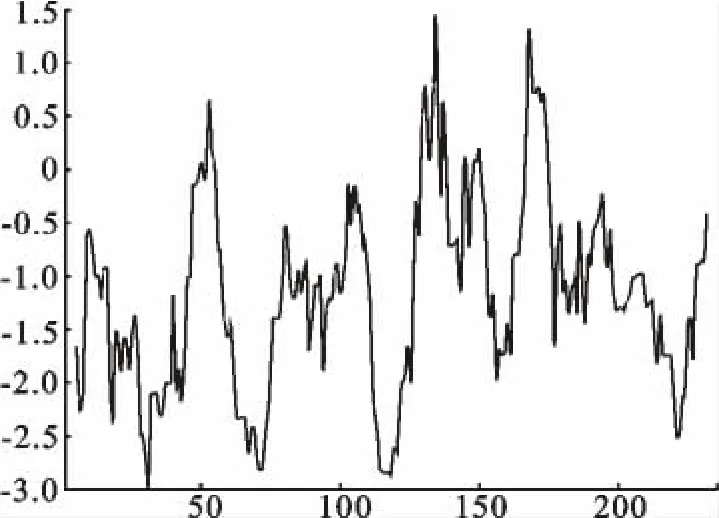
图7 重组蛋白Tasp-Spag1疏水性分析Fig.7 Analysis of the hydrophobicity of the recombinant protein Tasp-Spag1
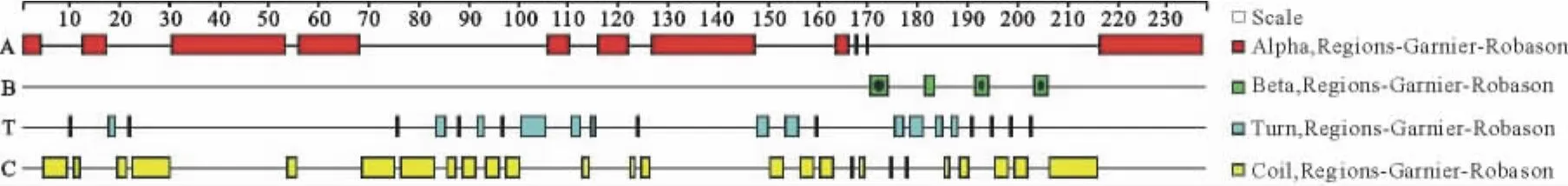
图8 重组蛋白Tasp-Spag1二级结构分析Fig.8 Secondary structure prediction of the recombinant protein Tasp-Spag1

图9 重组蛋白Tasp-Spag1抗原表位分析Fig.9 Analysis of the antigenic epitopes of the recombinant protein Tasp-Spag1
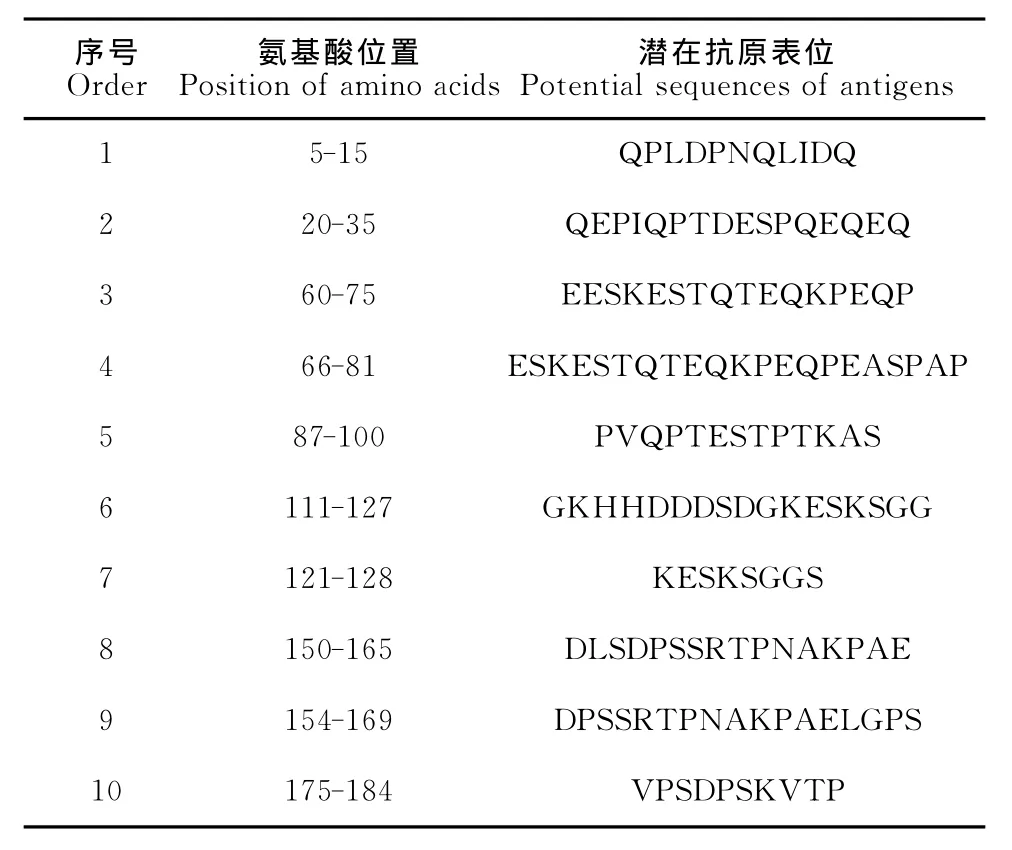
表1 重组蛋白Tasp-Spag1的B细胞抗原表位Table 1 The B cell antigenic epitopes of the recombinant protein Tasp-Spag1
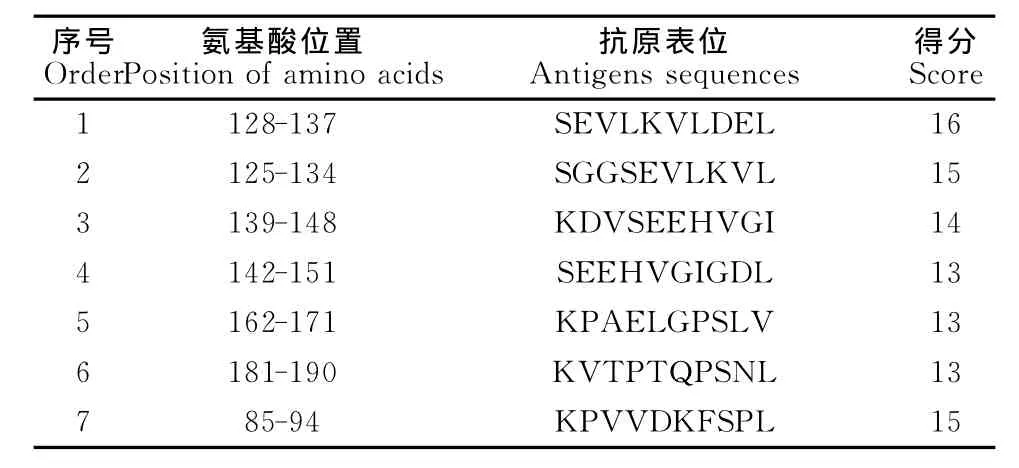
表2 重组蛋白Tasp-Spag1的T细胞抗原表位Table 2 The T cell antigenic epitopes of the recombinant protein Tasp-Spag1
3 讨论
Tasp是环形泰勒虫感染红细胞时表面分泌的一种膜内蛋白,其免疫原性很好。Tasp已被成功运用于环形泰勒虫病的诊断中[5-6],Mohamed A M等[7]对Tasp作为ELISA抗原检测环形泰勒虫病进行了评估,证实了此方法的可靠性。当虫体感染宿主时,产生的抗TasP的抗体同样具有良好的免疫原性,可以作为诊断环形泰勒虫病的理想抗原[8-10]。Spag1是虫体发育至子孢子阶段时分泌的一种膜内蛋白,具有较好的反应原性。虽然此两种表面抗原的免疫原性均已被验证并在实际诊断中应用,但以单一抗原为基础的诊断方法还存在着一些问题[11]。而对环形泰勒虫不同发育阶段的串联表面优势抗原蛋白的研究则为筛选理想的候选抗原提供了一条新的思路。环形泰勒虫的高免疫原性区片段串联表达,并以此为基础,建立以重组蛋白Tasp-Spag为包被抗原的间接ELISA检测方法[12-13],证实了串联抗原重组蛋白的可行性。而运用生物信息学方法预测存在的抗原表位,并对抗原表位进行分析及预测其免疫原性,是研究诊断试剂与表位疫苗的有效方法[14]。
本研究对Tasp-Spag1串联重组蛋白的基本特性、二级结构、亲水性、表面可能性、柔韧性等参数进行预测,并综合推测其可能存在的B细胞表位,同时预测了该蛋白可能的磷酸化与糖基化位点[15-18]。串联重组蛋白Tasp-Spag1含有236个氨基酸属于不稳定的非分泌型、非跨膜亲水性蛋白。分别含有33个与21个可能的糖基化与磷酸化位点,蛋白的磷酸化是病原生物感染、复制、转录等相关的信号传递中最基本的反应,即细胞外膜感应的信号通过相应分子的先后磷酸化从膜传递到细胞核,进而开启相关基因的转录并且以此指导翻译蛋白质执行细胞的功能[19]。而糖基化现象存在于超过50%的蛋白质中,与蛋白质降解,蛋白质翻译调控与细胞免疫等有着密切的关系,并且对蛋白质的生物学性质起着非常重要的作用。在28-83位、110-142位及195-228位氨基酸之间存在低复杂性的结构域,在81-120位之间存在Sorb的同源区域,96-121位之间含有NL的同源区域。此串联重组蛋白可能含有10个B细胞表位优势区段与7个T细胞表位优势区段,含有两段交叉反应性表位肽,分别可能存在的区域为162-171aa(KPAELGPSLV)、87-94aa(VVDKFSPL),此区域同时参与体液免疫与细胞免疫,所以在抗原表位的筛选中具有重要意义。本研究在BL21(DE3)中成功表达了重组蛋白,经Western blot检测表明其可被环形泰勒虫病阳性血清识别,为进一步进行环形泰勒虫亚单位疫苗的研究提供理论基础。
参考文献:
[1] 蒋金书.动物原虫病[M].北京:中国农业大学出版社,2000:120-125.
[2] 汪 明.兽医寄生虫学[M].3版.北京:中国农业大学出版社,2008:332.
[3] 农业部畜牧兽医局.Ⅰ、Ⅱ、Ⅲ类动物疫病释义[M].北京:中国农业出版社,2004:97-101.
[4] 蔺红玲,张继瑜,魏小娟,等.环形泰勒虫主要膜蛋白的研究进展[J].黑龙江畜牧兽医,2011(5):22-24.
[5] 黄家雨.新疆牛环形泰勒虫Tams1基因的克隆、表达与巢式PCR诊断方法的建立[D].新疆乌鲁木齐:新疆农业大学,2008.
[6] Ghoneim A M,EI-Fayomy A O.Targeting tams-1gene results in underestimation of Theileria annulata infection in diseased cattle in Egypt[J].Acta Parasitol,2014,59(1):85-90.
[7] Mohamed A M,Abdel-Rady A,Ahmed L S,et al.Evaluation of indirect TaSP enzyme-linked immunosorbent assay for diagnosis of tropical theileriosis in cattle(Bos indicus)and water buffaloes(Bubalus bubalis)in Egypt[J].Vet Parasitol,2012,186(3-4):486-489.
[8] Darghouth M A,Boulter N R,Gharbi M,et al.Vaccination of calves with an attenuated cell line of Theileria annulataand the sporozoite antigen SPAG-1produces a synergistic effect[J].Vet Parasitol,2006,142(1-2):54-62.
[9] Salih D E,Ahmed J S,Bakheit M A,et al.Validation of the indirect TaSP enzyme-linked immunosorbent assay for diagnosis of Theileria annulatainfection in cattle[J].Parasitol Res,2005,97(4):302-308.
[10] Bakheit M A,Schnittger L,Salih D A,et al.Application of the recombinant Theileria annulata surface protein in an indirect ELISA for the diagnosis of tropical theileriosis[J].Parasitol Res,2004,92(4):299-302.
[11] 曹雯丽,陈 亮,刘启生,等.新疆牛环形泰勒虫病的流行现状和防治[J].草食家畜,2011(3):76-78.
[12] 魏玉荣,易 忠,马文戈,等.泰勒焦虫表面抗原Tams1、Spag1 和Tasp基因的克隆与表达[J].新疆农业科学,2013,50(11):2136-2142.
[13] 魏玉荣,易 忠,马文戈,等.泰勒焦虫重组蛋白Tasp-Tams1-Spag1间接ELISA检测方法的建立[J].新疆农业大学学报,2013,36(5):360-365.
[14] 孙清鹏.生物信息学应用教程[M].北京:中国林业出版社,2012:6-148.
[15] Hopp T P.Protein surface analysis:Methods for identifying antigenic determinants and other interaction sites[J].J Immunol Meth,1986,88(1):1-18.
[16] 薛庆中,陈 辰,陈晓龙.DNA和蛋白质序列数据分析工具[M].3版.北京:科学出版社,2012:71-104.
[17] Petersen T N,Brunak S,von Heijne G,et al.SignalP4.0:discriminating signal peptides from transmembrane regions[J]. Nat Meth,2011,8(10):785-786.
[18] 吴祖建,高芳銮,沈建国.生物信息学分析实践[M].北京:科学出版社,2010:126-129.
[19] 王立荣.信号通路相关文献挖掘与分析方法研究[D].安徽合肥:中国科学技术大学,2007.
Expression and Bioinformatics Analysis of Tasp-Spag1 Genes of Theileria annulata
REN Fang1,3,YI Zhong1,MI Xiao-yun1,WEI Jie1,MA Wen-ge1,GUO Hui-ling1,MIAO Shu-kui1,WANG Li-qun2,WANG Yan1,XUE Ying1,HUANG Jiong1,WEI Yu-rong1
(1.Institute of Veterinary Medicine,Xinjiang of Animal Science Academy,Urumqi,Xinjiang,830000,China;2.Institute of Animal Health Supervision Station Inspection,Urumqi,Xinjiang,830063,China;3.College of Veterinary Medicine,Xinjiang
Agricultural University,Urumqi,Xinjiang,830052,China)
Abstract:To explore the characteristics of the Theileriaannulatasurface antigens,the surface antigen Tasp-Spag1genes were co-expressed in prokaryotic expression system.To bioinformatically analyze the surface antigen Tasp-Spag1genes.Tasp-Spag1genes were amplified by PCR method to construct recombinant plasmid of pET-28a-Tasp-Spag1.After the inducible expression by IPTG,SDS-PAGE,Western blot analyses were used.Bioinformatics software was used to analyze the Tasp-Spag1genes,the main characters and antigenic epitopes were predicted.Tasp-Spag1genes were about 729bp amplified by PCR,then,the result of SDS-PAGE,Western blot showed that the target protein was obtained with a molecular weight same as the expected size;Based on the bioinformatics analysis,the recombinant Tasp-spag1contains 236amino acids and belongs to unstable hydrophilic nonsecreted non-transmembrane protein.It contains 33glycosylation sites and 21phosphoric sites,3low complexity domain and Sorb,NL homologous regions.There may be 10 B-cell major epitope domains and 7 T-cell major epitope domains and two cross-reactive epitopes.The predicted results indicated that two different recombinant proteins have good immunogenicity in theory.
Key words:Theileria annulata;recombinant protein;prokaryotic expression;bioinformatics
通讯作者
作者简介:任 方(1989-),女,新疆人,硕士研究生,主要从事动物病毒病研究。*
基金项目:国家自然科学 (31160505)
收稿日期:2014-09-13
中图分类号:S852.723
文献标识码:A
文章编号:1007-5038(2015)05-0063-06

