罗非鱼维罗纳气单胞菌的分离鉴定
杨金平,沐建刚,刘 岳,和 锦,仁仕明,刘旭川,张以芳,毕保良*(.云南农业大学农科专业实验教学验中心,云南昆明6500;.云南省峨山县水产工作站,云南峨山6500;.云南农业大学动物科技学院,云南昆明6500)
罗非鱼维罗纳气单胞菌的分离鉴定
杨金平1,沐建刚2,刘岳1,和锦1,仁仕明1,刘旭川1,张以芳3,毕保良3*
(1.云南农业大学农科专业实验教学验中心,云南昆明650201;2.云南省峨山县水产工作站,云南峨山653200;
3.云南农业大学动物科技学院,云南昆明650201)
摘 要:为了解云南某渔场罗非鱼大量死亡的原因,通过病原分离纯化,表型鉴定及16SrRNA测序分析,从发病和濒死鱼中分离纯化了4株革兰阴性杆菌(Av1、Av2、Av3、Av4),其培养特性、菌体形态、生化特征与维罗纳气单胞菌相同;用PCR方法扩增4株纯化菌的16SrRNA基因,得到大小相同的片断,选取条带明亮的Av3进行16SrRNA测序分析,与GenBank中的维罗纳气单胞菌B565株核苷酸同源性为100%。用核苷酸同源性99%以上的序列构建系统进化树,Av3与运动性气单胞菌聚类。综合动物回归试验结果,确定维罗纳气单胞菌(Aeromonas veronii)是导致该渔场罗非鱼大量死亡的主要病原之一。
关键词:罗非鱼;维罗纳气单胞菌;分离;鉴定
2013年9月,云南省某水产养殖场罗非鱼大量死亡。病鱼发病期离群独游,体表鳞片脱落,鳍基发红,部分病鱼出现蛀鳍现象,眼球突出,肛门红肿,少数鱼无明显症状就死亡。剖检可见病鱼肠道严重充血,有黄色黏液,肠壁薄脆。肝、脾、肾严重溃烂。从不同的病鱼和濒死鱼体分离到4株溶血性细菌。现将分离鉴定结果报告如下。
1 材料与方法
1.1材料
1.1.1病料 病料采自云南省某地罗非鱼(体重0.5 kg~0.7kg)养殖场的患病鱼。健康罗非鱼购自元阳罗非鱼种苗场,经14d观察饲养正常后,用于感染试验。
1.1.2培养基及试剂 普通营养琼脂培养基,营养肉汤培养基,鲜血琼脂培养基,麦康凯琼脂培养基,MR试剂,VP试剂,吲哚试剂等均为云南农业大学农科基础实验室配制[1-2];细菌生化鉴定微量反应管为杭州天和微生物试剂有限公司产品;细菌基因组DNA提取试剂盒,DNA胶回收试剂盒(离心柱型)为北京百泰克生物技术有限公司产品;PCR反应体系(10×Taq buffer、dNTP Mixture(2.5mmol/L each)、Taq(2.5U/μL)、ddH2O)为北京庄盟国际生物有限公司产品;细菌16SrDNA基因通用引物F1:5′-AGAGTTTGATCCTGGCTGAG-3′和R1:5′-GGTTACCTTGTTACGACTT-3′为宝生物工程(大连)技术服务公司产品。
1.2方法
1.2.1病原菌的分离纯化 无菌采取发病和濒死罗非鱼的腹腔液及肝、脾、肾[3-9],划线分离于鲜血琼脂、普通营养琼脂、麦康凯琼脂各两份,30℃24h需氧及厌氧培养后观察菌落生长,革兰染色、鞭毛染色[10-11],观察菌体形态和染色特性。将可疑菌落转接于试管斜面纯培养。
1.2.2生理生化鉴定 根据菌体的培养特性、染色特性,用18h的纯培养物,参照伯杰氏细菌鉴定手册进行葡萄糖、乳糖、半乳糖,蔗糖、果糖、鼠李糖、麦芽糖、棉子糖、甘露糖、阿拉伯糖、木糖、七叶苷、甘露醇、硫化氢、尿素、明胶液化、赖氨酸、鸟氨酸、苯丙氨酸、硝酸盐还原、VP、MR、呼吸型、氧化酶和接触酶试验[12-13]。
1.2.3分子生物学鉴定 将分离获得的4个菌株分别接种于5 mL营养肉汤,30℃振荡培养过夜,取1.5mL液菌,12 000r/min离心2min,收集菌体。按照试剂盒操作说明提取细菌基因组DNA,以其模板进行16SrDNA基因PCR扩增。PCR反应体系为:10 ×Taq buffer 5μL,dNTP Mixture(2.5mmol/L each)4μL,Taq(2.5U/μL)1μL,ddH2O 33μL,上、下游引物各2μL(10mol/L),模板DNA 3μL。PCR反应条件:94℃5min;94℃30s,53℃40s,72℃45s,35
个循环;72℃延伸10min,4℃保存。将扩增条带明亮的PCR产物用DNA回收试剂盒回收,送华大生物科技有限公司测序。
测序结果通过NCBI的Blast进行序列同源性比较,选取参比菌株,使用MEGA6.0软件,运用Neighbour-Joining方法,采用Kimura 2-parameter校正模型,自举1 000次构建系统发育树并分析。
1.2.4动物回归试验 4个分离菌株分别接种至普通营养琼脂平板,30℃下24h培养,用无菌生理盐水将平板上的菌苔洗下,制成菌悬液,平板菌落计数法测定菌液浓度[8],无菌生理盐水将菌液稀释并调整为5.4×1012CFU/mL备用[13-14]。约75g的50尾罗非鱼随机分为5组,每组10尾,分别饲养于180L水鱼缸中,1组~4组接备用菌液各5mL,接种终浓度为1.5×107CFU/mL,第5组加培养基作为空白对照。接种后观察鱼的发病死亡情况,对死鱼及时剖检,并对致病菌再次分离鉴定。
2 结果
2.1病原菌的分离
各检样在3种培养基中需氧及厌氧培养,均有菌落形成,且形态单一。鲜血琼脂平板上呈β溶血的圆形、光滑、湿润、淡黄色落菌(图1)。普通营养琼脂平板上呈圆形、光滑、湿润的白色小菌落。麦康凯琼脂平板上圆形、光滑、湿润的淡黄色小菌落。分离纯化的4株细菌经革兰染色,镜检可见两端钝圆、小杆状、无荚膜、无芽胞(图2)、多呈单个排列。鞭毛染色,为极生鞭毛,有运动力(图3)。

图1 Av3β溶血菌落特征Fig.1 The characteristics of Av3β-hemolytic colonies
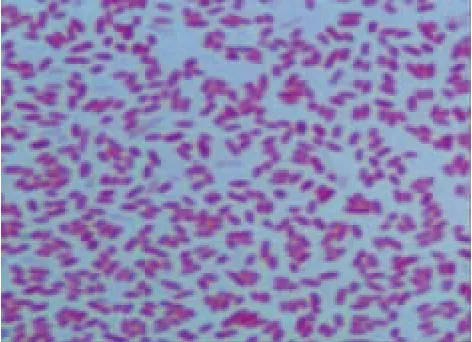
图2 Av3革兰染色镜检(1 000×)Fig.2 Gram stain of strain Av3(1 000×)
2.2分离菌株的生化鉴定
各菌株的氧化酶、接触酶、MR、VP试验均为阳性,分解葡萄糖、蔗糖、麦芽糖、果糖、七叶苷、甘露醇、淀粉,尿素、液化明胶,还原硝酸盐,不发酵山梨糖、木糖、阿拉伯糖、棉籽糖、鼠李糖、乳糖、山梨醇、不产生硫化氢,分离到的菌株Av1、Av2、Av3、Av4均符合维罗纳气单胞菌的特性[14-19](表1)。

图3 Av3鞭毛染色(改良Leifson染色法,1 000×)Fig.3 Av3flagella stain(Leifson stain,1 000×)
2.3分离菌株的16SrRNA鉴定
以Av1、Av2、Av3、Av4的DNA为模板,通过16S rRNA通用引物扩增,PCR扩增产物长度在1 000bp ~2 000bp之间,条带单一、大小相同(图4)。选择条带浓度最高的Av3扩增产物进行胶回收,经测序得到长度为1 442bp。将其基因序列在Blast T进行同源性比较,依据MGGA6.0软件同源性检索结果,选取同源性99%以上的检索序列做为参比菌株,构建系统发育树。结果显示Av3菌株与维罗纳气单胞B565亲缘关系最近,自然聚为一支。与不同菌种的Aeromonas bestiarum(CIP74.30)、Aeromonas salmonicida subsp.achromogenes(6263/4/5)、Haemophilus piscium(CIP 106116)、Aeromonas salmonicida subsp.masoucida(JCM 7873)分支进化距离较远(图5)。从分子水平上进一步证实分离细菌为维罗纳气单胞菌。
2.4动物回归试验
4个菌株(5.4×1012CFU/mL)均能在12h内引起发病,且72h致死率达100%,对照组罗非鱼未见异常,表明Av1、Av2、Av3、Av4对罗非鱼具有致死性。对接种菌液的鱼进行观察,发病症状及死后剖解症状均与自然病例相同,且从肝、脾、肾及腹腔液重新分到相同的病原菌(表2)。

图4 细菌株Av1~Av4 16SrRNA基因扩增结果Fig.4 PCR amplification of Av1-Av4 16SrRNA gene
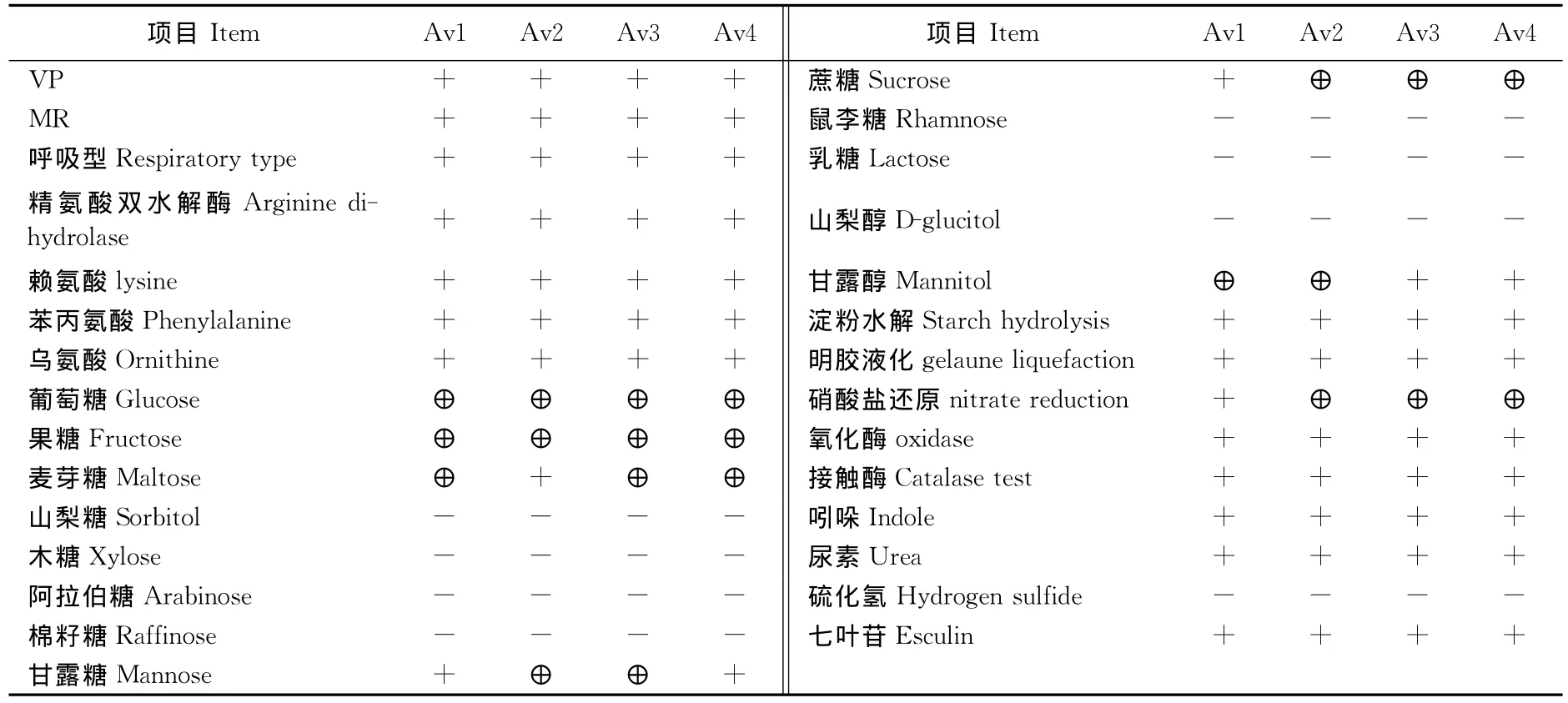
表1 4个分离菌株的生化特性鉴定Table 1 Biochemical identification of 4bacterial isolates

图5 Av3菌株的系统发育树分析Fig.5 Phylogenetic tree analysis of Av3strain

表2 分离菌对罗非鱼的人工回归感染试验结果Table 2 Results of pathogenicity test of isolates in tilapia
3 讨论
根据形态学、理化特性、16SrRNA测序分析和人工回归感染试验,确定导致渔场罗非鱼大量死亡的病原菌为维罗纳气单胞菌,提示该菌在水产动物中的病原学意义。系统进化树显示,发育树由两个分支构成,上支由非运动性气单胞菌组成;下支由运动性气单胞菌,是水生动物尤其是鱼类最常见的致病菌,在水温高的夏季可造成暴发性流行,给水产养殖带来巨大的经济损失。目前在国外已将这个分支中的嗜水气单胞菌纳入腹泻病原菌的常规检测范围,是食品卫生检验对象。
由于水产生存环境是一个复杂的生态系统,水产病害也是综合因素所导致,在该病例暴发的时候。8月份高温干旱、昼夜温差大,使鱼体抗病力下降,9月
份降雨增加,雨水导致泥沙冲刷或底泥翻起,导致的病原菌在水体鱼群分布层增加,水体含较丰富的盐离子和溶解态有机质,有利于病原微生物的生长和疾病的发生。人工感染回归试验模拟了水生动物所处的自然环境变化。采取直接倒入致病菌菌液的方法,与浸泡感染、划破皮肤浸泡感染、背鳍部注射感染、菌液接种肌肉感染和腹腔注射感染相比较,减少了对水生动物的应激损伤及试验工作时间。
参考文献:
[1] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学技术出版社,2001:147-155.
[2] 赵斌,何绍江.微生物学实验.[M].科学出版社,2002:232-239.
[3] 王鹰勇,王 茜.腹水中分离出维罗纳气单胞菌温和生物变种1例[J].中华医院感染学杂志,2005,15(6):715-717.
[4] 李 靖,王桂青.病原维氏气单胞菌的分离鉴定研究[J].水产学杂志,2011,24(4):33-36.
[5] 杨泽晓,周 亚,王 印,等.白缘(鱼央)维氏气单胞菌的分离鉴定及药敏试验[J].中国畜牧兽医,2012,39(2):92-95.
[6] 林启存,蔡丽娟,杨仲景,等.丁溃疡病的病原分离、鉴定与人工感染试验[J].水产科学,2005,24(11):21-24.
[7] 李本旺,徐逸文.中华鳖口腔溃烂综合症病原的研究[J].水产科技情报,2000,27(5):210-214.
[8] 房 海,陈翠珍,张小君,等.中华绒螯蟹病原维氏气单胞菌检验[J].中国人畜共患病学报,2008,24(1):45-49.
[9] 黎 炯,叶 星,卢迈新,等.罗非鱼维氏气单胞菌的分离鉴定和药敏试验[J].水生态学杂志,2011,32(3):132-136.
[10] 万滋衡,梁 莹.Leifson细菌鞭毛染色法的改良[J].中国卫生检验杂志,2010,20(4):792-794.
[11] 谷海瀛.细菌鞭毛染色方法及应用[J].中华检验医学杂志,2004,27(9):611-615.
[12] Sharon L A,Wendy K W.The genus Aeromonas:biochemical characteristics,atypical reactions,and phenotypic identification schemes[J].J Clin Microbiol,2003,41(6):2348-2357.
[13] Holt J G,Krieg N R,Sneath P H A,et al.Berjys mnual of dterminative bacteriology[M].9th.Baltimore:Williams & Wilkins,1994:190-191,253.
[14] 宋振辉,乔 霞,张鹦俊,等.维氏气单胞菌的分离与鉴定及系统进化分析[J].中国兽医杂志,2011,47(1):23-25.
[15] 马志宏,杨 慧,李铁梁,等.西伯利亚鲟(Acipenser baerii)致病性维氏气单胞菌的分离与鉴定[J].微生物学报,2009,49(10):1289-1294.
[16] 龚 倩,单晓枫,王伟利,等.框镜鱼致病性维氏气单胞菌的分离与鉴定[J].中国预防兽医学报,2010,32(12):981-983.
[17] 王 旭,雷 燕.中国大鲵腐皮病病原菌的分离与鉴定[J].中国人畜共患病学报,2010,26(10):944-948.
[18] Kieg N R,Hoit J G.Bergeys manual of systematic bacteriology [D].Blatmore:Williams Wilkins Co,1984:545-548.
[19] 夏 飞,梁利国,谢 骏.异育银鲫病原离鉴定及药敏试验[J].淡水渔业,2012,42(5):22-26.
Isolation and Identification of Aeromonas veronii in Tilapia
YANG Jin-ping1,MU Jian-gang2,LIU Yue1,HE Jin1,REN Shi-ming1,LIU Xu-chuan1,ZHANG Yi-fang3,BI Bao-liang3
(1.Experimental Teaching Center for Agricultural Course,Yunnan Agricultural University,Kunming,Yunnan,650201,China;2.Eshang County Fishery Station,Eshan,Yunnan,653200,China;3.College of Animai Science and Technology,Yunnan Agricultural University,Kunming,Yunnan,650201,China)
Abstract:To confirm the cause of massive death happened in a tilapia farm in Yunnan province,samples were collected from diseased tilapia,and the bacterial isolation,purification,phenotypic identification and 16SrRNA sequencing analysis were conducted.Study results showed that 4strains of Gram negative bacilli(Av1,Av2,Av3,Av4)were isolated,which similar to Aeromonas veronii in cultural traits,mycelial morphology and biochemical characters.In addition,16SrRNA genes of the 4purified strains were amplified by PCR method and amplified fragments were sequenced,the nucleotide homology analysis results found that Av3and Aeromonas veronii strain B565share identical 16SrRNA genes.Phylogenetic tree were constructed by selected strains,and sequences share 99%or more nucleotide homology from GenBank,and Av3was clustered with Aeromonas.Combination with results of experimental infection of tilapia with four isolated bacilli,the cause of outbreak was identified as Aeromonas veronii infection.
Key words:tilapia;Aeromonas veronii;isolation;identification
通讯作者
作者简介:杨金平(1991-),男(白族),云南兰坪人,本科,主要从事动物检疫研究。*
基金项目:云南省教育厅科学研究基金重点项目(2012Z023)
收稿日期:2014-07-15
中图分类号:S852.61
文献标识码:A
文章编号:1007-5038(2015)05-0040-04

