一种弓形虫单管套式PCR 检测方法的建立及其在奶山羊应用
阚松鹤,刘 侠,林 青*(.西北农林科技大学动物医学院,陕西杨凌7200;2.青海大学畜牧兽医科学院,青海西宁8006)
一种弓形虫单管套式PCR 检测方法的建立及其在奶山羊应用
阚松鹤1,2,刘侠1,林青1*
(1.西北农林科技大学动物医学院,陕西杨凌712100;2.青海大学畜牧兽医科学院,青海西宁810016)
摘 要:根据GenBank上发表的弓形虫RH虫株529bp重复序列,设计内、外2对特异性引物,建立一种弓形虫单管套式PCR检测方法,并进行特异性试验、敏感性试验及奶山羊临床样品的检测试验。结果表明,该方法能够扩增出基因片段大小为216bp,与GenBank收录的相关序列同源,而与山羊泰勒虫、微小隐孢子虫、蓝氏贾第虫基因组无交叉反应,该方法能够检测出DNA的最小量为1fg。使用该方法对137份奶山羊血液样品进行了检测,发现有38份为阳性。本研究所建立的方法具有特异性强、敏感性高的特点,可用于奶山羊弓形虫病的诊断,有较高的临床应用价值。
关键词:529bp重复序列;弓形虫;单管套式PCR;弓形虫病;奶山羊
弓形虫是一种有核细胞内寄生的原虫,可寄生于绝大多数恒温动物体内[1]。在众多易感家畜中,猪、绵羊、山羊是人类感染弓形虫的主要途径[2]。山羊妊娠期间首次感染弓形虫可导致流产、产死胎等临床症状,且目前尚无特效治疗药物,给养羊业带来巨大的经济损失[3-9],快速、准确的检测弓形虫感染就显得极为重要。传统的弓形虫检测方法,即病原学检测方法耗时长,敏感性低;而血清学检测结果易出现假阴性或由其他原虫交叉免疫而出现假阳性;分子生物学诊断中,常规PCR敏感性较低,而套式PCR敏感性、特异性都较高,但与常规PCR方法相比,操作较为繁琐且更易污染。为了避免污染、简化试验步骤,本研究拟以弓形虫基因组中529bp重复序列为对象,建立一种单管套式PCR检测方法。
1 材料与方法
1.1材料
1.1.1虫株与奶山羊血液样品 刚地弓形虫RH虫株DNA由中国农业科学院兰州兽医研究所张德林研究员馈赠。奶山羊血液样品共137份,采自陕西省关中地区某羊场的奶山羊,采血时加入抗凝剂(肝素)。山羊泰勒虫、微小隐孢子虫、蓝氏贾第虫等DNA均由西北农林科技大学动物医学院寄生虫实验室保存。
1.1.2主要试剂 10×PCR buffer、MgSO4、dNTPs、KOD-Plus-Neo为东洋纺生物科技有限公司产品,6× Loading buffer、DNA Marker DL 2 000为宝生物工程(大连)技术服务公司产品,血液/细胞/组织基因组DNA提取试剂盒购自天根生化科技有限公司。
1.1.3引物设计 根据弓形虫RH虫株529bp重复序列基因(GenBank accession number DQ779191)设计合成两对引物(表1),引物由英潍捷基贸易有限公司进行合成。
1.2方法
1.2.1奶山羊血液预处理及弓形虫DNA的提取
将采集到的奶山羊抗凝血在3 000r/min离心5min,弃上层血清,于血清与红细胞交界处吸取200μL血液,加入1.5mL离心管中备用。之后按照DNA提取试剂盒说明书进行弓形虫DNA的提取。
1.2.2单管套式PCR反应条件 反应条件为94℃2 min;94℃15s,68℃60s,15个循环;94℃15s,59℃30s,68℃30s,35个循环;68℃7min。反应体系为:10×PCR buffer 2.5μL,dNTPs(2mmol/L)2.5μL,MgSO4(25mmol/L)1.5μL,KOD-Plus-Neo(1U/μL)0.5μL,External primers(250nmol/L)1μL,Internal primers(10μmol/L)1μL,DNA模板1μL,ddH2O 13 μL,总体积为25μL。
1.2.3特异性试验 分别以山羊泰勒虫、微小隐孢子虫、蓝氏贾第虫和弓形虫RH虫株DNA为模板,应用所建立的PCR检测方法进行PCR扩增。
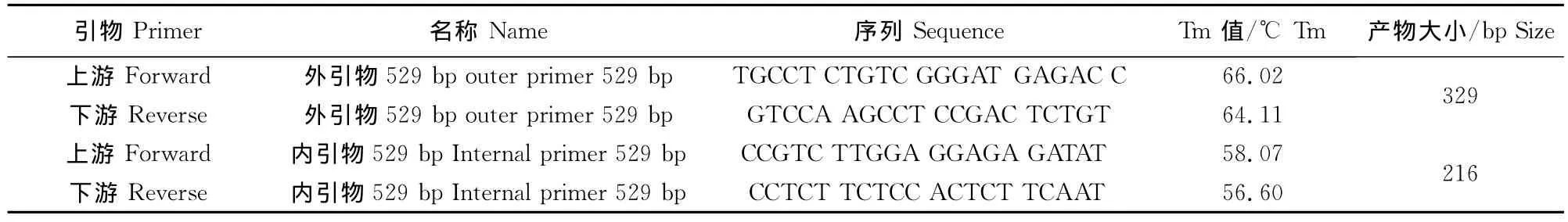
表1 单管套式PCR引物设计Table 1 Primer design of single tube nested PCR
1.2.4敏感性试验 用分光光度计测定弓形虫RH虫株阳性样品DNA含量,连续10倍倍比稀释,应用所建立的PCR检测方法进行PCR扩增。
1.2.5单管套式PCR检测方法的临床应用 应用所建立的检测方法对来自关中地区某羊场的137份奶山羊血液样品进行弓形虫检测。
2 结果
2.1PCR扩增结果
应用所建立的检测方法在弓形虫RH虫株DNA样品、待检血液DNA阳性样品中均扩增出216bp左右的片断,阴性对照无条带,与预期结果一致(图1)。
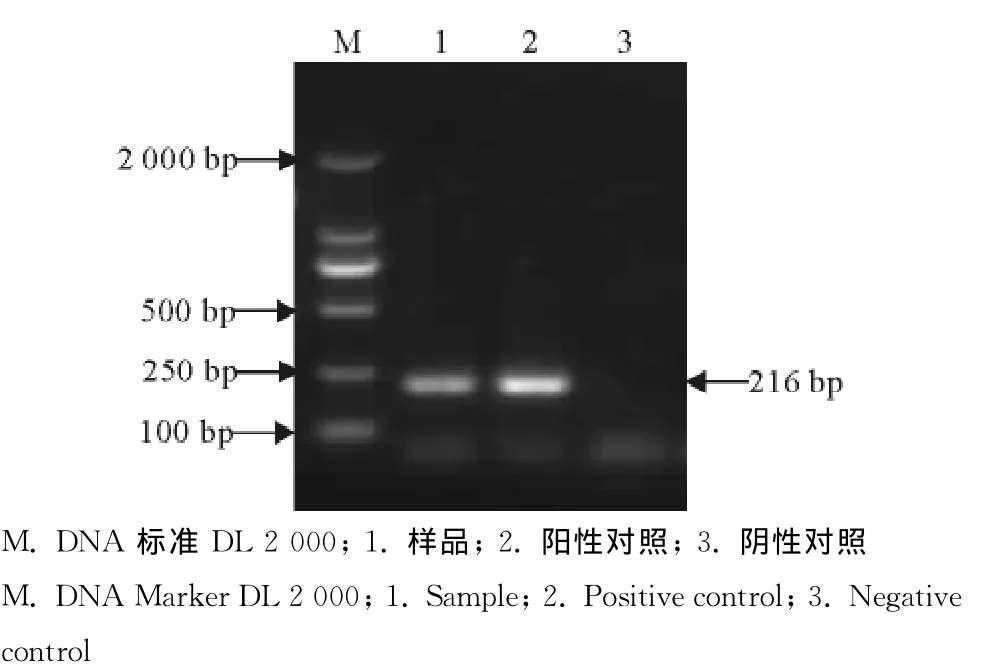
图1 弓形虫单管套式PCR扩增结果Fig.1 Single tube nested PCR for detection of T.gondii PCR
2.2特异性试验结果
应用建立的检测方法在弓形虫RH虫株DNA(阳性对照)中能扩增出216bp的条带且无杂带,而在山羊泰勒虫、微小隐孢子虫、蓝氏贾第虫DNA和阴性对照中均不能扩增出该片段(图2)。
2.3敏感性试验结果
分光光度计测得弓形虫RH虫株DNA样品浓度为102.1ng/μL,连续10倍倍比稀释,对不同稀释度进行单管套式PCR检测,结果最低可检测到1fg的弓形虫DNA(图3)。
2.4临床样品检测
应用单管套式PCR检测奶山羊血液DNA样品137份,结果检出38份为阳性,测序结果经Blast鉴定均为弓形虫。
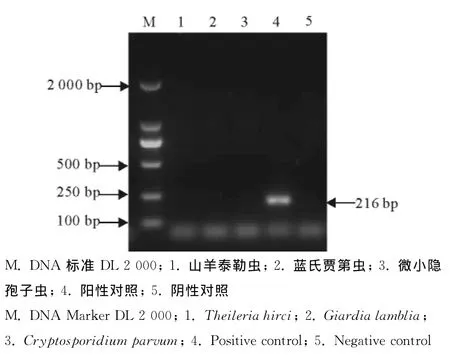
图2 单管套式PCR特异性试验Fig.2 The specificity test of single tube nested PCR
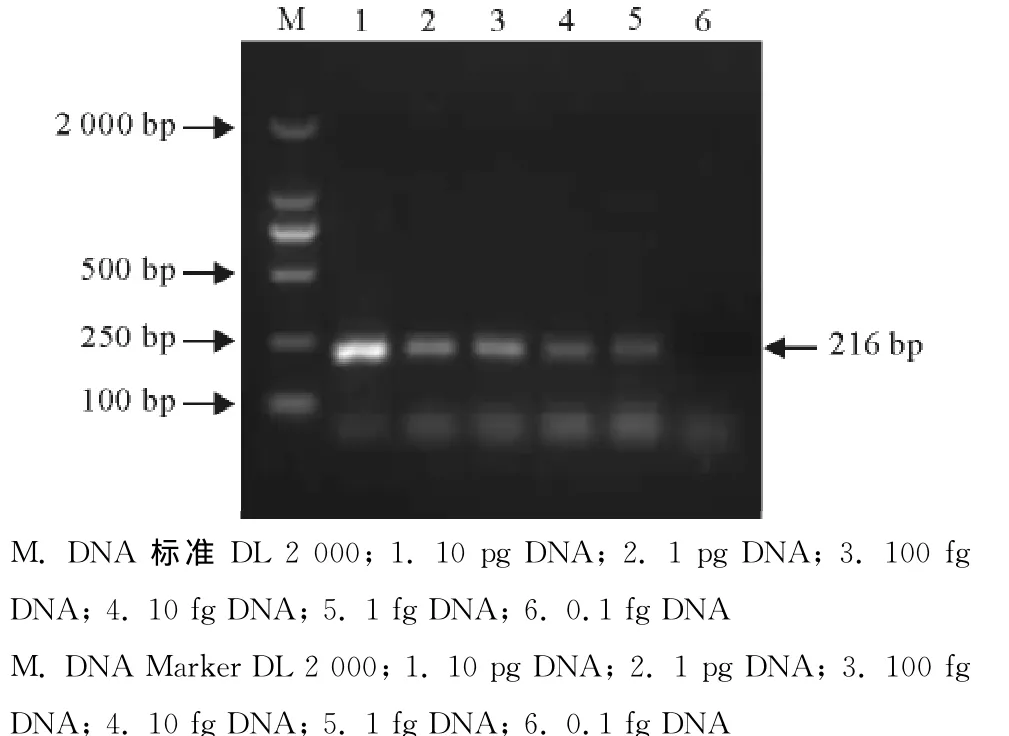
图3 单管套式PCR敏感性试验Fig.3 Sensitivity test of single tube nested PCR
3 讨论
多数人类和动物在感染弓形虫之后缺乏临床症状,很难通过临床来确定是否为弓形虫感染,加之DNA抽提时的降解以及纯度不够而导致PCR检测结果出现假阳性或假阴性。基于以上因素,考虑到单管套式PCR比常规PCR的优越性[10-11],本试验拟根据弓形虫RH虫株529bp重复序列,建立一种弓形虫单管套式PCR检测方法。通常PCR检测弓形虫所使用的靶基因有35拷贝的B1基因、110拷贝的ITS1和300拷贝的529bp重复序列,其中529bp重复序列有更高的敏感性,因此,更加适合用于临床样
品的检测[12-16]。
本试验采用2次PCR的4个引物置于同一PCR管中进行扩增的方法。而常规的套式PCR采用了将第1次PCR的产物再取出加入到第2次PCR的反应体系中,该法操作烦琐、费时且增加了污染的可能性。但一次性加入引物的单管套式PCR方法对内外引物的Tm值有特殊要求,即外引物的退火温度高,内引物退火温度低,二者相差至少5℃。其目的是反应开始的若干轮循环中外引物可以在较高的温度结合到模板DNA上,而内引物由于Tm值较低,无法结合到模板DNA上,从而只扩增外引物的目的基因片断。外引物耗尽后,再采用较低的退火温度,主要是为了增加内引物的扩增效率。为避免外引物干扰后面的循环,可尽量减少外引物的量,从而确保外引物可以被耗尽。该方法具有高度的特异性和敏感性,能够客观地反映弓形虫的感染情况,具有较好的临床应用价值,为更好地进行弓形虫病的流行病学调查提供了有效的技术手段。
参考文献:
[1] Dubey J P,Beattie C P.Toxoplasmosis of Animals and Man[M]. Boca Raton:CRC Press,1988:220.
[2] Tenter A M,Heckeroth A R,Weiss L M.Toxoplasma gondii:from animals to humans[J].Int J Parasitol,2000,30(12):1217-1258.
[3] Munday B L,Mason R W.Toxoplasmosis as a cause of perinatal death in goats[J].Aust Vet J,1979,55(10):485-487.
[4] Tzanidakisa N,Maksimovb P,Conrathsb F J,et al.Toxoplasma gondii in sheep and goats:Seroprevalence and potential risk factors under dairy husbandry practices[J].Vet Parasitol,2012,190(3-4):340-348.
[5] Czopowicza M,Kabaa J,Szalus-Jordanowb O,et al.Seroprevalence of Toxoplasma gondii and Neospora caninuminfections in goats in Poland[J].Vet Parasitol,2011,178(3-4):339-341.
[6] Nurse G H,Lenghaus C.An outbreak of Toxoplasma gondii abortion mummification and perinatal death in goats[J].Aust Vet J,1986,63(1):27-29.
[7] Kamani J,Mani A U,Egwu G O.Seroprevalence of Toxoplasma gondiiinfection in domestic sheep and goats in Borno state,Nigeria [J].Trop Anim Health Pro,2010,42(4):793-797.
[8] Swai,E S,Kaaya J E.A survey of Toxoplasma gondii antibodies by latex agglutination assay in dairy goats in Northern Tanzania [J].Trop Anim Health Pro,2012,45(1):211-217.
[9] 郑 斌,尹志奎,韩丁丁,等.国外羊弓形虫感染情况及影响因素研究进展[J].中国病原生物学杂志,2013,8(6):571-573.
[10] Horiuchi K,Yabe I,Tajima Y,et al.Case of Toxoplasma encephalopathy with specific MRI findings,diagnosed by IgG avidity index and nested PCR[J].Rinsho Shinkeigaku,2010,50(4):252-256.
[11] 张莹光,曹利利,徐丹,等.基于弓形虫529-bp重复序列巢式PCR诊断方法的建立[J].中国兽医学报,2013,33(2):227-228,235.
[12] Switaj K,Master A,Skrzypczak M,et al.Recent trends in molecular diagnostics for Toxoplasma gondii infections[J].Clin Microbiol Infect,2005,11(3):170-176.
[13] Homan W L,Vercammen M,De Braekeleer J,et al.Identification of a 200-to 300-fold repetitive 529bp DNA fragment in Toxoplasma gondii and its use for diagnostic and quantitative PCR [J].Int J Parasitol,2000,30(1):69-75.
[14] Calderaro A,Piccolo G,Gorrini C,et al.Comparison between two real-time PCR assays and a nested-PCR for the detection of Toxoplasma gondii[J].Acta Bio Medica,2006,77(2):75-80.
[15] Hurtado A,Aduriz G,Moreno B,et al.Single tube nested PCR for the detection of Toxoplasma gondii in fetal tissues from naturally aborted ewes[J].Vet Parasitol,2001,102(1):17-27.
[16] 袁恒青,徐前明,李培英.弓形虫529bp基因的克隆及序列分析[J].畜牧与兽医,2012,44(11):60-63.
Establishment and Application of Single-tube Nested PCR for Detection of Toxoplasma gondii in Dairy Goats
KAN Song-he1,2,LIU Xia1,LIN Qing1
(1.College of Veterinary Medicine,Northwest A&F University,Yangling,Shaanxi,712100,China;2.National Key Lab Cultivating Base of Plateau Grazing Animal Nutrition and Ecology,Qinghai Academy of Animal Science and Veterinary Medicine,Qinghai University,Xining,Qinghai,810016,China)
Abstract:According to 529bp repetitive sequence of Toxoplasma gondii RH strain published in GenBank,2pairs of specific primers,including external and internal primers were designed,and a single tube nested PCR method for detection of Toxoplasma gondii was established,then specificity test,sensitivity test and test for clinical samples of dairy goats were conducted.The results suggested that this method can amplify 216bp gene fragment being homologous to the related sequences in GenBank.No cross-reactions were found in genome of Theileria hirci,Cryptosporidiumor Giardia lamblia,and the method can detect 1fg DNA as a minimum.38were positive in 137clinical samples of dairy goats by this method.In short,this method was highly specific,sensitive and valuable in clinical application for detection of Toxoplasma gondii in dairy goats.
Key words:529bp repetitive sequence;Toxoplasma gondii;single-tube nested PCR;Toxoplasmosis;dairy goat
通讯作者
作者简介:阚松鹤(1989-),女,黑龙江拜泉人,硕士研究生,主要从事动物疫病防治研究。*
基金项目:陕西省农业攻关项目(2013K01-60-02);省部共建国家重点实验室培育基地基金资助。
收稿日期:2014-10-17
中图分类号:S852.7
文献标识码:A
文章编号:1007-5038(2015)05-0033-03

