鸡毒支原体胶体金免疫层析试纸条的研制和初步应用
宁官保,刘国莉,张 鼎,李宏全,马海利,高荣琨,郝卫芳,高文伟,赵宇军,高诗敏,李建慧,李桂兰,闫 芳,田文霞*(.山西农业大学动物科技学院,山西太谷0080;.介休市劳动和社会保障局,山西介休0000;.华中农业大学动物医学院,湖北武汉0070;.太原市动物疫病预防控制中心,山西太原000)
鸡毒支原体胶体金免疫层析试纸条的研制和初步应用
宁官保1,刘国莉2,张鼎3,李宏全1,马海利1,高荣琨1,郝卫芳4,高文伟1,赵宇军1,高诗敏1,李建慧1,李桂兰1,闫芳1,田文霞1*
(1.山西农业大学动物科技学院,山西太谷030801;2.介休市劳动和社会保障局,山西介休032000;3.华中农业大学动物医学院,湖北武汉430070;4.太原市动物疫病预防控制中心,山西太原030024)
摘 要:为研制一种用于快速检测鸡毒支原体(MG)的胶体金免疫层析试纸条,采用直径20nm的胶体金颗粒标记纯化的MG多克隆抗体,硝酸纤维素膜检测线和质检线分别喷加纯化的MG多克隆抗体和兔抗鸡IgG抗体,制作胶体金试纸条。试纸条检测MG阳性显示两条红色反应条带;阴性为一条红色反应带。本试纸条可检测到1∶1 280倍稀释的MG抗原,即颜色变化单位为8×104CCU/mL,具有高度的灵敏性。用试纸条检测衣原体、滑液支原体、猪肺炎支原体、鸡大肠埃希菌和鸡白痢沙门菌等均呈阴性,表明该试纸条具有较好的特异性。对试纸条检测呈MG阳性的38只病鸡进行MG培养验证,所得结果一致;同时对MG培养检测的另外95份病鸡样品进行试纸条测试比对,符合率为96.84%,证明该试纸条具有很高的准确性。该胶体金免疫层析试纸条检测MG操作简单,灵敏度、准确度、特异性等均符合要求,可以用于养殖场批量MG的检测。
关键词:鸡毒支原体;胶体金;免疫层析;试纸条
鸡毒支原体病是由鸡毒支原体(Mycoplsma gallisepticum,MG)引起的传染病,其临床特征包括呼吸啰音、咳嗽、流鼻液等,主要病变是气囊浑浊,鼻道、气管及支气管内有干酪样渗出物[1-2]。本病可以通过垂直和水平方式传播,这也是造成鸡毒支原体感染率高,分布面积广,难以根除的重要原因[3]。本病在世界养禽国家均流行,且常继发或并发新城疫、传染性支气管炎、大肠杆菌病等传染病。在老疫区,本病常呈隐性感染,发病慢、病程长,无法根除。目前对鸡毒支原体病的血清学诊断方法主要包括血清平板凝集试验(SPA)、血凝抑制试验(HI)、酶联免疫吸附试验(ELISA)和斑点酶联免疫吸附试验(Dot-ELISA)等。这些方法虽然能有效地诊断鸡毒支原体病,但均在不同程度上存在成本高、专业性强、主观依赖性、操作繁琐等缺点,难以在生产一线实现大规模简易检测。胶体金免疫层析(GICA)是20世纪80年代发展起来的一种新型免疫学检测方法,能通过检测血清抗原、抗体存在,准确诊断各种疾病的发生[4-5]。目前市场上已有多种用于鸡病诊断的胶体金免疫层析试纸产品,但尚没有针对鸡毒支原体病诊断的试纸。本研究旨在制备可快速、准确、简便检测MG的胶体金免疫层析试纸条,为鸡毒支原体病诊断提供工具。
1 材料与方法
1.1材料
1.1.1毒株 鸡毒支原体弱毒活疫苗购自青岛易邦生物工程有限公司;鸡毒支原体冻干菌株为天津农学院动物科学与动物医学学院杨百亮教授惠赠。
1.1.2主要试剂、材料 氯金酸、柠檬酸三钠购自国药集团化学试剂有限公司;硝酸纤维素膜、玻璃纤维滤纸购自上海派坤生物制品有限公司;鸡支原体平板凝集抗原购自中国兽医药品监察所;MG多克隆抗体、兔抗鸡IgG抗体系山西农业大学生物制品实验室自制。
1.2方法
1.2.1MG的分离及CCU的测定 参照文献[6]进行MG的分离和鉴定,并对培养的MG进行颜色变化单位(CCU)测定。具体为向96孔细胞培养板各孔中分别加入肉汤培养基180μL,于前7排每排的第1孔分别加入MG液体培养物20μL,然后按10倍倍比稀释至第12孔后弃去多余的20μL液体,第8排孔不加
MG液体培养物作空白对照。加盖后用医用橡皮胶带封住周围的缝隙以防止漏气,37℃培养,每日观察结果,当变色孔不再增加后确定终点。以导致颜色改变的待测分离物的最高稀释度作为1CCU/mL。
1.2.2鸡MG多克隆抗体的制备、纯化 点眼法对鸡免疫鸡毒支原体弱毒疫苗,分别于第7天和14天收集血清。标准MG阳性血清做对照,平板凝集试验检测血清MG抗体效价。达到要求后,盐析法对血清蛋白进行粗提纯,后采用饱和硫酸铵-DEAE-纤维素层析法进一步纯化MG多抗。紫外吸收法测定MG多克隆抗体浓度[7-8]。
1.2.3兔抗鸡IgG抗体的制备、纯化 心脏采集健康鸡血液,分离、收集血清。盐析法粗提鸡IgG免疫球蛋白,离子交换层析法纯化血清IgG。将纯化好的鸡IgG与弗氏完全佐剂和弗氏不完全佐剂乳化制成疫苗,对家兔进行肌肉、皮下多点注射初次免疫。1个月后用弗氏不完全佐剂乳化苗再加强免疫1次,后收集血清,利用双向琼脂扩散试验检测其效价。兔抗鸡IgG抗体纯化及其浓度测定同1.2.2。
1.2.4胶体金溶液的制备 采用柠檬酸钠还原法制备直径约为20nm的胶体金[9-10],4℃保存备用。
1.2.5胶体金标记MG抗体最低标记量、最适pH值确定 将MG抗体按照100μg/mL~500μg/mL做逐级浓度稀释后,各取0.1mL分别与1mL胶体金溶液混合,静置5min后,再分别加入0.1mL 100g/L 的NaCl溶液,混匀静置,观察溶液颜色变化以确定MG抗体最低标记量。用HCl或K2CO3调节储存胶体金溶液pH为5.5~8.5,各取1mL后加入最适MG抗体浓度,混匀后加入0.1mL 100g/L的NaCl,再次混匀后静置,观察溶液颜色变化,以确定胶体金标记所需最适pH[11]。
1.2.6MG抗体的胶体金标记 在胶体金标记MG抗体的最低标记量的基础上再加上20%为稳定胶体金所需MG抗体的实际用量[12]。在电磁搅拌下,将抗体溶液加入胶体金溶液中,静置15min后,加入终浓度为10mL/L的BSA,4℃过夜。采用低温超速离心法纯化胶体金标记MG抗体,最后将沉淀溶于原体积1/10的TBS中。4℃保存备用。
1.2.7硝酸纤维素膜包被鸡MG抗体、兔抗鸡IgG抗体稀释度的选择 用0.05 mol/L的PBS溶液(pH7.0)将鸡MG抗体从100μg/mL~500μg/mL做浓度梯度稀释,包被于硝酸纤维素膜上,同时将MG做不同比例稀释与包被的MG抗体结合,作方阵试验,确定检测线的鸡MG抗体的最适稀释度。用确定的最适稀释度的MG抗体喷于硝酸纤维素膜上作为检测线,把兔抗鸡IgG抗体从100μg/mL~600μg/mL做浓度梯度稀释,并与检测线的MG抗体结合,做方阵试验,确定兔抗鸡IgG的最适稀释度。
1.2.8胶体金免疫层析试纸条的制备 试纸条组装步骤参照文献[13-14]。试纸条结构见图1。
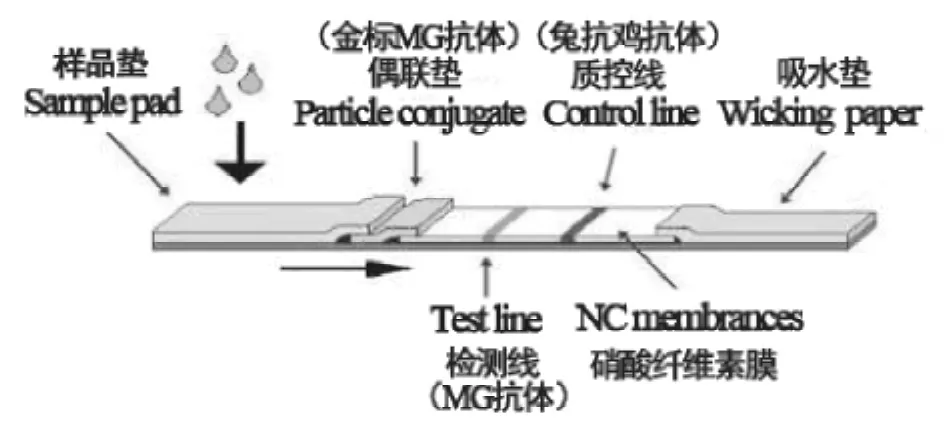
图1 胶体金试纸条组装示意图Fig.1 Assembly diagram of the colloidal gold strip
1.2.9试纸条的使用方法和结果判断 将胶体金免疫层析试纸条从4℃环境中取出,恢复到室温。用标准MG做阳性对照,PBS溶液做阴性对照。分别将试纸条样品垫端浸入含有MG和PBS溶液检样的容器中,取出平放,静置10min观察结果。阴性结果试纸条检测线不显色,仅质控线显色,出现1条红线;阳性结果试纸条检测线和质控线均显色,出现2条红线。
1.2.10试纸条性能检测 用试纸条分别对蒸馏水、0.05mol/L PBS、TBS、衣原体、滑液支原体、猪肺炎支原体、鸡大肠埃希菌和鸡白痢沙门菌进行检测,以测试试纸条的特异性。用生理盐水稀释MG,从10倍开始做倍比稀释至2 560倍,用试纸条分别进行检测,观察检测线和质控线有无及清晰程度,以测试试纸条敏感性。随机抽取不同批次和批间的试纸条进行重复试验,以测试试纸条重复性。
1.2.11MG胶体金试纸条的初步应用 分别对太谷某鸡场的38只疑似MG病鸡、山西农业大学动物医院收集的95份病鸡样品用研制的试纸条进行MG检测。并对所有样品进行实验室病原培养、平板凝集试验验证检测,结果与MG胶体金试纸检测结果比对,比较结果符合率。
2 结果
2.1分离MG的CCU测定
CCU测定结果显示,将MG液体培养物在细胞培养板上进行10倍系列稀释,37℃培养。经过6d后变色孔停止增加,终点稀释度均为10-8。即MG颜色变化单位为1×108CCU/mL。
2.2鸡MG抗体及兔抗鸡IgG抗体效价、浓度测定
采用平板凝集试验测定鸡MG抗体效价,双向
琼脂扩散试验测定兔抗鸡IgG抗体效价,紫外吸收法测定MG抗体、兔抗鸡IgG抗体浓度。结果显示:鸡MG抗体的平均效价为1∶200,浓度为3.87 mg/mL。兔抗鸡IgG抗体的平均效价为1∶64,浓度为5.26mg/mL。
2.3胶体金标记MG抗体最低标记量和最适pH测定
对MG抗体做100μg/mL~500μg/mL的逐级浓度稀释,观察与1mL胶体金结合后的颜色变化,确定用于胶体金标记的MG抗体的最低标记量为35μg/mL。通过调节胶体金溶液pH范围,确定胶体金标记MG抗体的最适pH为7.5。
2.4硝酸纤维素膜包被鸡MG抗体、兔抗鸡IgG抗体最适稀释度测定
对鸡MG抗体、兔抗鸡IgG抗体浓度梯度稀释,做方阵试验,确定用于硝酸纤维素膜包被的鸡MG抗体、兔抗鸡IgG抗体最适稀释度分别为400 μg/mL和500μg/mL。
2.5试纸条性能检测
用试纸条分别对蒸馏水、0.05mol/L的PBS、TBS、衣原体、滑液支原体、猪肺炎支原体、鸡大肠埃希菌和鸡白痢沙门菌进行检测。结果表明,试纸条对上述样品检测结果均为阴性,说明该试纸条具有较好的特异性。用试纸条检测倍比稀释MG结果显示,本试纸条可检测到1∶1 280倍稀释的MG,即CCU单位为8×104CCU/mL,具有很高的灵敏度。对不同批次和批间的试纸条进行重复试验结果表明,该试纸条稳定性良好,无变异现象。
2.6MG胶体金试纸条的初步应用
用制备的胶体金免疫层析试纸条对山西省太谷县某养鸡场的38只病鸡进行测试,均呈现阳性,与平板凝集试验、MG培养结果一致。对收集的95份病鸡样品进行FM-4培养基培养,确诊了35份阳性样品。然后用平板凝集试验和自制的MG免疫层析试纸条对其进行对比检测试验。在已经确诊的35份样品中,试纸条检测出32份阳性样品,平板凝集试验检测出33份阳性样品。对已经确诊的60份阴性样品进行检测,平板凝集试验和试纸条法均未检测出阳性样品。试纸条和培养法检测样品的阳性符合率为91.43%(32/35),总符合率为96.84%(92/ 95)。平板凝集试验与实验室培养法的阳性符合率94.29%(33/35),总符合率为97.89%(93/95)。试纸条和平板凝集试验两种方法比较,阳性符合率为96.97%(32/33),总符合率为98.92%(92/93)。两种试验方法的结果比较一致。证明研制的MG试纸条具有很高的准确性。
3 讨论
MG是一种很小的原核生物,对体外培养条件要求很高,无法在一般培养基上生长。近年出现的其他MG检测手段操作繁琐、主观性强。本文首次建立MG胶体金免疫层析试纸条诊断鸡MG感染,其检测样品用量少(<1 mL),操作简便,可在10 min内观察结果,具有较高的临床实用性。准确性、灵敏性和特异性是影响胶体金试纸检测效果的三大关键指标,该试验在开展过程中反复论证,从多个环节确保胶体金试纸条检测的有效性。
灵敏性方面,胶体金颗粒的大小是影响试纸灵敏度的重要因素之一。胶体金颗粒的大小对其与抗体的偶联以及偶联后的灵敏度影响很大。胶体金颗粒过大会使选择的硝酸纤维素膜的孔径增加,抗体偶联后扩散能力下降,降低检测的灵敏度;胶体金颗粒过小会增加标记时加入的蛋白质量[15]。本试验选择直径20nm的胶体金颗粒,大小适宜。同时通过浓度梯度稀释,对胶体金标记所需的MG抗体最低标记量、最适pH进行测定,保证了胶体金与MG抗体的结合比例和效率,从而最大程度地提高了试纸条的灵敏性。
准确性方面,在硝酸纤维素膜上分别位于检测线和质控线的鸡MG抗体和兔抗鸡IgG抗体的包被浓度是影响试纸准确性的关键因素[16]。抗体包被浓度过高会造成假阳性,浓度过低又会降低试纸灵敏度和准确性。本试验通过抗体浓度梯度稀释,建立方阵试验,确定鸡MG抗体和兔抗鸡IgG抗体的最适稀释度,保证了两者在检测过程中与胶体金标记蛋白复合物的结合。试验将试纸条所检测出的阳性结果与其他方法进行比对,发现与实验室培养法和平板凝集试验法的检测结果符合率分别达到94.29%和96.97%,这显示试纸条具有很高的准确性,能显著避免检测结果假阳性的出现。
特异性方面,该试纸条不与衣原体、滑液支原体、猪肺炎支原体、鸡大肠埃希菌和鸡白痢沙门菌等病原体作用,证明其具有很好的特异性。试验后期,用检验合格的MG胶体金试纸条对山西省太谷县某鸡场以及本实验室收集的病鸡样本进行了初步检测,进一步验证了制作的MG胶体金层析试纸条,且试验数据在一定程度上反映了太谷县周边地区鸡MG感染状况,为下一步鸡MG感染的防控提供依据。
参考文献:
[1] 郭伟娜.鸡毒支原体感染的流行和控制[J].山东畜牧兽医,
2010,31(5):80-81.
[2] 刘轶秋,张 媛,薛青红,等.恩诺沙星与其他抗菌药对鸡毒支原体的体外联合抑菌试验[J].中国兽药杂志,2013,47(12):46-50.
[3] Xiao X,Zhao D H,Yang X,et al.Mycoplasma gallisepticum and E.coli mixed infection model in broiler chickens for studying valnemulin pharmacokinetics[J].J Vet Pharmacol Therap,2014,37(1):99-102.
[4] Zhu A,Huo R,Zhou W,et al.Establishment of colloidal gold immunochromatography strip for detection of florfenicol residues[J].Cur Pharma Anal,2014,10(4):263-270.
[5] 庄金秋,梅建国,沈志强.胶体金免疫层析技术在兽医临床诊断中的应用进展[J].中国动物检疫,2012,29(9):70-75.
[6] 齐新永,徐 锋,张维谊,等.上海地区鸡毒支原体的分离与鉴定[J].上海畜牧兽医通讯,2013(6):24-25.
[7] 高莉萍,盛凤仙,浦奕奕,等.紫外分光光度法快速测定人纤维蛋白原制品中蛋白质含量[J].上海预防医学,2012,24(1):41-42.
[8] 彭伏虎.禽流感与新城疫胶体金免疫层析快速检测技术及初步应用研究[D].湖北武汉:华中农业大学,2008.
[9] 李淑群,曹碧云,常化仿,等.胶体金免疫层析法快速检测牛奶、奶粉、饲料中的三聚氰胺[J].分析化学,2013,41(7):1025-1030.
[10] Zhang J,Guo Y,Hu S,et al.An adhesion molecule-based colloidal gold immunochromatography assay strip for rapidly and specifically detecting chicken antibodies against Mycoplasma gallisepticum[J].Res Vet Sci,2011,90(3):379-384.
[11] Niu K,Zheng X,Huang C,et al.A Colloidal gold nanoparticle-based immunochromatographic test strip for rapid and convenient detection of Staphylococcus aureus[J].J Nanosci Nanotechnol,2014,14(7):5151-5156.
[12] Hampl J,Hall M,Mufti N A,et al.Upconverting phosphor reporters in immunochromatographic assays[J].Anal Biochem,2001,288(2):176-187.
[13] 张绍庚,段跃强,张德玺,等.胶体金免疫层析试纸条快速检测乙型流感病毒[J].免疫学杂志,2012,28(11):981-984.
[14] 孙 婧.犬瘟热病毒单克隆抗体夹心ELISA检测方法和胶体金免疫层析试纸条的研究[D].山东泰安:山东农业大学,2013.
[15] 姜金庆,杨雪峰,王自良,等.克伦特罗和莱克多巴胺多残留胶体金免疫层析试纸条的研制[J].畜牧兽医学报,2013,44(1):87-94.
[16] 王宵雪.恩诺沙星免疫胶体金快速检测试纸条的研制[D].天津:天津科技大学,2012.
Development and Application of Colloidal Gold Immunochromatographic Strip for Rapid Detection of Mycoplsma gallisepticum
NING Guan-bao1,LIU Guo-li2,ZHANG Ding3,LI Hong-quan1,MA Hai-li1,GAO Rong-kun1,HAO Wei-fang4,GAO Wen-wei1,ZHAO Yu-jun1,GAO Shi-min1,LI Jian-hui1,LI Gui-lan1,YAN Fang1,TIAN Wen-xia1
(1.College of Animal Science and Veterinary Medicine,Shanxi Agricultural University,Taigu,Shanxi,030801,China;2.Jiexiu Municipal Labor and Social Security Bureau,Jiexiu,Shanxi,032000,China;3.College of Veterinary Medicine,Huazhong Agricultural University,Wuhan,Hubei,430070,China;4.Taiyuan Center for Disease Control and Prevention,Taiyuan,Shanxi,030024,China)
Abstract:This study aimed to develop a colloidal gold immunochromatographic strip specific for Mycoplsma gallisepticum(MG)detection.a 20nm-diameter colloidal gold was selected to mark the purified MG anbibody,which was then wrapped with nitrocellulose membrane.Another purified MG antibody and rabbitanti-chicken IgG antibody was also connected to nitrocellulose membrane as test line and control line respectively.Two red reaction stripes both on the test and control line showed up when the finished strip was justified with the standard MG antigen;while only one red line appeared on the control line in the negative samples.The strips can detect the diluted MG antigens up to 1∶1 280(8×104CCU/mL),indicating a satisfied sensitivity.We also justified the qualified specificity of the strip by testing Chlamydia,Mycoplsma synoviae,Mycoplasma hyopneumoniae,chicken Escherichia coli and Salmonella,all of which presented negative results.To evaluate the accuracy of the strip,we verified the 70positive samples and 60 negative samples tested with strips using laboratory MG cultivation and plat agglutination methods.Results showed that the strip had a total coincidence of 98.92% with laboratory MG cultivation way,and 96.97% with the plat agglutination method.In conclusion,the developed colloidal gold immunochromatographic strip had qualified requirements of specificity,sensitivity and accuracy,and was recommended to extensively apply in the clinic MG disease diagnosis.
Key words:Mycoplasma gallisepticum;colloidal gold;immunochromatography;strip
通讯作者
作者简介:宁官保(1961-),男,山西闻喜人,副教授,主要从事生物技术研究。*
基金项目:山西省自然科学 (2014011028-1,2009011043-1);山西省科技攻关项目(20130311027-3);国家自然科学基金项目(31072179)
收稿日期:2014-12-06
中图分类号:S852.62
文献标识码:A
文章编号:1007-5038(2015)05-0025-04

