B型产气荚膜梭菌C58-1株ε毒素基因序列分析与可溶性表达
林初文,张松林,刘 磊,马永彪,沈志强,,韩文瑜(1.吉林大学动物医学学院,吉林长春,1006;.山东省滨州畜牧兽医研究院,山东滨州56600;.山东绿都生物科技有限公司,山东滨州56600)
B型产气荚膜梭菌C58-1株ε毒素基因序列分析与可溶性表达
林初文1,2,张松林2,刘磊3,马永彪3,沈志强2,3,韩文瑜1*
(1.吉林大学动物医学学院,吉林长春,130062;2.山东省滨州畜牧兽医研究院,山东滨州256600;3.山东绿都生物科技有限公司,山东滨州256600)
摘 要:利用PCR技术从B型产气荚膜梭菌扩增出ε毒素基因,然后用限制性核酸内切酶BamHⅠ和SalⅠ对其进行酶切,回收984bp的ε毒素基因片段,将其定向克隆在载体PET-32a中,获得重组质粒pETε984。将pETε984转化至受体菌BL21(DE3)中。重组菌株经IPTG诱导后,其表达产物经SDS-PACE分析。结果表明,重组目的蛋白在大肠埃希菌成功表达,融合蛋白大小为51ku,存在于细菌培养上清中,可溶性蛋白占菌体总蛋白相对含量的67.8%。序列分析表明C58-1株ε毒素蛋白序列与目前公布的所有B型和D型产气荚膜梭菌同源性均在99.7%以上,但ε毒素蛋白序列第321位出现了S→Y突变。研究结果为ε毒素蛋白的亚单位疫苗研究奠定了基础。
关键词:产气荚膜梭菌B型C58-1株;ε毒素基因;表达;序列分析
产气荚膜梭菌(Clostridum perfringens),又名魏氏梭菌(Cl.wechii),能引起人类气性坏疽及多种动物的肠毒血症和坏死性肠炎,是近年来我国家畜“猝死症”的主要病原。根据毒素-抗毒素中和试验可将该菌分为A、B、C、D、E五型[1]。A型菌引起人和其他动物气性坏疽、马坏死性肠炎及人食物中毒;B型菌引起羔羊痢疾及羊肠毒血症;C型菌引起羊猝狙、犊牛及羔羊肠毒血症、仔猪红痢、人及禽坏死性肠炎;D型菌引起绵羊、山羊、羔羊肠毒血症及羊软肾病;E型菌引起犊牛及羔羊痢疾[2]。实验动物中以豚鼠、小鼠、鸽及幼猫最易感,家兔次之。近年在患多发性细胞壁硬化的患者中检出B型产气荚膜梭菌[3]。B型产气荚膜梭菌可产生的最重要的致死性毒素有α、β、ε3种[4]。在发现该菌能产生的多种外毒素中,其中最重要的致死性毒素有α、β、ε、ι4种[5]。ε毒素作为一种通透酶,能增加肠的通透性,从而使其容易吸收入血,进而损害脉管的内皮细胞,造成循环液的丢失,引起水肿;并能造成肾脏功能的损害。β毒素和ε毒素也能损害神经系统,从而使动物表现严重的精神沉郁,对矫正治疗没有应答,死亡率高或许与此有关。ε毒素需要蛋白水解酶的激活,在B型菌株引起的疾病中,没有β毒素的毒性作用大[6-8]。目前认为,B型产气荚膜梭菌所产生的毒素中,β1毒素和ε毒素为主要毒素,α毒素次之[9]。
ε毒素被美国CDC列为可用于战争和恐怖行动的B类生物武器。由于ε毒素可随食草家畜的感染产气荚膜梭菌孢子的食料而传播,也可能以气溶胶的形式被大量扩散。因而加强ε毒素基础和应用方面研究尤为必要,可为疾病的预防和控制作好技术和物质储备[10]。本文克隆、表达了产气荚膜梭菌B 型C58-1株的ε毒素基因,并对其氨基酸序列进行了遗传进化分析,为进一步研究ε毒素基因的结构、功能以及亚单位疫苗的研究奠定基础。
1 材料与方法
1.1材料
1.1.1菌株 B型产气荚膜梭菌中国标准株C58-1株购自中国兽药监察所,受体菌JM109由山东省滨州畜牧兽医研究院重点实验室保存。
1.1.2试剂 限制性核酸内切酶BamHⅠ和SalⅠ为New England BioLabs公司产品,Taq DNA Polymerase(recombinant)为Thermo Fisher Scientific Inc公司产品。pMD 18-T Vector和T4DNA连接酶为宝生物工程(大连)技术服务有限公司产品;细菌基因组提取试剂盒EZNA Bacterial DNA Kit为Omega Bio-Tek Inc公司产品;原核表达载体pET-32a由本实验室保存。
1.2方法
1.2.1细菌基因组的提取 按照EZNA Bacterial
DNA Kit说明书进行。
1.2.2引物设计 参考GenBank(登录号:JF833085)收录的产气荚膜梭菌ε毒素基因序列,设计一对特异性引物,引物序列为:pε984s:GGGGGATCCATGAAAAAAAATCTTGTAAA,pε984r:GGGGTCGACTTTTATTCCTGGTGCC,其中下划线部分是加入的BamHⅠ和SalⅠ酶切位点。PCR反应参数:95℃5min;95℃1min,53℃1min,72℃1 min,共进行30个循环;72℃延伸10min。
1.2.3ε毒素基因克隆 将PCR扩增产物回收,经T4连接酶与pMD18-T Vector连接,经BamHⅠ和SalⅠ酶切鉴定正确后,送往上海生工生物工程技术服务有限公司进行序列测定。
1.2.4表达载体的构建与鉴定 利用限制性核酸内切酶BamHⅠ和SalⅠ对ε毒素基因进行双酶切处理,将其定向克隆在事先经同样内切酶处理的载体pET-32a的相应位点上,转化至受体菌BL21 (DE3)中,然后涂种在氨苄霉素琼脂平板上。挑取阳性重组菌落,经37℃过夜培养后,抽提质粒,以BamHⅠ和SalⅠ进行酶切鉴定。
1.2.5ε毒素基因的表达与检测
1.2.5.1ε毒素基因的表达 将pETε984按照1∶100的比例加入LB/Amp+的培养基中,37℃摇床180r/min摇菌2h~3h。细菌密度OD600≈0.4,加入1mol/L的IPTG至终浓度1mmol/l,同时设置空载体对照组,于37℃摇床180r/min诱导3h。取上述诱导的菌液4 000r/min离心20min,收集菌体沉淀,用PBS重悬,冰浴条件下超声波破碎,至澄清或尽量至澄清状态。将破碎的菌液于4℃、12 000 r/min离心10min。沉淀用PBS重悬后加入等量2×上样缓冲液,上清中加入等量2×上样缓冲液,煮沸10min,处理好的样品用于SDS-PAGE检测。
1.2.5.2表达产物的SDS-PAGE分析 取诱导的菌液1mL,在冰浴中进行超声波破菌,每次超声4 s,间隔4s,共处理时间10min。裂解后的菌液于4℃10 000r/min离心10min,分别收集上清和沉淀,取样进行SDS-PAGE电泳分析,确定表达产物在大肠埃希菌细胞中的分布。
处理好的样品置于120g/L分离胶和50g/L浓缩胶的SDS-PAGE电泳进行检测。电泳起始电压为80V,样品完全进入分离胶后,增高电压至120 V,电泳8h。电泳结束后取出凝胶,加入考马斯亮蓝染色液染色,置于水平摇床上染色4h。将凝胶用单蒸水清洗2次,倒入脱色液置于水平摇床上脱色,2h换1次脱色液,至背景色褪去后,观察结果。
1.2.6序列比对与分析 利用胶回收试剂盒回收PCR产物,送到大连宝生物进行测序分析。测序结果用综合序列分析软件DNA Star(版本号:7.10)进行同源性检索分析,然后利用CLUSTALW(版本号:2.1)进行序列的多重比对。
2 结果
2.1ε毒素基因克隆
PCR扩增产物经10g/L琼脂糖凝胶电泳检测,结果出现一条小于1 000bp的特异性条带(图1),与预期相符。
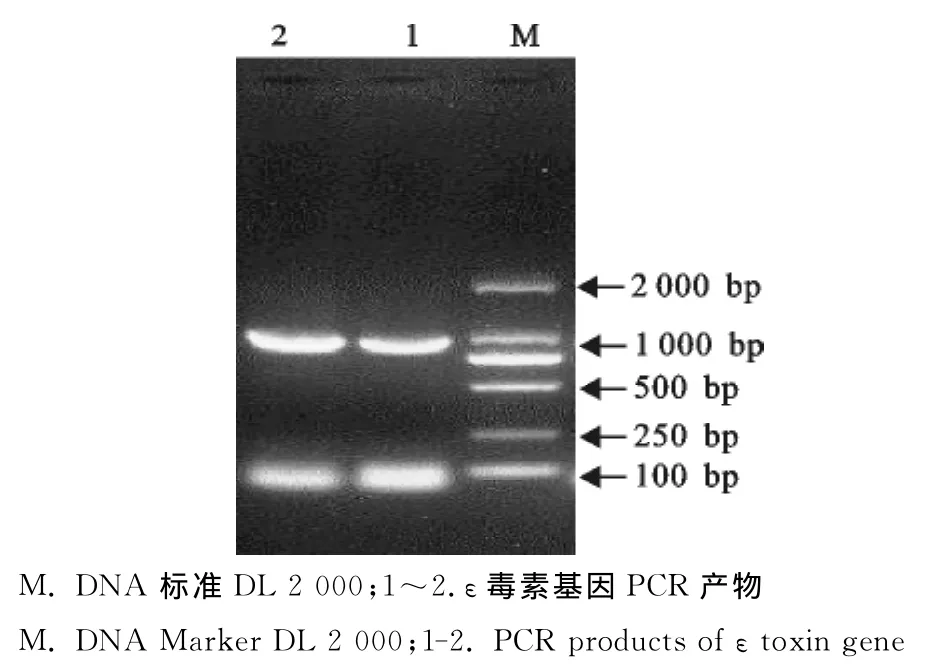
图1 ε毒素基因PCR产物电泳Fig.1 Agarose gel electrophoresis ofεgene PCR products
2.2表达载体的构建
用限制性核酸内切酶BamHⅠ和SalⅠ对克隆在pET-32a载体的ε毒素基因进行双酶切鉴定,琼脂糖凝胶电泳图像出现两条近似984bp和5 900bp的目的条带(图2),其大小与ε毒素基因和pET-32a载体相符合,获得正确的重组表达质粒,命名为pETε984。
2.3ε毒素基因的表达
以BL21(DE3)菌株作为表达宿主菌,经转化挑取单个菌落培养,菌体经超声波处理后,用SDSPAGE分析,表明ε毒素基因获得了表达。经凝胶成像仪扫描分析,IPTG诱导重组菌株pETε984毒素在上清和包涵体均获得表达。其中上清中可溶性蛋白占总蛋白量的67.8%(图3)。
2.4ε毒素基因序列分析
C58-1株ε毒素基因由987bp组成,其中1bp ~96bp是信号肽部分。利用NCBI进行序列同源性比对,在GenBank找到6条完整的ε毒素基因序列,分别是B型产气荚膜梭菌AB444205、X60694和AY858558,D型产气荚膜梭菌JX010451、HQ179546和M95206。ε毒素蛋白序列无论在B型还是D型产气荚膜梭菌几乎没有差异,蛋白序列同源性在99.7%~100%之间(图4)。相对于其他
毒株,M95206株除了第321位氨基酸由丝氨酸变为酪氨酸外,其余任何变化。
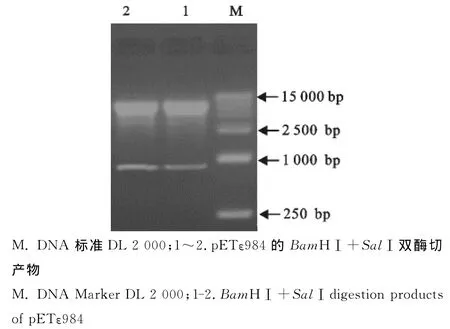
图2 pETε984的酶切鉴定Fig.2 Identification of pETε984enzyme digestion
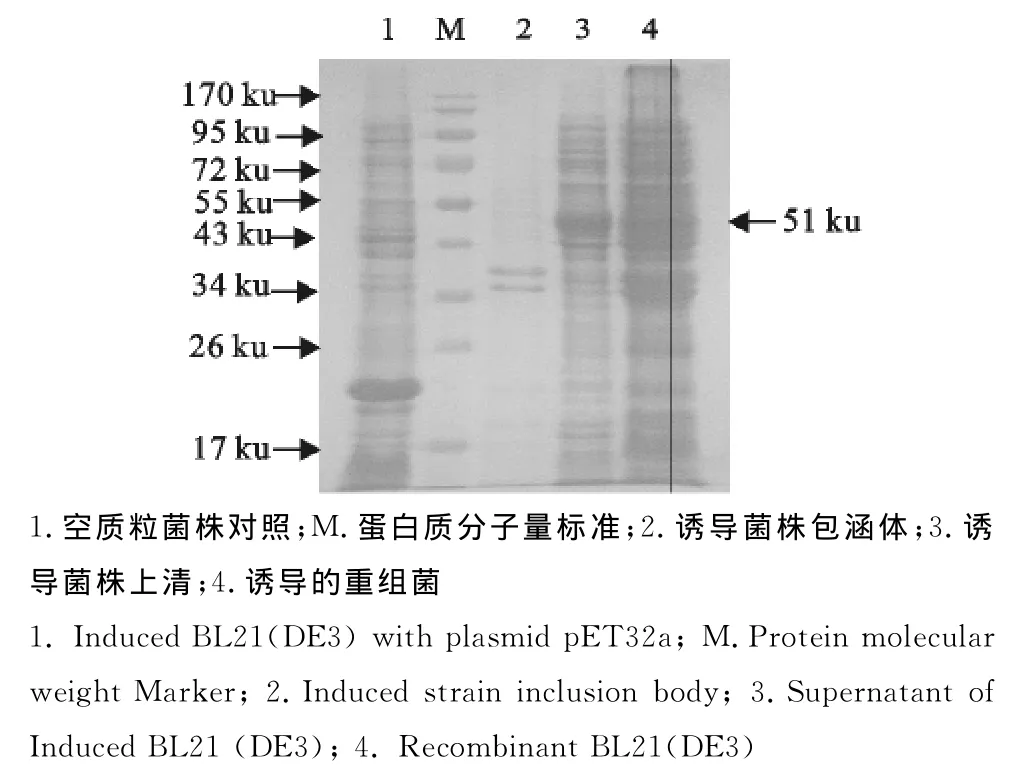
图3 表达产物SDS-PAGE结果Fig.3 SDS-PAGE analysis of the expressed products
图4 ε毒素序列的遗传变异Fig.4 Genetic variation ofεtoxin sequences
3 讨论
产气荚膜梭菌的致病因子是菌体产生的外毒素,现已发现的外毒素有α、β、γ、δ、ε、η、θ、ι、κ、λ、μ、ν 共12种[11]。梭菌外毒素是梭菌疫苗的有效免疫抗原,梭菌性疾病的有效免疫,主要是通过灭活梭菌培养过程中所产的毒素而实现。因此,培养此类细菌,使其大量生长繁殖并分泌高浓度的毒素、表达强毒力,可以制作出免疫效果优良的疫苗。羊快疫(腐败梭菌)、羔羊痢疾(产气荚膜梭菌B型)、肠毒血症(产气荚膜梭菌D型)三联灭活疫苗就是其中之一,它可以预防羊快疫、猝狙(产气荚膜梭菌C型)、羔羊痢疾和肠毒血症4种传染病,被称为羊梭菌病三联四防苗,在我国被广泛使用。然而,目前生产中多使用厌气肉肝胃酶消化汤培养厌气梭菌,需要牛肉、肝、胃蛋白酶等昂贵的原料,成本高昂,工艺复杂。另一方面,受到肉品质的影响(如抗生素的残留、新鲜度等),使得培养基质量不易控制,进而影响到疫苗的质量。通过基因工程技术制备基因重组疫苗为解决上述问题提供了可行性方案。Reze P L等[12]在大肠埃希菌中串联表达β1-ε毒素,获得稳定、大量的表达,表达的融合蛋白和自然毒素具有同等的毒力。Zeng J等[13]利用融合表达的α-β2-β1类毒素免疫大鼠、母猪和奶牛,结果发现被免疫大鼠机体产生了显著地保护性免疫应答,被免疫的猪血清中和奶牛乳液中均检测到了该融合毒素蛋白的抗体。Felipe M S等[14]也发现重组表达的产气荚膜梭菌α-β1类毒素可提高母猪产前被动体液免疫水平。目前,国内学着已经利用基因工程方法,成功表达了ε毒素和α,并且动物免疫保护试验取得了乐观的结果[15]。为此我们利用基因工程方法,克隆、表达产气荚膜梭菌B型的主要2种毒素基因(β1毒素和ε毒素),通过单独表达β1毒素和ε毒素以及串联表达β1-ε毒素(实验数据在本文没有显示),试图找到一种可以替代传统B型产气荚膜梭菌疫苗制备方法。
研究克隆了C58-1株ε毒素基因,构建了原核重组表达载体pETε984,并且在BL21菌株中得到了表达,其中可溶性蛋白占总蛋白量的67.8%。序列分析表明,C58-1株ε毒素蛋白序列与目前公布的所有B型和D型产气荚膜梭菌同源性均在99.7%以上,以此推断,ε毒素在B型和D型产气荚膜梭菌中具有相同或相似的功能。另外,ε毒素作为B型和D型产气荚膜梭菌重要毒素蛋白,免疫B型ε毒素蛋白的动物可能对ε型菌也有一定的抵抗能力。在ε毒素蛋白序列第321位出现了S→Y突变,作为最容易突变的氨基酸之一,推测这种变化不会对蛋白功能产生较大影响。
参考文献:
[1] Carman R J,Sayeed S,Li J,et a1.Clostridium perfringens toxin genotypes in the feces of healthy North American[J].Anaerobe,2008,14(2):102-108.
[2] Rumah K R,Linden J,Fischetti V A,et al.Isolation of Clostridium perfringens type B in an individual at first clinical presentation of multiple sclerosis provides clues for environ-
mental triggers of the disease[J].PLoS One,2013,8:e76359.
[3] Mathur D D,Deshmukh S,Kaushik H,et al.Functional and structural characterization of soluble recombinant epsilon toxin of Clostridium perfringens D,causative agent of enterotoxaemia[J].Appl Microbiol Biotechnol,2011,88(4):877-884.
[4] Filho E J,Carvalho A U,Assis R A,et al.Clinicopathological features of experimental Clostridium perfringens type D enterotoxemia in cattle[J].Vet Pathol,2009,46(6):1213-1220.
[5] Carman R J,Sayeed S,Li J,et al.Clostridium perfringens toxin genotypes in the feces of healthy North American[J].Anaerobe,2008,14(2):102-108.
[6] Chassln C,Bens M,de Barry J,et a1.Pore-forming epsilon toxin causes membrane permeabilization and rapid ATP depletionmediated cell death in renal collecting duct cells[J].Am J Physiol Renal Physiol,2007,293(3):927-937.
[7] Losada-Eaton D M,Uzal F A,Fernández Miyakawa M E. Clostridium perfringens epsilon toxin is absorbed from different intestinal segments of mice[J].Toxicon,2008,51(7):1207-1213.
[8] Fernandez-Miyakawa M E,Jost B H,Billington S J,et a1.Lethal effects of Clostridium perfringens epsilon toxin are potentiated by alpha and per-fringolysin-O toxins in a mouse model [J].Vet Microbiol,2008,127(3-4):379-385.
[9] 霍萍萍,张聪敏,胡明丽,等.产气荚膜梭菌β毒素研究进展[J].动物医学进展,2013,34(9):90-94。
[10] 卢田粉,柴同杰,孙玲玉,等.产气荚膜梭菌ε毒素蛋白高效表达体系的构建及其免疫保护性的研究[J]。中国畜牧兽医,2012,34(9):59-62.
[11] 王光华,蔺国珍,郑福英,等.D型产气荚膜梭菌ε毒素基因表达及其免疫保护作用的初步研究[J].中国畜牧兽医,2012,39 (3):36-40.
[12] Reze PL,Mehdi S,Khosrow A.Expression of Clostridium perfringens epsilon-beta fusion toxin gene in E.coli and its immunologic studies in mouse[J].Vaccine,2013,31(32):3295-3299.
[13] Zeng J,Deng G C,Wang J,et al.Potential protective immunogenicity of recombinant Clostridium perfringensα-β2-β1fusion toxin in mice,sows and cows[J].Vaccine,2011,29 (33):5459-5466.
[14] Felipe M S,Fabricio R C,Carlos E P C,et al.Vaccination with recombinant Clostridium perfringens toxoids αandβpromotes elevated antepartum and passive humoral immunity in swine[J].Vaccine,2013,31:4152-4155.
[15] 李 娜,吴建勇,李建军,等.D型产气荚膜梭菌α毒素基因的克隆与高效表达[J].中国畜牧兽医,2012,39(12):10-13.
Soluble Expression and Sequence Analysis ofεToxin Gene of Clostridum perfringens Type B C58-1 Strain
LIN Chu-wen1,2,ZHANG Song-lin2,LIU Lei3,MA Yong-biao3,SHEN Zhi-qiang2,3,HAN Wen-yu1
(1.College of Animal Sciences and Veterinary Medicine,Jilin University,Changchun,Jilin,130062,China;2.Shandong Binzhou Animal Science &Veterinary Medicine Academy,Binzhou,Shandong,256600,China;3.Shandong Lvdu Bio-Sciences &technology Co.,Ltd,Binzhou,Shandong,256600,China)
Abstract:In order to investigate the characteristics of prokaryotic expressionεtoxin gene was amplified fromClostridum perfringens type B C58-1strain by PCR,PCR products were digested with restriction endonucleases BamHⅠand SalⅠ,then the 984bp gene fragment was recovered and inserted into the same site of PET-32avector.The recombinant plasmid pETε984was obtained and transfected into BL21(DE3). The recombinant strain was induced with IPTG for expression.In SDS-PAGE analysis,the fusion protein was 51ku as expected and distributed in ultrasonic lysis,and the expressed products were about 67.8%of total cellular protein.Theεsequence analysis showed that more than 99.7%homology was found in comparison with that of Clostridum perfringens serotype B and D.However,S→Y mutation was determined in the 321th protein sequence.The results lay an important foundation for the further subunit vaccine research of epsilon toxin.
Key words:Clostridum perfringens type B C58-1strain;εtoxin gene;expression;sequence analysis
通讯作者
作者简介:林初文(1975-),男,山东省高密人,副研究员,主要从事预防兽医专业研究。*
基金项目:山东省现代农业产业技术体系羊产业创新团队项目(SATS-201226-3)
收稿日期:2014-08-11
中图分类号:S852.616.3
文献标识码:A
文章编号:1007-5038(2015)05-0029-04

