兔肠艾美耳球虫实时荧光定量PCR 检测方法的建立
许家园,程 田,胡会朋,陈晓珍,翁亚彪,林瑞庆(华南农业大学兽医学院,广东广州510642)
兔肠艾美耳球虫实时荧光定量PCR 检测方法的建立
许家园,程田,胡会朋,陈晓珍,翁亚彪,林瑞庆
(华南农业大学兽医学院,广东广州510642)
摘 要:为建立一种肠艾美耳球虫定量的检测方法,在肠艾美耳球虫核糖体第二内转录间隔区(ITS2)序列设计一对特异性引物,以10倍倍比稀释的已知卵囊含量的肠艾美耳球虫DNA为模板进行SYBR GreenⅠreal-time PCR的扩增和标准曲线的建立。结果显示,最低可检测1个卵囊含量的样品,与同属的黄艾美耳球虫、中型艾美耳球虫、大型艾美耳球虫均不发生交叉反应,重复性变异系数小于2%。表明建立的实时荧光定量PCR检测方法灵敏度高,特异性强,重复性好,可为快速检测肠艾美耳球虫提供有效的方法。
关键词:兔;肠艾美耳球虫;SYBR GreenⅠ;实时荧光定量PCR
兔球虫病是由艾美耳属球虫寄生于家兔肝胆管及肠上皮细胞内引起的一种最常见的原虫性疾病,该病流行广泛[1-2],对不同年龄段的兔均有不同程度的危害,严重影响养兔业的健康发展[3]。国际上公认的兔艾美耳球虫有11个种[4],其中肠艾美耳球虫是3种强致病性兔球虫虫种之一,能引起严重的球虫病。因此,开展对该病病原的检测对其防控有重要的意义。
长期以来,对球虫病的诊断主要依靠传统的卵囊形态、致病性、寄生部位、肠道病变特征等指标[5],近年来普通PCR也逐渐用于兔球虫的检测[6-7],促进了兔球虫的分子鉴定研究。实时荧光定量PCR (real-time PCR)具有重复性好、灵敏度高、定量准确、工作效率高等优点[8],近年来国外不少学者将此方法用于检测临床寄生虫的感染,Morgan J A T等[9-10]建立了7种鸡球虫的real-time PCR检测方法,可以准确的检测出多价鸡球虫活疫苗中的各种球虫的卵囊含量,对临床鸡粪便中的卵囊检测可以精确到1个卵囊。但目前未见荧光定量检测方法应用于兔球虫的临床研究。因此,本试验拟建立一种兔肠艾美耳球虫real-time PCR检测方法,为肠艾美耳球虫病的快速诊断和定量检测提供技术手段。
1 材料与方法
1.1材料
1.1.1虫种来源 肠艾美耳球虫、黄艾美耳球虫、中型艾美耳球虫和大型艾美耳球虫纯种卵囊均由佛山正典生物技术有限公司提供。
1.1.2主要试剂 DNA提取试剂盒Wizard SV Genomic DNA Purification System购置于Promega公司。蛋白酶K购置于Merck公司。SYBR Green Premix Ex TaqⅡ、Ex-Taq DNA聚合酶、分子质量标准DL-500DNA Size Marker为宝生物工程(大连)有限公司产品。
1.2方法
1.2.1引物设计 根据GenBank中肠艾美耳球虫ITS2序列,用Primer 5.0设计一对特异性引物,上游引物F:5′-TTGTTCAATGCTGTTGCCGA -3′,下游引物R:5′-CCTCATCTTTCCACCACCGT -3′,预计扩增片段160bp,引物由华大基因公司合成。
1.2.2肠艾美耳球虫卵囊DNA提取 用血球计数板计数纯种保存的肠艾美耳球虫卵囊液,用移液枪吸取含106个卵囊的卵囊液于1.5mL离心管中,加入1mL双蒸水,13 000r/min离心10min,弃上清液,重复两次。加入与卵囊体积相同的玻璃珠,持续漩涡震荡,在显微镜下观察直到95%的卵囊壁破裂后,按Promega试剂盒Wizard SV Genomic DNA Purification System使用说明进行DNA提取,提取后的DNA于-20℃保存。
1.2.3Real-time PCR反应体系与条件 反应体系为20μL,其中SYBR Green Primix Ex TaqⅡ10
μL,上下游引物(25pmol/μL)各0.25μL,模板DNA 2μL,dd H2O 7.5μL;反应条件:95℃30s;95℃5s,60℃30s,72℃30s,共40个循环,扩增完成绘制熔解曲线。
1.2.4Real-time PCR标准曲线的建立 将提取的DNA原液做1∶10~1∶105倍比稀释,得到5个梯度的DNA样品相当于卵囊数分别为105、104、103、102、101所提取得到的DNA,将这5个梯度的DNA样品进行real-time PCR,反应体系和条件同上,根据real-time PCR的动力学曲线,检测仪系统自动生成标准曲线以及回归方程。
1.2.5Real-time PCR特异性试验 分别提取黄艾美耳球虫、中型艾美耳球虫和大型艾美耳球虫DNA,用所建立的SYBR GreenⅠreal-time PCR进行检测,收集荧光信号,检测其特异性,同时设肠艾美耳球虫阳性对照组和无模板阴性对照。
1.2.6敏感性试验 将DNA原液做1∶10~1∶106倍比稀释,用所建立的real-time PCR进行检测,并将此6种稀释度的DNA进行普通PCR扩增,电泳观察结果,比较两种方法的灵敏度。
1.2.7重复性试验 将DNA原液做1∶10~1∶105倍比稀释后进行3次组内和组间重复试验。组内重复试验:5个稀释度的样品DNA,每个浓度设3个重复,同时进行real-time PCR检测;组间重复试验:将5个稀释度的样品DNA在不同的时间做3次real-time PCR检测。根据检测结果计算Ct平均值和变异系数(CV),评价该方法的稳定性。
2 结果
2.1标准曲线的建立
以1∶10~1∶105倍比稀释DNA原液形成的5个梯度DNA作为模板进行real-time PCR扩增,得到动力学扩增曲线(图1),用Rotor Gene Q软件进行数据分析,以稀释后的DNA所代表的卵囊个数为X轴,以Ct值为Y轴,建立标准曲线(图2)。图1显示,模板Ct值与该模板DNA对应的卵囊个数存在线性关系,卵囊数越高对应的Ct值越小。该直线的斜率为-3.563 8,截距为32.548 9,R2为0.997,扩增效率为95%,从而得出标准方程:y=-3.548 9logx+32.548 9。real-time PCR溶解曲线显示扩增产物的溶解温度为83℃,未见非特异性扩增和引物二聚体生成(图3)。
2.2特异性试验
用所建立的real-time PCR方法对肠艾美耳球虫、黄艾美耳球虫、中型艾美耳球虫和大型艾美耳球虫进行检测,结果显示,除肠艾美耳球虫的检测结果为阳性外,其他种球虫的检测结果均为阴性(图4),表明该方法检测肠艾美耳球虫具有良好的特异性。
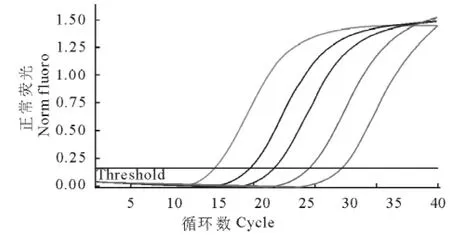
图1 肠艾美耳球虫real-time PCR扩增动力学曲线Fig.1 Dynamic curve of E.intestinalis real-time PCR
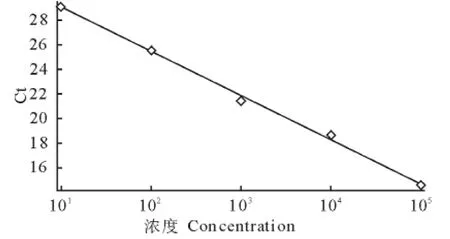
图2 肠艾美耳球虫real-time PCR标准曲线Fig.2 Standard curve of E.intestinalis real-time PCR

图3 肠艾美耳球虫扩增产物溶解曲线Fig.3 The melting curve of amplication products of E.intestinalis
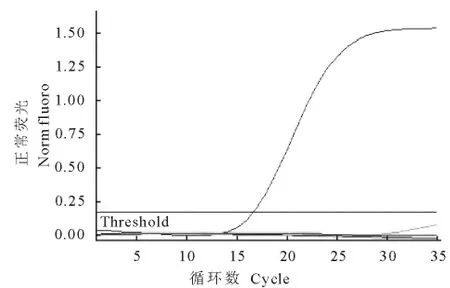
图4 real-time PCR特异性扩增曲线Fig.4 The specific amplication curve of real-time PCR
2.3敏感性试验
将DNA原液做1∶10~1∶106倍比稀释后进行real-time PCR扩增,分析其敏感性,图5显示6个稀释度的样品DNA都得到了有效的扩增,结果表明该方法最低可对106倍稀释的DNA进行检测,即可检测1个卵囊含量的样品;普通PCR结果显示原始DNA 1∶10~1∶105倍比稀释能被检测出,而106倍稀释后未能被检测出,即普通PCR可对105倍稀释的DNA进行检测,可检测10个卵囊含量的样品(图6)。该real-time PCR灵敏度是普通PCR 的10倍。
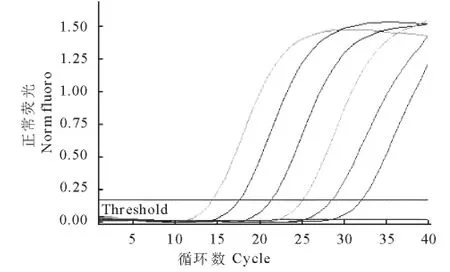
图5 real-time PCR敏感性试验Fig.5 Sensitivity test of real-time PCR
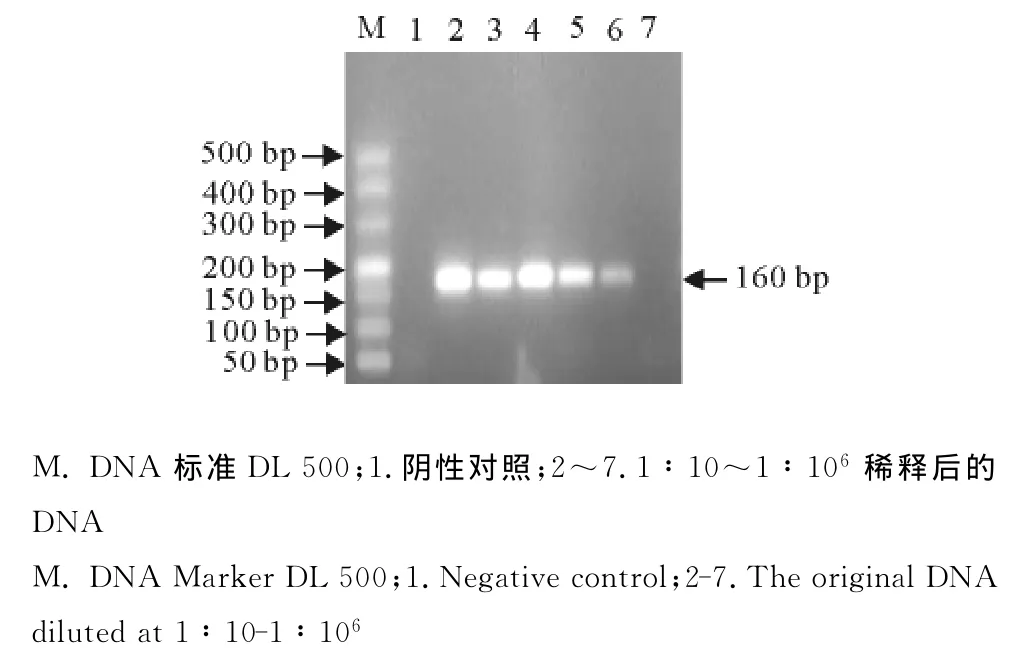
图6 普通PCR扩增结果Fig.6 The amplification results of the conventional PCR
2.4重复性试验
将原始DNA按1∶10~1∶105倍比稀释后,进行3次组内和组间重复试验。统计分析结果显示,组内重复试验的变异系数(CV)为0.1 %~1.0 %(表1),组间重复试验的变异系数(CV)为0.8 %~1.9%(表2),均小于2%。表明该方法具有良好的重复性。
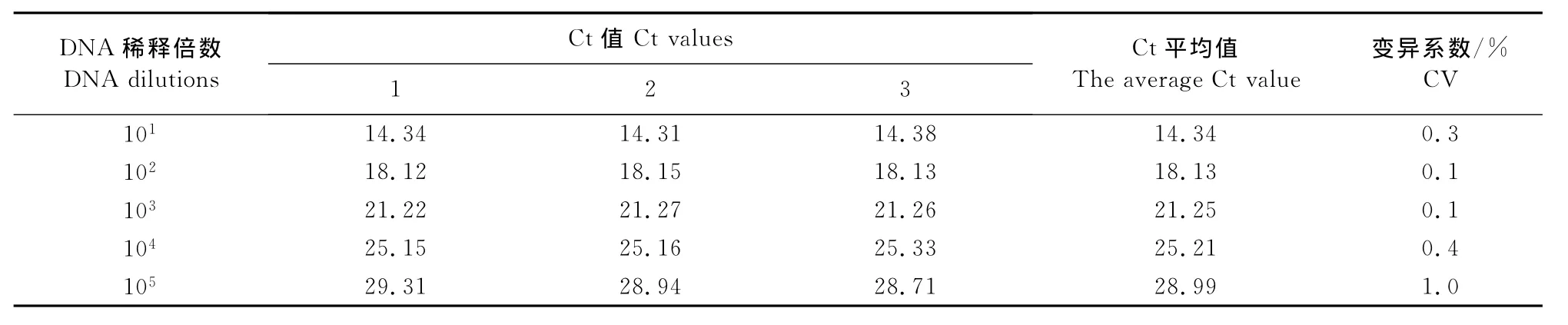
表1 SYBR GreenⅠreal-time PCR组内重复性试验结果Table 1 Intra-assay reproducibility test of SYBR GreenⅠreal-time PCR
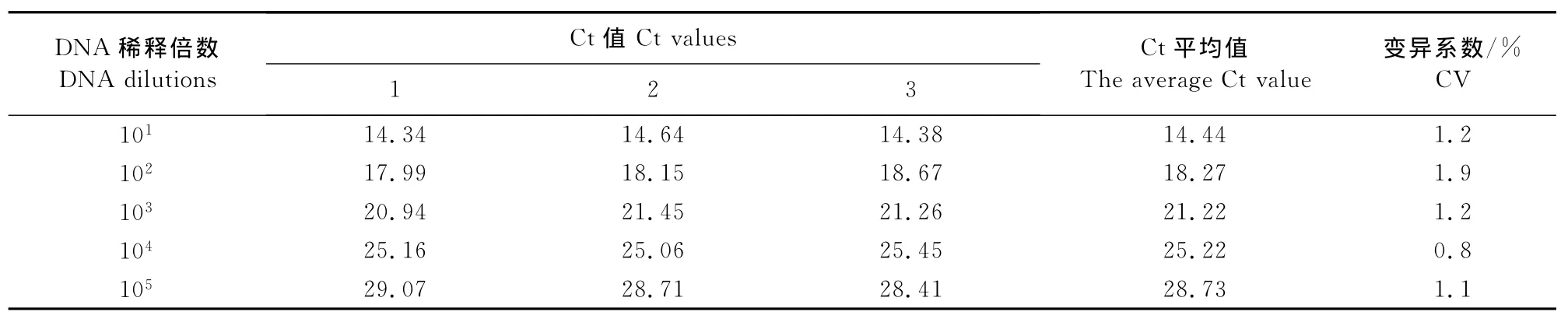
表2 SYBR GreenⅠreal-time PCR的组间重复性试验结果Table 2 Inter-assay reproducibility test of SYBR GreenⅠreal-time PCR
3 讨论
Real-time PCR是一种定量定性的检测方法,与普通PCR相比,具有灵敏、精确、简单、快速等优点,PCR的扩增及其分析过程均在同一封闭系统下完成,只需加样时打开1次PCR反应管,避免交叉污染导致假阳性的产生,因此被广泛的应用于各种临床检测[11]。
SYBR GreenⅠ法成本低、操作简便,虽然其特异性不如TaqMan探针法,但使用特异性高的引物,优化反应体系与条件,消除非特异性扩增和二聚体的生成,也能达到很高的特异性[12]。
本研究建立的SYBR GreenⅠreal-time PCR对肠艾美耳球虫的检测具有很好的特异性,最低可以检测1个卵囊含量的样品;各个浓度扩增重复性好,组内和组间重复的变异系数(CV)均小于2%,稳定性好;此方法可以直接对粪便提取的肠艾美耳球虫DNA进行检测,可以精确的检测到粪便中的卵囊含量,得到每克粪便中的卵囊含量(OPG),且一次可以对多个粪样进行检测,比传统的显微镜检查更高效精确。该real-time PCR技术特异性强、敏感度高、稳定性好,可以用于临床肠艾美耳球虫感染情况进行快速而准确的检测,为该病的临床诊断和流行病学调查提供一种技术手段。
参考文献:
[1] Jing F,Yin G,Liu X,et al.Large-scale survey of the prevalence of Eimeriainfections in domestic rabbits in China[J]. Parasitol Res,2012,110(4):1495-1500.
[2] El-Shahawi G A,El-Fayomi H M,Abdel-Haleem H M.Coccidiosis of domestic rabbit(Oryctolagus cuniculus)in Egypt:light microscopic study[J].Parasitol Res,2012,110(1):251-258.
[3] 闫文朝,王天奇,索 勋,等.家兔球虫病的研究进展[J].中国兽医科学,2010,40(11):1200-1205.
[4] Pakandl M.Coccidia of rabbit:a review[J].Folia Parasitol,2009,56(3):153-166.
[5] 薛方民.鸡艾美耳球虫不同种株ITS-1,ITS-2序列的克隆和分析比较[D].山东济南:山东师范大学,2007.
[6] Oliveira U C,Fraga J S,Licois D,et al.Development of molecular assays for the identification of the 11 Eimeriaspecies of the domestic rabbit(Oryctolagus cuniculus)[J].Vet Parasitol,2011,176(2):275-280.
[7] Yan W,Wang W,Wang T,et al.Simultaneous identification of three highly pathogenic Eimeria species in rabbits using a multiplex PCR diagnostic assay based on ITS1-5.8SrRNAITS2fragments[J].Vet Parasitol,2013,193(1):284-288.
[8] 薛 霜,独军政,高闪电,等.实时荧光定量PCR技术研究进展及其在兽医学中的应用[J].中国农学通报,2010,26 (7):11-15.
[9] Morgan J A T,Morris G M,Wlodek B M,et al.Real-time polymerase chain reaction(PCR)assays for the specific detection and quantification of seven Eimeriaspecies that cause coccidiosis in chickens[J].Mol Cell Prob,2009,23(2):83-89.
[10] Vrba V,Blake D P,Poplstein M.Quantitative real-time PCR assays for detection and quantification of all seven Eimeriaspecies that infect the chicken[J].Vet Parasitol,2010,174(3):183-190.
[11] Bhudevi B,Weinstock D.Fluorogenic RT–PCR assay (TaqMan)for detection and classification of bovine viral diarrhea virus[J].Vet Microbiol,2001,83(1):1-10.
[12] 郭 杨,陈世界,郭万柱,等.荧光定量PCR技术及其应用研究进展[J].动物医学进展,2009,30(2):78-82.
Development of Real-time PCR for Detection of Eimeria intestinalis
XU Jia-yuan,CHENG Tian,HU Hui-peng,CHEN Xiao-zhen,WENG Ya-biao,LIN Rui-qing
(College of Veterinary Medicine,South China Agricultural University,Guangzhou,Guangdong,510642,China)
Abstract:To develop a SYBR GreenⅠreal-time PCR assay to detect Eimeria intestinalis,apair of primers were designed basing on the internal transcribed spacer 2(ITS2)sequence of E.intestinalis.The standard curve was generated by using serial dilutions of E.intestinalis DNA.The result indicated that the assay was highly sensitive with detection limit of one occyst and no cross-reaction with Eimeria flavescens,Eimeria media and Eimeria magna.The results showed that this method was characterized by high sensitivity and spceificity,and could be further used in clinic detection and epidemic investigation of E.intestinalis.
Key words:rabbit;Eimeria intestinalis;SYBR GreenⅠ;real-time PCR
通讯作者
作者简介:许家园(1988-),男,安徽人,硕士研究生,主要从事兽医寄生虫研究。*
基金项目:广东省科技计划项目(2012A020100001)
收稿日期:2014-11-06
中图分类号:S852.723
文献标识码:A
文章编号:1007-5038(2015)05-0036-04

