Cav1.2通道CT1片断突变体的质粒构建和蛋白表达
雷明,赵美眯,封瑞,王红梅,毛楠,朱彤,郝丽英
(1.中国医科大学药学院药物毒理学教研室,沈阳 110122;2.东北大学环境生物学教研室,沈阳 110004)
·论著·
Cav1.2通道CT1片断突变体的质粒构建和蛋白表达
雷明1,赵美眯1,封瑞1,王红梅1,毛楠1,朱彤2,郝丽英1
(1.中国医科大学药学院药物毒理学教研室,沈阳 110122;2.东北大学环境生物学教研室,沈阳 110004)
目的构建心肌Cav1.2通道CT1片段及其突变体与谷胱甘肽转移酶(GST)重组的融合蛋白原核表达载体,并进行蛋白表达和纯化。方法以豚鼠Cav1.2通道CT1质粒(pGEX-6p-3/CT1)为模板,采用定点突变技术构建CT1 T1603A和CT1 T1603D两种突变体质粒。转化大肠杆菌BL21感受态细胞,大量培养后用IPTG诱导GST融合蛋白表达,分离纯化后采用SDS-PAGE检测CT1及其突变体蛋白的相对分子量和纯度。结果CT1片段及其突变体融合蛋白得到了正确、大量表达,提取纯化后的CT1片段及其突变体融合蛋白具有较高的纯度。结论成功构建了Cav1.2通道CT1片断及其突变体融合蛋白原核表达载体,获得了CT1突变体融合蛋白,为深入研究CT1片断在Cav1.2通道调节中的作用和机制奠定基础。
融合蛋白;CT1;突变体
电压依赖性钙通道(voltage-dependent Ca2+channel,VDCC)按照电生理特性分为低电压依赖型及高电压依赖型2种,按照药理学及生物物理学特性分为T、L、N、P/Q和R型[1,2],其中L型钙通道(L-type Ca2+channel,LTCC)可以被二氢吡啶类药物硝苯地平所阻断,也称为二氢吡啶受体。LTCC是研究最为广泛的高电压依赖型钙通道之一,存在于大多数可兴奋细胞膜上,如骨骼肌、心脏、脑、内分泌细胞、神经元及其他组织。在心肌细胞中,L型钙通道介导的钙离子内流触发肌浆网钙释放通道ryanodine受体开放,肌浆网存储的钙离子大量释放,这种级联效应称为“钙致钙释放”(Ca-induced Ca2+release,CICR),在心脏的兴奋收缩耦联(excitationcontraction couple,EC)中起着关键性作[3],LTCC的调节方式多种多样,异常复杂[4,5]。
前期研究[6~8]发现,钙离子、钙调蛋白(calmodulin,CaM)、钙离子/钙调蛋白依赖的蛋白激酶Ⅱ(Ca/ calmodulin-dependent protein kinasesⅡ,CaMKⅡ)等都是通过与LTCC C末端的CT1(1 509~1 789)片段特定的氨基酸或氨基酸序列相互作用发挥调节功能。CaM可直接与心肌细胞Cav1.2钙通道CT1片段结合,从而对钙通道钙离子依赖性易化作用进行调节[9,10],CaMKⅡ通过磷酸化CT1片段上的1 603位苏氨酸以调节钙通道的功能[11]。为了更好研究1 603位苏氨酸在Cav1.2钙通道调节中的作用,本研究以豚鼠Cav1.2通道CT1为模板,采用定点突变技术将1 603位苏氨酸分别突变为丙氨酸(CT1 T1603A)和天门冬氨酸(CT1 T1603D),模拟其去磷酸化和磷酸化状态,制备纯化蛋白并进行相应的活性鉴定,为研究Cav1.2钙通道的磷化调节奠定基础。
1 材料与方法
1.1 材料
原核表达质粒pGEX-6p-3/CT1和BL21菌株由本实验室保存。异丙基硫代-β-D半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)、溶菌酶(1ysozvme,LYS)、二硫苏糖醇(dithiothreitol,DDT)、N-十二烷基肌氨酸钠(N-laurylsarcosine,N-Lau)、氨苄西林(ampicillin,Amp)均购自美国Sigma公司;PreScission Pmtease和GS-4B beads购自德国GE Healthcare公司;胰蛋白胨、酵母提取物购自英国OXOID公司;其他试剂均购自美国BIOSHARP公司。CT1定点突变由本研究组提供原始质粒作为模板和突变位置信息,由上海生工生物工程股份有限公司代为完成突变和序列测定。
1.2 BL21感受态细胞的转化
应用42℃精确热激法进行感受态细胞的转化,将CT1及其突变体质粒导入BL21感受态细胞,构建相应的原核表达系统。具体方法如下:分别量取pGEX-6p-3/CT1、pGEX-6p-3/CT1 T1603A和pGEX-6p-3/CT1 T1603D质粒各5 ng,加入到50 μL E.coli BL21感受态细胞,轻轻混匀后冰浴30 min,再放入42℃水浴锅热击45 s,快速转移至冰浴中,冷却2 min。加入1 mL SOC培养基(不含抗生素),混匀后37℃、120 r/min水浴振荡培养l h。3 000 r/min、2 min离心后去除600 μL上清,剩余沉淀的菌体约轻轻混匀后加在含Amp 0.1 g/L的LB固体琼脂培养板上,无菌条件下涂抹均匀。晾干后转移至37°C电热恒温培养箱中,倒置培养12~16 h。取单克隆菌种接种于装有3 mL含Amp 0.1 g/L的LB培养液的15 mL离心管中,37℃、120 r/min培养12~16 h。菌液按菌液∶50%甘油比例为4∶1冻存于-80℃备用。
1.3 融合蛋白的诱导表达及提取纯化
各取10 μL菌种加入到装有200 mL含0.1 g/L Amp的LB培养液的锥形瓶中,37℃、120 r/min振荡培养12~16 h。当A600在0.8左右时,加入IPTG至终浓度1 mmol/L,37℃、120 r/min振荡培养4 h,诱导融合蛋白表达。菌液经4 000 r/min离心8 min后弃上清,用10 mL PBS重悬细菌,加入1 mol/L LYS和1 mol/L DTT各100 μL、15%N-Lau 1 mL,混匀后放置于冰上30 min,然后用超声法粉碎细菌(超声3 s停7 s,共20 min,冰上进行)。再加入30%TritonX-100 335 μL,冰上放置30 min,充分破碎细菌释放融合蛋白。16 000 g、8 min离心后将10 mL上清液加入到含200 μL GS-4B beads的15 mL离心管,4℃旋转结合过夜(GS-4B beads用PBS洗3遍,每次800 r/min离心2 min)。第2天用PBS温柔清洗beads 3次,每次5 mL,800 r/min离心2 min,去除杂蛋白,4℃保存备用。
1.4 CT1及其突变体蛋白的鉴定
用15%SDS-PAGE电泳检测纯化的CT1及其突变体蛋白的相对分子量和纯度。
2 结果
2.1 CT1及其突变体质粒的测序结果
DNA测序结果显示CT1及其突变体质粒均是含有843 bp的DNA片断,CT1片断中位于285 bp处的密码子ACG(图1A)分别突变为GCT(图1B)和GAC(图1C)。这3个密码子编码的氨基酸依次为苏氨酸(T)、丙氨酸(A)和天门冬氨酸(D),该位点氨基酸在Cav1.2通道氨基酸序列全长中对应为第1 603位。因此,结果表明已成功获得CT1突变体质粒CT1 T1603A和CT1 T1603D。
2.2 CT1及其突变体蛋白的表达与纯化
实验中表达提取的蛋白均为GST-CT1融合蛋白。其中,CT1片断共有281个氨基酸,分子量约为17.6 kDa,GST分子量约为26 kDa。采用15%SDSPAGE电泳检测该融合蛋白及其突变体蛋白。如图2所示:CT1及其突变体蛋白分子量大约为43.6 kDa,与理论值基本一致。表明该方法构建并表达所得的CT1及其突变体蛋白均能正常表达。
3 讨论
Cav1.2通道的磷酸化调节是其重要的调节途径之一,许多调控因子都是通过对通道的磷酸化和去磷酸化实现调节功能[12,13]。基于氨基酸序列结构,豚鼠Cav1.2通道C末端有17个潜在的磷酸化位点,其中相当一部分位于CT1片段(1 509~1 789)。Erxleben等[14]报道了CaMKⅡ磷酸化Ⅰ~Ⅱ环上的439位丝氨酸和CT1上的1 517位丝氨酸,引起兔心肌细胞Cav1.2通道2型开放。Lee等[15]也报道了CaMKⅡ磷酸化兔平滑肌钙通道C末端的1 512和1 570位丝氨酸,促进电压依赖性易化。前期研究发现,1 603位苏氨酸可以被CaMKⅡ磷酸化,并且对Cav1.2起着重要的调节作用[11]。CT1片断及其突变体的构建表达有利于进一步研究CT1上各个调节位点对Cav1.2通道的调节作用和机制,具有十分重要的意义。
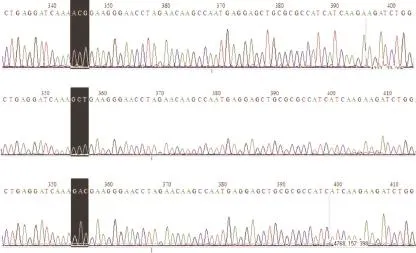
图1 CT1及其突变体重组质粒的DNA测序结果Fig.1 DNA sequence identification of GST-CT1and its mutants

图2 纯化后的CT1及其突变体GST融合蛋白SDS-PAGEFig.2 SDS-PAGE results of purified GST-CT1and its mutants
原核表达系统发展日趋完善、操作流程简单快速、成本低、产量高,尤其适宜于表达原核来源的以及不需要翻译后修饰的真核蛋白。但在表达具体某种蛋白时,需要对表达条件进行相应的优化,以获得高纯度、高表达量的融合蛋白。本研究以豚鼠Cav1.2通道CT1为模板构建了2种突变体,采用定点突变技术将1 603位苏氨酸分别突变为丙氨酸(CT1 T1603A)和天门冬氨酸(CT1 T1603D)。这2种突变体都能正常表达GST融合蛋白,而且所表达的GST融合蛋白均能与CaM结合,其Ca2+依赖性和CaM浓度依赖与CT1相似。此方法同样适用于CT1其他位点的突变,为研究Cav1.2钙通道的磷酸化调节奠定了基础。
[1]Hagiwara S,Byerly L.Calcium channel[J].Annu Rev Neurosci,1981,4:69-125.
[2]Hofmann F,Flockerzi V,Kahl S,et al.L-type CaV1.2 calcium channels:from in vitro findings to in vivo function[J].Physiol Rev,2014,94(1):303-326.
[3]Terkildsen JR,Niederer S,Crampin EJ,et al.Using Physiome standards to couple cellular functions for rat cardiac excitation-contraction[J].Exp Physiol,2008,93(7):919-929.
[4]Minor DL,Findeisen JrF.Progress in the structural understanding of voltage-gated calcium channel(CaV)function and modulation[J]. Channels(Austin),2010,4(6):459-474.
[5]Zhou CZ,Luo D.Electrophysiological characterization of spinal neuron sensitization by elevated calcium channel alpha-2-delta-1 subunit protein[J].Eur J Pain,2014,18(5):649-658.
[6]Xu JJ,Hao LY,Kameyama A,et al.Calmodulin reverses rundown of L-type Ca2+channels in guinea pig ventricular myocytes[J].Am J Physiol Cell Physiol,2004,287(6):C1717-1724.
[7]Nie HG,Hao LY,Xu JJ,et al.Distinct roles of CaM and Ca2+/CaM-dependent protein kinase II in Ca2+-dependent facilitation and inactivation of cardiac L-type Ca2+channels[J].J Physiol Sci,2007,57(3):167-173.
[8]Hao LY,Wang WY,Minobe E,et al.The distinct roles of calmodulin and calmodulin kinase II in the reversal of run-down of L-type Ca(2+)channels in guinea-pig ventricular myocytes[J].J Pharmacol Sci,2009,111(4):416-425.
[9]Asmara H,Minobe E,Saud ZA,et al.Interactions of calmodulin with the multiple binding sites of Cav1.2 Ca2+channels[J].J Pharmacol Sci,2010,112(4):397-404.
[10]Simms BA,Souza IA,Zamponi GW.A novel calmodulin site inthe Cav1.2 N-terminus regulates calcium-dependent inactivation[J].Pflugers Arch,2014,466(9):1793-1803.
[11]Wang WY,Hao LY,Minobe E,et al.CaMKII phosphorylates a threonine residue in the C-terminal tail of Cav1.2 Ca2+channel and modulates the interaction of the channel with calmodulin[J].J Physiol Sci,2009,59(4):283-290.
[12]Murphy JG,Sanderson JL,Gorski JA,et al.AKAP-anchored PKA maintains neuronal L-type calcium channel activity and NFAT transcriptional signaling[J].Cell Rep,2014,7(5):1577-1588.
[13]Fu Y,Westenbroek RE,Scheuer T,et al.Basal and beta-adrenergic regulation of the cardiac calcium channel CaV1.2 requires phosphorylation of serine 1700[J].Proc Natl Acad Sci USA,2014,111(46):16598-16603.
[14]Erxleben C,Liao Y,Gentile S,et al.Cyclosporin and Timothy syndrome increase mode 2 gating of CaV1.2 calcium channels through aberrant phosphorylation of S6 helices[J].Proc Natl Acad Sci USA,2006,103(10):3932-3937.
[15]Lee TS,Karl R,Moosmang S,et al.Calmodulin kinase II is involved in voltage-dependent facilitation of the L-type Cav1.2 calcium channel:Identification of the phosphorylation sites[J].J Biol Chem,2006,281(35):25560-25567.
(编辑 王又冬)
Plasmid Construction and Protein Expression of CT1 Fragment Mutants of Cav1.2 Channel
LEIMing1,ZHAOMei-mi1,FENG Rui1,WANGHong-mei1,MAONan1,ZHUTong2,HAOLi-ying1
(1.Department of Pharmaceutical Toxicology,School of Pharmacy,China Medical University,Shenyang 110122,China;2.Lab of Environment Biology and Engineering,Northeastern University,Shenyang 110004,China)
ObjectiveTo construct prokaryotic expression vectors of the CT1 fragment of Cav1.2 channel and its mutants for CT1-GST fusion protein expression and purification.MethodsTaking plasmid of pGEX-6p-3/CT1 as template,two mutational plasmids(CT1-T1603A and CT1-T1603D)with site directed mutagenesis were constructed.The plasmids were then transformed to E.coli BL21 competent cells,and the transformantswere induced with IPTG forthe expression ofGSTfusion proteins ofCT1 fragmentand its mutants.SDS-PAGE was performed to determine the relative molecular weight and purity.ResultsMutated bases corresponding to the target amino acid site were confirmed by cDNA sequence.High purity of GST-CT1 fusion protein and its mutants were successfully obtained.ConclusionProkaryotic expression vectors of CT1 fragment and its mutants were constructed,and the fusion proteins were successfully expressed were obtained.These results provided a basis for further studies of the function ofCT1 fragmentin the regulation for Cav1.2 channeland its mechanism.
fusion protein;CT1;mutant
R966
A
0258-4646(2015)09-0837-03
国家自然科学基金(31071004)
雷明(1984-),男,硕士研究生.
郝丽英,E-mail:lyhao@mail.cmu.edu.cn
2014-12-08
网络出版时间:

