豚鼠心肌组织Cav1.2钙通道蛋白的提取与纯化
封 瑞,于丽凤,胡慧媛,郭 凤,龟山正树,郝丽英
L型钙通道是电压依赖型钙通道,其由4个亚单位组成,分别为 α1、α2δ、β1-4和 γ,其中 α1亚单位决定了通道的大部分功能[1]。编码 α1亚单位蛋白的基因分别为 α1S、α1C、α1D和 α1F,对应命名为 Cav1.1、Cav1.2、Cav1.3、Cav1.4。L 型钙通道广泛存在于各种细胞中,特别是心肌和心血管平滑肌细胞中,心肌L型钙通道主要为Cav1.2钙通道。L型钙通道是细胞兴奋时外钙内流的最主要途径,其在许多生理和病理情况下起到非常重要的作用,例如在肌肉收缩、激素或神经递质分泌,以及在基因表达方面都具有关键作用[2]。
近年来,关于L型钙通道功能和结构的研究越来越深入,研究手段也越来越多,如应用电生理的方法检测L型钙通道电流的变化[3],采用共聚焦显微镜检测细胞内钙的变化间接反映L型钙通道的功能等。除此之外,分子生物学的方法也得到了广泛应用,例如采用免疫印迹的方法检测钙通道蛋白的表达情况[4],免疫共沉淀的方法检测钙通道蛋白与某些特定蛋白的结合作用情况[5],以及Pull-down assay的方法检测钙通道片段与某些蛋白的结合情况[6]。然而,研究者们发现L型钙通道蛋白作为细胞的膜蛋白,在提取和制备方面仍然存在一定困难。利用传统的提取总蛋白的方法获得的L型钙通道蛋白的量较少,且纯度不高,在需要增溶的钙通道蛋白的研究中,提取总蛋白的方法也无法满足进一步的实验,给深入的实验研究带来了不同程度的困难。小麦胚芽凝集素(wheat germ lectin-agarose,WGA)能与L型钙通道蛋白上的膜糖蛋白特异性结合,因此,本研究采用WGA亲和层析的方法制备与纯化豚鼠心肌Cav1.2钙通道蛋白,并用免疫印迹的方法对纯化的钙通道蛋白进行鉴定。以期寻找到制备与纯化全长的心肌Cav1.2钙通道蛋白的方法,为心肌Cav1.2钙通道蛋白的进一步研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 动物 豚鼠,♂♀不限,体质量300~400 g,由日本鹿儿岛大学实验动物中心提供。
1.1.2 主要试剂 胶原酶,日本Yakult公司;Protease inhibitor cocktail,Roche Diagnostics GmbH,德国;CHAPS,Sigma 公司;抗Cav1.2抗体,抗 N末端1-46氨基酸,Alomone Labs公司;抗Cav1.2抗体,抗C末端1507-1733氨基酸,Stress-Marq Biosciences Inc公司;小麦胚芽凝集素(WGA),日本Wako公司;ECL发光试剂盒,GE Health-care公司。
1.1.3 主要仪器设备 超高速离心机,日本佐久间制造所;小型动物呼吸机,日本SETA GAYA.KU公司;匀浆仪,日本IUCHI株式会社;Western blot电泳槽和转印槽,美国 Bio-Rad;凝胶自动成像仪,韩国DAHAN公司;图像分析系统,日本ALTO公司。
1.2 方法
1.2.1 豚鼠心室肌组织的制备 豚鼠,体质量300~400 g。1%戊巴比妥钠按100 mg·kg-1行腹腔注射麻醉,气管插管后,在人工呼吸机支持下开胸进行主动脉管插管,迅速取出心脏,将心脏离体并连接于Langendorff灌流装置上,37℃恒温及供氧条件下台氏液连续灌流约3 min,无钙台氏液灌流约6 min,用含0.05%胶原酶的无钙台氏液灌流至心室肌组织被消化;KB液灌流冲洗,剪碎心室肌组织,存于-80℃备用。
1.2.2 豚鼠心室肌Cav1.2钙通道蛋白的提取 豚鼠心室肌组织在蛋白裂解液中剪成小块,然后研磨法匀浆,匀浆后12 000 ×g 离心,20 min,取上清,45 000 r·min-1离心,1 h,沉淀用 Tris缓冲液(100 mmol·L-1Sucrose,20 mmol·L-1Tris-HCl,10 mmol·L-1EGTA,5 mmol·L-1EDTA)重悬,此悬浮液体与WGA孵育2 h,然后用Tris缓冲液洗两次,所有操作均在冰上进行。将提纯的 Cav1.2钙通道蛋白应用Bradford方法检测蛋白浓度。牛血清白蛋白作为标准品被用来做标准曲线。
1.2.3 SDS-PAGE凝胶电泳鉴定Cav1.2钙通道蛋白 制备浓度为5.8%的SDS-PAGE凝胶以备电泳。SDS-PAGE凝胶电泳分离制备的心肌Cav1.2钙通道蛋白,上样量为20μg,同时使用预染蛋白Marker,依据分子量对所制备的蛋白进行鉴定。
1.2.4 Western blot鉴定目的蛋白免疫原性 Cav1.2钙通道蛋白经5.8%的SDS-PAGE凝胶电泳,电泳后将蛋白转印于PVDF膜上,TBST洗膜后5%的BSA室温封闭1 h,分别采用不同的抗Cav1.2抗体4℃孵育过夜,辣根过氧化物酶标记的二抗室温孵育2 h,TBST洗膜,ECL试剂曝光、显影及定影,对胶片进行图像采集。将胶片图像输入图像分析系统,应用CS analyzer 3.0软件进行强度测定,结果以光密度值表示。
2 结果
2.1 不同表面活性剂对Cav1.2钙通道蛋白制备的影响
膜蛋白是通过疏水氨基酸残基锚定在膜结构中的,很难溶解在水性缓冲液中,因此,需要使用去污剂或表面活性剂以达到增溶的效果。用于增溶的去污剂有离子型和非离子型的,本研究选择了两种较为温和的非离子型去污剂CHAPS和Triton X-100,尝试制备心肌细胞膜Cav1.2钙通道蛋白。心肌组织经过匀浆离心后,上清再分别经过2%CHAPS和1%TritonX-100的处理,结果发现经过2%CHAPS处理的样本,上清中可能含有较多的Cav1.2钙通道蛋白,而1%Triton X-100处理过的上清并未分离得到Cav1.2钙通道蛋白(Fig 1)。因此,在制备心肌Cav1.2钙通道蛋白时本研究选择CHAPS作为增溶的去污剂。
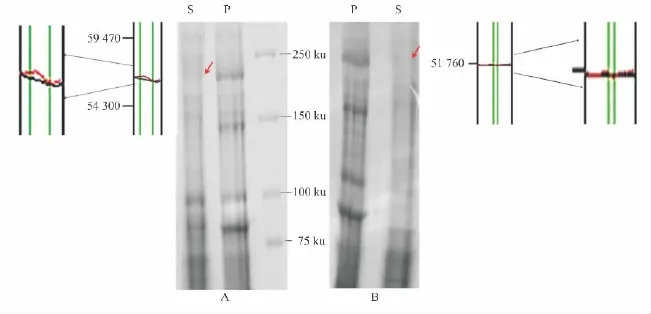
Fig 1 Soluble effect of Cav1.2 protein treated by CHAPS and Triton X-100 detergent
进一步实验使用了不同浓度的CHAPS观察了Cav1.2钙通道蛋白的增溶效果的不同。结果显示(Fig 2),不同浓度的CHAPS(2%、4%、6%)在钙通道蛋白的增溶效果上并没有明显差别。同时,有研究表明高浓度的去污剂可能会对蛋白结构产生影响,使蛋白质失去天然的构象。因此,后续研究采用了较低浓度的CHAPS(2%)制备心肌Cav1.2钙通道蛋白。
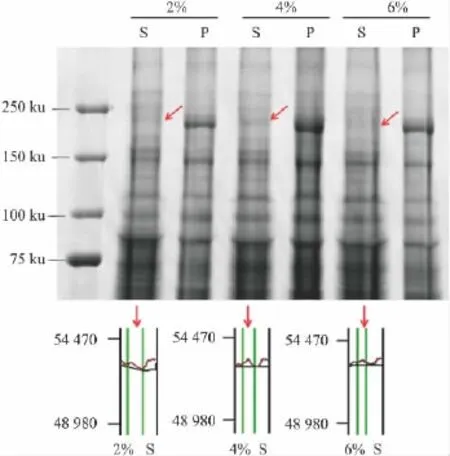
Fig 2 Soluble effect of Cav1.2 protein treatedby different concentrations of CHAPS(2%,4%,6%)
2.2 WGA亲和层析方法制备Cav1.2钙通道蛋白 除了选择合适的去垢剂,蛋白溶解液中的离子强度也是影响膜蛋白制备的重要因素。进一步实验将用于溶解蛋白的Tris缓冲液中加入了氯化钾(0.5 mol·L-1),以促使细胞膜更好的溶解破裂。WGA是能够特异结合Cav1.2钙通道蛋白上糖蛋白的凝集素,经氯化钾处理后的蛋白溶解液,应用WGA与蛋白溶解液孵育2 h后,经5.8%SDS-PAGE凝胶电泳分离蛋白,结果显示在分子质量约为220 ku处存在唯一蛋白条带(Fig 3)。Cav1.2钙通道蛋白分子质量约220 ku,我们认为本实验采用WGA制备的蛋白为心肌Cav1.2钙通道蛋白。2.3 Western blot鉴定Cav1.2钙通道蛋白 根据上述实验结果,为了更进一步鉴定所制备的蛋白为全长的心肌Cav1.2钙通道蛋白,本研究采用了Western blot的方法。使用两种不同的心肌Cav1.2钙通道蛋白的抗体对制备的蛋白进行鉴定,结果显示应用抗C末端(检测1507-1733氨基酸片段)的抗体可检测到心肌Cav1.2钙通道蛋白(Fig 4);应用抗N末端(检测1-46氨基酸片段)的抗体同样也可检测到心肌Cav1.2钙通道蛋白(Fig 4),此实验结果表明,我们成功制备纯化了全长心肌Cav1.2钙通道蛋白,且此蛋白纯度较高。

Fig 3 Cardiac Cav1.2 channel protein was separated by 5.8%SDS-PAGE gel
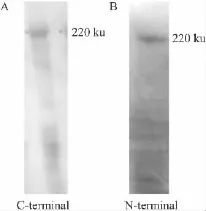
Fig 4 The Cav1.2 channel protein identified by Western blot
3 讨论
心肌L型钙通道(Cav1.2钙通道)是心肌细胞兴奋时外钙内流的主要途径,研究表明[7-9],心肌L型钙通道与许多心血管系统疾病密切相关,如心肌L型钙通道与心律失常、心肌肥大、心力衰竭等有关。关于心肌L型钙通道的研究非常广泛,研究方法也很多,由于实验目的不同,采用的方法也不同。例如采用电生理的方法对心肌L型钙通道的功能进行研究[10-11],应用共聚焦显微镜可测定单个心肌细胞内钙离子浓度,Western blot的方法是检测钙通道蛋白比较常用的方法等。然而本研究采用亲和层析的方法提取制备了纯度较高的心肌全长Cav1.2钙通道蛋白,为系统研究钙通道奠定了坚实的基础。
蛋白质与蛋白质之间相互作用是细胞生化反应的重要组成部分,对调控细胞信号具有重要意义。目前,研究蛋白质与蛋白质相互作用的方法有很多,如酵母双杂交、免疫共沉淀以及pull-down技术等。研究发现很多蛋白质可与心肌Cav1.2钙通道结合,并且多采用制备不同标签的融合蛋白的方法来获得Cav1.2钙通道的不同片段,应用Cav1.2钙通道的不同片段进行进一步的蛋白与蛋白结合实验的研究[6,12]。这种方法在研究全长Cav1.2钙通道蛋白与其他蛋白结合实验中存在缺点,由于Cav1.2钙通道蛋白的分子质量约为220 ku,而采用不同标签的融合蛋白制备方法很难获得分子质量很大的蛋白,因此,本研究探索制备了全长的Cav1.2钙通道蛋白,为检测某些蛋白与全长钙通道蛋白结合研究提供了方便,也为应用全长的Cav1.2钙通道蛋白进行相关的实验研究提供新的方法。
亲和层析法制备全长的心肌Cav1.2钙通道蛋白,是体外系统研究钙通道蛋白的前提和基础。研究表明[13-15],很多细胞内因子可与钙通道直接结合,如钙离子、钙调蛋白以及钙调蛋白抑素等,它们在钙通道上的结合位点是目前研究的热点,在某些疾病状态下,这些细胞因子与钙通道的结合可能会发生改变,通过制备全长钙通道蛋白可为寻找这些细胞内因子在钙通道上的结合位点奠定基础。因此,对钙通道蛋白纯化方法的研究不仅对钙通道在蛋白水平的研究具有很大的促进作用,也为与钙通道相关的心血管系统疾病的研究拓宽了思路。
[1] Zühlke R D,Reuter H.Ca2+-sensitive inactivation of L-type Ca2+channels depends on multiple cytoplasmic amino acid sequences of the α1C subunit[J].Proc Natl Acad Sci USA,1998,95(6):3287-94.
[2] Berridge M J.Elementary and global aspects of calcium signalling[J].J Exp Biol,1997,200(Pt2):315 -9.
[3] Xu J J,Hao L Y,Kameyama A,et al.Calmodulin reverses rundown of L-type Ca2+channels in guinea pig ventricular myocytes[J].Am J Physiol Cell Physiol,2004,287(6):C1717 -24.
[4] Yang L,Katchman A,Morrow J P,et al.Cardiac L-type calcium channel(Cav1.2)associates with γ subunits[J].FASEB J,2011,25(3):928-36.
[5] Gui P,Wu X,Ling S,et al.Integrin receptor activation triggers converging regulation of Cav1.2 calcium channels by c-Src and protein kinase A pathways[J].J Biol Chem,2006,281(20):14015-25.
[6] Asmara H,Minobe E,Saud Z A,et al.Interactions of calmodulin with the multiple binding sites of Cav1.2 Ca2+channels[J].J Pharmacol Sci,2010,112(4):397 -404.
[7] Bers D M.Altered cardiac myocyte Ca regulation in heart failure[J].Physiol,2006,21:380 -7.
[8] Song L S,Pi Y,Kim S J,et al.Paradoxical cellular Ca2+signaling in severe but compensated canine left ventricular hypertrophy[J].Circ Res,2005,97(5):457 -64.
[9] Wang S Q,Stern M D,Ríos E,et al.The quantal nature of Ca2+sparks and in situ operation of the ryanodine receptor array in cardiac cells[J].Proc Natl Acad Sci USA,2004,101(11):3979 -84.
[10]刘妍妍,白云龙,王 涛,杜 娟.白藜芦醇对豚鼠心室肌细胞L型钙通道的影响[J].中国药理学通报,2007,23(2):181-4.
[10] Liu Y Y,Bai Y L,Wang T,Du J.Effects of resveratrol on L-type calcium current(ICa-L)in guinea pig ventricular myocytes[J].Chin Pharmacol Bull,2007,23(2):181 -4.
[11]吴 辉,李立环,陈 雷,黄爱杰.心肌肽素对豚鼠心室肌细胞L型钙通道的影响[J].中国药理学通报,2006,22(5):611-5.
[11] Wu H,Li L H,Chen L,Huang A J.Effects of cardiomyopeptidin on L-type calcium channels in ventricularmyocytes of guinea pigs[J].Chin Pharmacol Bull,2006,22(5):611 -5.
[12] Minobe E,Asmara H,Saud Z A,et al.Calpastatin domain L is a partial agonist of the calmodulin-binding site for channel activation in Cav1.2 Ca2+channels[J].J Biol Chem,2011,286(45):39013-22.
[13] Isaev D,Solt K,Gurtovaya O,et al.Modulation of the voltage sensor of L-type Ca2+channels by intracellular Ca2+[J].J Gen Physiol,2004,123(5):555 -71.
[14] Xiong L,Kleerekoper Q K,He R,et al.Sites on calmodulin that interact with the C-terminal tail of CaV1.2 channel[J].J Biol Chem,2005,280(8):7070-9.
[15] Saud Z A,Minobe E,Wang W Y,et al.Calpastatin binds to a calmodulin-binding site of cardiac Cav1.2 Ca2+channels[J].Biochem Biophys Res Commun,2007,364(2):372-7.

