染料木素对人宫颈癌细胞株HeLa增殖的影响
郑秋玲,聂少平,李文娟,胡晓娟,谢明勇
染料木素(genistein,Gen),又称为金雀异黄酮、染料木黄铜,是异黄酮的主要成分,其性质稳定,且毒副作用小,是一种已被广泛认知的、最为常见的且活性最为显著的植物雌激素之一[1]。其结构与人体内源性雌激素相似,并可竞争与雌激素受体(estrogen receptor,ER)结合,从而能够发挥抗雌激素作用以及类雌激素作用[2]。近年来,因植物雌激素毒副作用小,且食源含量高,越来越引起人们的关注与重视。研究证实,植物雌激素具有抗癌、抗氧化、抑制骨质疏松等积极治疗作用[3-5]。流行病学调查研究表明,东方国家因其饮食习惯中豆类食物丰富,其乳腺癌、前列腺癌以及心血管疾病等患病率明显低于西方国家[6]。在人们大力提倡摄入植物雌激素的同时,有关植物雌激素安全性的问题也逐渐引起了大家的重视。然而,因各地区种族差异性以及各研究团队研究方法的不一致性,其结果一直具有争议性。
宫颈癌是全球妇女中仅次于乳腺癌的恶性肿瘤,是最常见的女性生殖道恶性肿瘤之一,且发病率有持续上升的趋势[7]。然而,有关宫颈癌的研究却较少,远不及对乳腺癌的研究。研究表明,宫颈癌发生、发展与体内雌激素水平密切相关[8],但具体作用机制及与食源性植物雌激素的关系不详。本实验试图探讨染料木素对宫颈癌细胞增殖的影响,以期为染料木素对宫颈癌的影响及作用机制提供进一步的实验基础以及理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞及试剂 人宫颈癌细胞系(HeLa),购买自美国ATCC;Gen,纯度99%以上,溶于DMSO,配制成母液、雌二醇(E2),美国Sigma公司;兔抗人ERα,美国Abcam公司;活性炭处理过的胎牛血清(CDT-FBS),美国Hyclone公司;DMEM培养基,美国Gibco公司;四甲基偶氮唑蓝溶液(MTT),中国索莱宝公司;细胞周期检测试剂盒,中国碧云天公司;细胞凋亡检测试剂盒,中国凯基生物公司。
1.1.2 仪器与设备 流式细胞仪,美国BD公司;3K15-高速冷冻离心机,美国Sigma公司;凝胶成像仪,美国Bio-Rad公司;HH-4数显恒温水浴锅,中国深圳国华电器有限公司;METTLER TOLEDO AL104电子天平,梅特勒-托利多仪器(上海)有限公司;垂直电泳仪,美国Bio-Rad公司;CO2培养箱、E-330酶标仪,美国Thermo公司;超净工作台,中国吴江市净化设备总厂;倒置显微镜,日本Olympus公司。
1.2 方法
1.2.1 细胞培养 贴壁生长HeLa细胞用无酚红含10%CDT-FBS的DMEM高糖培养基在37℃,体积分数5%CO2的条件下培养,待细胞状态良好,传代或进行实验处理。传代时弃原培养液,以PBS洗涤1-2次,然后加入0.25%胰酶消化细胞,离心(1 000 r·min-1,5 min),加入新培养液重悬,接种于新培养瓶。
1.2.2 实验分组 MTT检测,对照组:等体积的DMSO(体积含量比为0.1%);雌二醇阳性对照组(E2):0.01 μmol·L-1E2;Gen 组:0.001、0.01、0.1、1、10 μmol·L-1染料木素处理细胞。药物刺激48、72 h后检测。细胞周期、细胞凋亡检测的分组同上,药物刺激48 h后检测。Western blot检测ERα表达,对照组:等体积的DMSO(体积含量比为0.1%);Gen 组:用 0.1 μmol·L-1Gen 刺激 HeLa细胞 3、6、12、24 h。
1.2.3 MTT法检测细胞生长 用传代的方法将细胞制成1×107·L-1的细胞悬液接种于96孔板内,每孔200 μl,置于含5%CO2的37℃培养箱中培养24 h。加药,每个浓度设6个复孔,培养48、96 h后,每孔加入20 μl的 MTT(5 g·L-1),继续孵育4 h 后取出96孔板,将液体弃净,每孔加入150 μl DMSO溶液,振荡10 min后检测其在490 nm处的吸光值,计算平均OD值及增殖率(PR):PR/%=(实验组OD值/对照组OD值)×100%
1.2.4 流式细胞术检测细胞周期变化 用0.25%的胰酶消化、收集细胞,制成5×108·L-1浓度的细胞悬液,接种于6孔板,置于培养箱中孵育24 h后加药,加药48 h后收集细胞。收集的细胞用PBS洗涤两次,每次1 000 r·min-1离心5 min。弃上清,加入PBS混匀细胞,再加入无水乙醇,使乙醇的体积分数为0.75,固定24 h(4℃)后弃去固定液,PBS洗涤细胞后加入100 μl RNase,水浴37℃孵育30 min,最后加入 400 μl Propidium Iodide(PI)染液,水浴37℃孵育30 min。应用流式细胞仪测定细胞周期变化。
1.2.5 流式细胞术检测细胞凋亡 收集HeLa细胞,制成单细胞悬液接种于6孔板,置于培养箱孵育24 h后加药,48 h后收集细胞。用PBS洗涤两次,每次离心 5 min(1 000 r·min-1)。加入 500 μl缓冲液悬浮细胞,加入 Annexin V-FITC、PI各 5 μl,混匀,室温、避光反应5 min,1 h内检测细胞凋亡变化。
1.2.6 Western blot方法检测ERα蛋白表达 根据MTT检测细胞生长的数据,采用对HeLa细胞增殖作用较为明显的染料木素浓度(0.1 μmol·L-1)刺激HeLa细胞,分别作用3、6、12及24 h后收集细胞,提取核蛋白。根据目标蛋白分子(ERα蛋白和β-actin)量配制10%SDS-PAGE凝胶,根据蛋白浓度,调整上样量一致后进行电泳。常规进行转膜操作,牛血清白蛋白(BSA)37℃封闭1 h。ERα抗体按1∶1 000稀释,于4℃过夜,洗脱后二抗孵育,轻摇1 h,洗脱后ECL显色,凝胶成像分析系统成像检测分析(以β-actin作为内参)。
2 结果
2.1 培养人宫颈癌HeLa细胞的一般特性 在倒置显微镜下观察,HeLa细胞贴壁生长,排列紧密,细胞体积较大,细胞为梭形或扁平多边形,边界清晰,胞质丰富。见Fig 1。
Fig 1 Features of HeLa cells
2.2 MTT结果 Gen对HeLa细胞生长的作用如Fig 2所示。实验浓度的 Gen(0.001~10 μmol·L-1)均促进了HeLa细胞的生长,且随着作用时间的增加作用效果更加明显。浓度为0.1 μmol·L-1的Gen作用72 h后增殖效果最明显,OD值为(1.992±0.055),与对照组的(1.247±0.086)相比,差异具有显著性(P<0.05),且增殖作用大于阳性对照组E2组(OD值=1.827±0.034)。
2.3 染料木素对HeLa细胞周期的影响 由流式检测结果Fig 3可知,在Gen的作用下,HeLa细胞S期细胞比例有所增加,G1期比例降低,并且在0.01 μmol·L-1的Gen的作用下,细胞周期的变化最明显,S期比例由(24.68±4.38)%增加到(38.84±3.80)%,其效果较E2更为明显。见Tab 1。
2.4 染料木素对HeLa细胞凋亡的影响 经Gen刺激48 h后,HeLa细胞凋亡率明显下降。与对照组相比(凋亡率为24.37±0.78),Gen在0.1 μmol·L-1浓度下作用效果最为明显(凋亡率为8.77±1.23),其效果较E2更为明显(凋亡率为11.29±2.92)。见Tab 2。
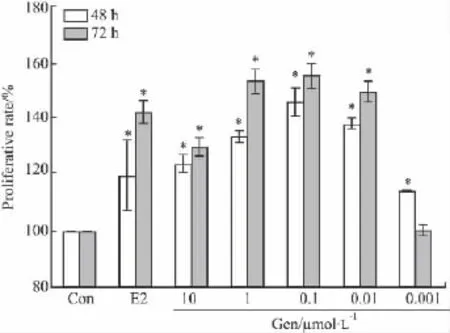
Fig 2 Effect of Gen on proliferation of HeLa cells

Fig 3 Effect of Gen on cell cycle of HeLa cells
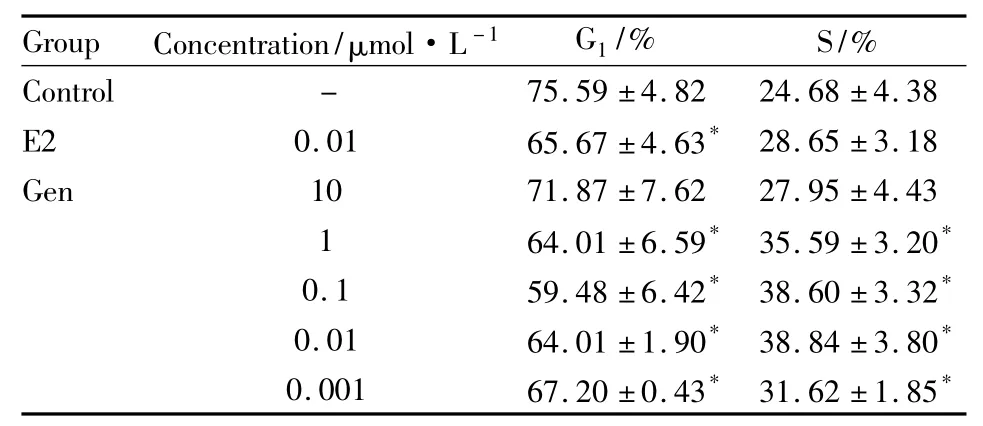
Tab 1 Effect of Gen on cell cycle of HeLa cells

Tab 2 Effect of Gen on apoptosis of HeLa cells
2.5 染料木素对HeLa细胞ERα表达的影响 研究表明,雌激素可通过调节雌激素受体,进而影响细胞增殖[9]。因此,本研究进一步检测Gen对雌激素受体ERα的影响。如Fig 4所示,与对照组相比,Gen刺激6 h后,HeLa细胞中ERα表达量明显上调,在24 h后与对照组差异无显著性。

Fig 4 Effect of Gen on ERα expression in HeLa cells
3 讨论
目前,研究显示植物雌激素对宫颈癌的增殖具有抑制作用[10],但多是研究其在高浓度下(一般大于10 μmol·L-1)的作用。然而,摄入的食源性植物雌激素的浓度是否能达到该浓度仍有待考察,且因不同地区饮食习惯的不同,摄入的植物雌激素浓度高低不同。因此,除考察其高浓度作用效果外,探讨植物雌激素在低浓度下对宫颈癌增殖作用的影响具有重要的意义。研究表明,植物雌激素在低浓度下能够发挥类雌激素作用[11],因此,本实验以人宫颈癌HeLa细胞为研究对象,应用低剂量植物雌激素Gen,选取内源性雌激素E2作为阳性对照,考察Gen对宫颈癌的影响。MTT实验结果表明,实验浓度的染料木素(0.001 ~10 μmol·L-1)都能够对HeLa细胞的增殖起到促进作用,该作用结果与E2相一致。
众所周知,为保持细胞的正常运行,细胞内部有着精密的调控机制。细胞周期是生命活动中的一个非常重要的过程,具有非常复杂和精细的调节机制及过程,对它的研究是现代生命科学研究的一个重要内容。细胞周期分为间期和有丝分裂期,细胞间期又分为休眠期(G0)、DNA合成前期(G1)、DNA合成期(S)以及DNA合成后期(G2)。下一阶段的开始依赖于前一阶段的完成,而各个阶段之间的衔接依赖于很多调控因子。肿瘤的发生、发展与细胞周期发生紊乱从而导致细胞失控性生长有关[12]。用Gen刺激HeLa细胞48 h后,流式细胞仪检测细胞周期,结果表明,与对照组相比,实验组S期细胞比例有所增加,G1期细胞比例有所下降,表明Gen可能通过对细胞周期的调控从而达到促进HeLa细胞增殖的作用。
细胞凋亡是细胞在外界环境的影响下为了更好的适应环境在一系列基因的调控下主动有序死亡的过程,凋亡与肿瘤的发生发展也有着密切的关系[13]。本实验中,与细胞周期的Gen作用时间相对应,用Gen作用HeLa细胞48 h后用流式细胞仪检测细胞凋亡率的变化。结果显示,与对照组相比,实验各组的凋亡率均明显降低,表明Gen也可能通过对细胞凋亡的抑制进而影响细胞增殖。
ERα是被广泛认知的一种雌激素受体,广泛分布于人体各组织中,能够与内源性及外源性雌激素表现出相似的结合特性。在无雌激素存在的情况下,ERα以抑制性复合体形式存在,而雌激素与ERα结合后则能够与靶基因上的雌激素反应元件结合,激活靶基因,在无雌激素反应元件基因的细胞中,ERα也能够通过调节一些转录因子的活性调节靶基因的表达,ER在体内参与的信号通路复杂,对靶基因的调节依赖于不同的细胞类型。在一些生殖器官癌细胞中如乳腺癌MCF-7细胞以及卵巢癌细胞中都检测到了ERα的高表达[14],因此,对宫颈癌细胞中ERα的表达及其作用的研究有着至关重要的作用。本实验结果表明,在宫颈癌细胞中也同样发现了ERα高表达的现象。
综上所述,Gen可能通过上调ERα的表达量,激活一系列调控细胞周期及细胞凋亡的基因表达,从而促进了HeLa细胞的增殖。然而,Gen在细胞内参与的信号转导通路及其相互间的作用方式仍有待进一步的实验探究。
[1] 沈国栋,王 弦,吴 强,等.染料木素抑制HER2阳性人乳腺癌与卵巢癌细胞增殖作用的研究[J].中国临床保健杂志,2012,15(5):517 -9.
[1] Shen G D,Wang X,Wu Q,et al.The effect of genistein in inhibiting cell proliferation of human HER2-positive breast and ovarian cancer[J].Chin J Clin Healthc,2012,15(5):517 - 9.
[2] 沈丽霞,赵丕文,牛建昭,王继峰.金雀异黄素和槲皮素对人类乳腺癌细胞增殖和细胞周期的影响[J].中国药理学通报,2008,24(1):59 -62.
[2] Shen L X,Zhao P W,Niu J Z,Wang J F.Effect of genistein and quercetin on proliferation and cell cycle in human breast carcinoma cells[J].Chin Pharmacol Bull,2008,24(1):59 - 62.
[3] Tantikanlayaporn D,Robinson L J,Suksamrar A,et al.A diarylheptanoid phytoestrogen from Curcuma comosa,1,7-diphenyl-4,6-heptadien-3-ol,accelerates human osteoblast proliferation and differentiation[J].Phytomedicine,2013,20(8 -9):676 -82.
[4] 翟远坤,陈克明,葛宝丰,等.淫羊藿次苷Ⅱ通过激活雌激素信号通路促进骨髓间充质干细胞的成骨性分化[J].中国药理学通报,2011,27(10):1451 -7.
[4] Qu Y K,Chen K M,Ge B F,et al.Promotion of the osteogenic differentiation of rat bone marrow stromal cells via estrogen signal pathway by icariside Ⅱ[J].Chin Pharmacol Bull,2011,27(10):1451-7.
[5] 牛银波,李宇华,黄海涛,等.染料木素促成骨样细胞增殖作用及其机制研究[J].中国药理学通报,2010,26(10):1309-12.
[5] Niu Y B,Li Y H,Huang H T,et al.Effect and mechanism of genistein on the proliferation of MC3T3-E1 cells[J].Chin Pharmacol Bull,2010,26(10):1309 -12.
[6] Ruth Swann,Perkins K A,Velentzis L S,et al.The DietCompLyf study:A prospective cohort study of breast cancer survival and phytoestrogen consumption[J].Maturitas,2013,75(3):232 -40.
[7] 陈 娇,张 蔚,敖良飞,等.槲皮素对宫颈癌 HeLa细胞STAT3的表达及其信号通路的影响[J].中华临床医师杂志,2011,5(19):5656 -60.
[7] Chen J,Zhang W,Ao L F,et al.Effect of quercetin on the expression of STAT3 and its signal pathway in HeLa cells[J].Chin J Clin,2011,5(19):5656 -60.
[8] George G Ghen,Qiang Zeng,Gary MK Tse.Estrogen and its receptors in cancer[J].Med Res Reviews,2008,28(6):956 - 74.
[9] 方 勤.ERα、ERβ的研究进展[J].国外医学·妇产科学分册,2000,27(4):210-3.
[9] Fang Q.Reserch of ERα and ERβ[J].Fore Med Sci·Obst Gyneco Fasc,2000,27(4):210 -3.
[10] Federico Dajas.Life or death:Neuroprotective and anticancer effects of quercetin[J].J Ethnopharmacol,2012,143(2):383 -96.
[11]黄桂香,赵君丽,杨 军,等.植物雌激素的应用及研究进展[J].内蒙古医学杂志,2005,37(1):26 -8.
[11] Huang G X,Zhao J L,Yang J,et al.Application and new progress of phyoto-estrogen[J].Inner Mongolia Med J,2005,37(1):26 -8.
[12] Chang K L,Kung M L,Chow N H,Su S J.Genistein arrests hepatoma cells at G2/M phase:involvement of ATM activation and upregulation of p21waf1/cip1 and Wee1[J].Biochem Pharmacol,2004,67(4):717 -26.
[13]魏华波,海 蓉,王振华.植物雌激素抗肿瘤作用机制研究进展[J].食品科学,2011,32(1):274-7.
[13] Wei H P,Hai R,Wang Z H.Research progress on anti-carcinogenic mechanism of phytoestrogens[J].Food Sci,2011,32(1):274-7.
[14]郑温雅,聂少平,李文娟,等.香豆雌酚对乳腺癌细胞株MCF-7增殖的影响[J].中国药理学通报,2012,28(10):1477-9.
[14] Zheng W Y,Niu S P,Li W J,et al.Effect of coumestrol on cell proliferation of human breast cancer cell line MCF-7[J].Chin Pharmacol Bull,2012,28(10):1477 -9.

