人肝微粒体中CYP2B6对氯胺酮代谢的催化作用
赵芸慧,王晓龙,田阿勇,马 虹,王俊科
(中国医科大学附属第一医院麻醉科,辽宁沈阳 110001)
氯胺酮是临床常用静脉麻醉药,特别是广泛用于小儿短小手术的麻醉和术前基础麻醉。已知氯胺酮进入体内之后,大部分经肝脏细胞色素P450代谢,形成去甲氯胺酮。有必要进一步研究氯胺酮的代谢机制和影响其代谢的遗传机制。
1 材料与方法
1.1 一般资料 本研究进行人体组织实验已获得中国医科大学伦理委员会的批准。20例人体肝脏组织来自中国医科大学附属第一医院普外科肝血管瘤或者肝癌行肝脏部分切除手术,患者(8男,12女)的平均年龄为(49±12)岁,并已排除急慢性肝炎、肝硬化和长期吸烟酗酒史病例。取直径为1~2 cm的正常肝脏组织(经病理形态学证实),10 min内液氮冰冻,-70℃冰箱保存备用。肝脏微粒体通过差速离心法制备,所有试剂及器械均需冰盒内预冷。
1.2 孵育条件 同参考文献[1]。
1.3 样品处理 加入10 μl内标布比卡因混匀,加入750 μl乙腈沉淀蛋白,振荡混匀,10 800×g离心10 min,取上清50 μl进样。采用高效液相色谱法(HPLC)测定各时点氯胺酮的浓度。与CYP2B6的特异底物丁氨苯丙酮和抑制剂奥芬那君作相关分析。荧光检测波长为211 nm,流速1 ml·min-1,流动相:乙腈 ∶0.025 mol·L-1KH2PO4∶三乙胺(40 ∶60 ∶0.02)。
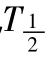
1.5 抑制性研究 应用CYP2B6特异性抑制剂奥芬那君对微粒体中氯胺酮的代谢进行抑制性研究。这些抑制剂溶解在甲醇溶液当中,在孵育反应开始前,10 μmol·L-1奥芬那君 20 μl分别与400 mg·L-1肝微粒体和 0.05 mmol·L-1氯胺酮在磷酸缓冲液当中预孵育3 min,反应从加入NADPH(1 mmol·L-1)工作液开始持续60 min,其余步骤同前述。
2 结果
20例人肝脏微粒体中氯胺酮的代谢速率相差最大约1倍,平均为(9.7 ±2.4)μmol·min-1·g-1protein。该速率与CYP2B6活性探针丁氨苯丙酮代谢速率呈正相关(r=0.897,P<0.01)。加入特异性抑制剂组,氯胺酮的平均代谢速率都明显低于正常孵育对照组(P<0.01),为(5.1±1.3)μmol·min-1·g-1protein,抑制率为 47.5%。
3 讨论
实验结果表明氯胺酮在微粒体孵育液的代谢速率和CYP2B6的活性探针丁氨苯丙酮的代谢速率呈相关性;CYP2B6酶活性特异性抑制剂奥芬那君对氯胺酮在微粒体孵育液的代谢速率有明显的抑制作用;CYP2B6对氯胺酮的代谢具有催化作用;适用于药物体外代谢速率的研究。
在人类P450家庭中,主要有3族(CYP1、CYP2、CPY3)19种同工酶参与外来化学物的代谢[2]。CYP1,2,3家族约占肝P450总含量的70%,并负责大多数药物的代谢。已知CYP3A4、CYP2B6、CYP2C9三种酶在肝微粒体中均具有较高活性[3-4],并且可能都参与了氯胺酮的体内代谢[1,5-7]。遗传多态性、酶抑制、酶诱导及生理因素均可引起细胞色素P450活性的改变,这有一定的临床意义。因为这会引起药物药代动力学的改变,导致药物效能改变,因代谢减少或毒性代谢物生成增多而增加药物毒性,以及导致药物的相互作用。究竟有几种P450酶参与氯胺酮的代谢和哪一种酶起到决定性作用目前还没有定论,本文可能为主要由CYP2B6催化的异质化合物的代谢提供重要依据,还有待广大学者作进一步深入的研究。
[1] 赵芸慧,田阿勇,马 虹,等.人肝微粒体中CYP3A4对氯胺酮代谢的催化作用[J].中国药理学通报,2012,28(7):986 -7.
[1] Zhao Y H,Tian A Y,Ma H,et al.Contribution of CYP3A4 to catalysis of ketamine in human hepatic microsome[J].Chin Pharmacol Bull,2012,28(7):986 - 7.
[2] 贺全仁.人类细胞色素P450同工酶与药物代谢[J].中国临床药理学与治疗学杂志,1997,2(4):307-10.
[2] He Q R.Human cytochromes P450 isozyme and drug metabolism[J].Chin J Clin Pharmacol Ther,1997,2(4):307 -10.
[3] Ekins S,Wrighton S A.The role of CYP2B6 in human xenobiotic metabolism[J].Drug Metab Rev,1999,31:719 -54.
[4] 周宏灏.遗传药理学[M].北京:科学出版社,2001:87.
[4] Zhou H H.Pharmacogenetics[M].Beijing:Science Press,2001:87.
[5] Yanagihara Y,Kariya S, Ohtani M, et al. Involvement of CYP2B6 in N-demethylation of ketamine in human liver microsomes[J].Drug Metab Dispos,2001,29:887 -90.
[6] Hijazi Y,Boulieu R.Contribution of CYP3A4,CYP2C9,and CYP2C9 isoforms to N-demethylation of ketamine in human liver microsomes[J].Drug Metab Dispos,2002;30:853 -8.
[7] Mössner L D,Schmitz A,Theurillat R,et al.Inhibition of cytochrome P450 enzymes involved in ketamine metabolism by use of liver microsomes and specific cytochrome P450 enzymes from horses,dogs,and humans[J].Am J Vet Res,2011,72(11):1505 -13.

