后循环缺血性卒中与认知障碍相关性研究
阮 婕,计仁杰,魏 果,周 琼,沈和平,孟繁霞,袁怀武,罗本燕
在卒中致残症状中,认知障碍的发生率可达40.7%[1]。目前后循环卒中引起的认知障碍临床上较常见,James等[2]发现后循环卒中后患者认知功能呈恶化趋势。Pedro等[3]报道10例双侧丘脑缺血性卒中患者存在记忆、计算、执行等多项认知障碍。然而既往研究中很少将幕下脑组织,如延髓、脑桥、中脑、小脑纳入研究范围内,而临床研究中发现脑干、小脑等病变往往也能引起执行功能障碍等认知障碍[4]。
因此本课题组假设急性期后循环缺血性卒中,包括幕下卒中,与认知障碍发生可能存在相关性。
1 对象与方法
1.1 研究对象 连续纳入2013年11月至2014年11月浙江大学医学院附属第一医院神经内科及嘉兴市第二医院神经内科收治的急性后循环缺血性卒中患者67例(包括首发和复发卒中患者),本研究经浙江大学医学院附属第一医院伦理委员会批准,所有入组患者或其法定监护人均已签署知情同意书。
1.2 入组标准 所有患者根据以下标准进行入组:①年龄≥18岁;②根据世界卫生组织定义的卒中定义[5],临床诊断为卒中,即突发的局灶性或全面性神经功能缺损的临床征象,并且神经功能缺损的临床征象持续时间超过24小时,排除其他非血管性原因(如原发性脑肿瘤、脑转移瘤、硬膜下血肿、癫痫发作后麻痹、脑外伤、抑郁等精神因素、颅脑感染等)造成的脑功能障碍,同时经头颅磁共振成像证实为急性缺血性卒中;③排除前循环卒中患者;④起病时间≤14天。
1.3 排除标准 ①因各种症状(包括语言障碍)无法完成检查者;②既往有认知障碍病史;③拒绝签署知情同意书。
1.4 入院时基线资料 入院时完整记录患者以下资料:①人口学特征,包括年龄、性别、受教育程度等;②血管危险因素:高血压[6],糖尿病[7],高脂血症[8],脑血管病史[5],心血管病史[9],吸烟史,饮酒史,体重指数(body mass index,BMI);③临床资料:头颅磁共振成像,扫描序列包括T1加权像,T2加权像,弥散加权像(b=0,1000 s/mm2)明确病变部位,美国国立卫生院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评估卒中后神经系统功能缺损情况、汉密尔顿抑郁量表(Hamilton Depression Rating Scale,HAMD)评估抑郁状态。
1.5 量表评估 ①两家中心的认知评估者经我院专业神经心理评估师专业培训1月后应用以下认知量表评估所有患者认知功能,量表包括简易精神状态量表(Mini-Mental State Examination,MMSE),阿尔兹海默病评定量表认知分量表(Alzheimer’s Disease Assessment Scale-cognitive subscale,ADAS-cog),临床痴呆量表(Clinical Dementia Rating scale,CDR);②根据患者磁共振成像结果,统计后循环梗死部位。部位主要包括:中脑、脑桥、延髓、小脑、颞枕叶、丘脑。
1.6 诊断标准 结合患者认知量表评定结果并根据以下认知功能诊断标准,将患者分为3组:认知功能正常组(N),血管性轻度认知功能障碍组(mild cognitive impairment,MCI),血管性痴呆组(vascular dementia,VD)。①根据美国心脏协会/美国卒中协会(American Heart Association/American Stroke Association,AHA/ASA)血管性轻度认知功能障碍诊断标准[10],本研究将诊断为“很可能”的患者归入血管性轻度认知功能障碍组;②根据美国国立神经疾病与卒中研究所和瑞士神经科学研究国际协会(National Institute of Neurological Disorders and Stroke and Association Internationale pour la Recherche et 1’Enseignement en Neurosciences,NINDS-AIREN)血管性痴呆诊断标准[10],本研究将诊断为“很可能”的患者归入血管性痴呆组。
1.7 统计学方法 本研究中采用SPSS 19.0软件进行数据处理和统计分析,计量资料符合正态分布采用()表示,组间比较采用采用t检验或方差分析;非正态分布计量资料用中位数和四分位数间距表示,组间比较采用秩和检验。计数资料用频数或百分数表示,组间比较采用方差分析;相关性分析时,先采用卡方检验进行单因素分析,对于单因素检验结果P<0.05的项目再采用logistic回归模型进行多因素分析。模型1校正年龄、性别因素,模型2校正年龄、性别及HAMD评分;P<0.05表示差异有显著性。
2 结果
2.1 一般资料 67例急性后循环缺血性卒中患者中男性47例(70.1%),平均年龄(62.85±9.03)岁,女性20例(29.9%),平均年龄(61.89±12.32)岁。
2.2 基线变量均衡性检验 认知功能正常组患者32例(47.8%)、轻度认知障碍组患者20例(29.9%),血管性痴呆组患者15例(22.4%)。组间基线特征比较发现,性别、吸烟、HAMD评分组间差异有显著性(P<0.05);高血压、糖尿病、高脂血症、既往卒中史、饮酒史、年龄、受教育年限、体重指数、NIHSS评分组间差异无显著性(P>0.05);血管性轻度认知障碍组及血管性痴呆组与认知正常组基线变量比较发现,前两组男性比例低,有吸烟史的患者少,但HAMD评分更高(表1)。
2.3 后循环梗死部位及分布情况 根据MRI结果,三组梗死部位分布如下:认知功能正常组中,脑桥梗死最多13例(40.6%);其次为丘脑梗死9例(28.1%),颞枕叶梗死5例(15.6%),中脑梗死2例(6.3%),延髓梗死2例(6.3%),小脑梗死1例(3.1%);轻度认知功能障碍组中,颞枕叶梗死最多11例(55%),其次脑桥梗死4例(20%),延髓梗死2例(10%),小脑梗死2例(10%),丘脑梗死1例(5%);血管性痴呆组中,小脑、丘脑、颞枕叶梗死例数相似,分别为4例(26.7%)、4例(26.7%)、5例(33.3%),其次脑桥梗死2例(13.3%);在所有认知障碍患者中,颞枕叶梗死最多16例(45.7%),其次为脑桥、丘脑、小脑梗死,分别为6例(17.1%)、5例(14.3%)、6例(17.1%),延髓梗死2例(5.7%)(图1)。
2.4 后循环梗死与认知障碍相关性 在单因素分析中,颞枕叶梗死患者发生认知障碍风险比非颞枕叶梗死高3.1倍(OR 4.10,95%CI 1.35~12.39﹚,脑桥梗死患者发生认知障碍风险低于非脑桥梗死70%(OR 0.30,95%CI 0.10~0.93);颞枕叶梗死患者发生轻度认知障碍风险比非颞枕叶梗死增高4.3倍(OR 5.30,95%CI 1.52~18.50﹚;小脑梗死患者发生血管性痴呆风险比非小脑梗死增高10.3倍(OR 11.27,95%CI 1.13~112.07﹚(表2)。
将单因素分析结果中差异具有显著性的梗死部位(颞枕叶、小脑、脑桥)用Logstic回归模型进行多因素分析,其结果显示:认知障碍组(MCI+VD)中,模型1通过校正年龄及性别因素,颞枕叶梗死患者发生认知障碍风险比非颞枕叶梗死增加约38倍(OR 39.3,95%CI 2.70~572.53﹚,脑桥梗死患者发生认知障碍风险比非脑桥梗死降低87%(OR 0.13,95%CI 0.03~0.64﹚;模型2通过校正年龄、性别及HAMD评分,颞枕叶梗死患者发生认知障碍风险增加更加明显(OR 75.89,95%CI 3.92~1 470.06),脑桥梗死患者发生认知障碍风险进一步降低90%(OR 0.10,95%CI 0.02~0.60)。轻度认知障碍组中,经模型1及模型2校正后发现,颞枕叶梗死患者发生MCI风险明显增加。类似地经模型1及模型2校正后,血管性痴呆组中小脑梗死患者发生VD风险明显增加(表3)。

图1 不同认知功能组后循环梗死部位分布
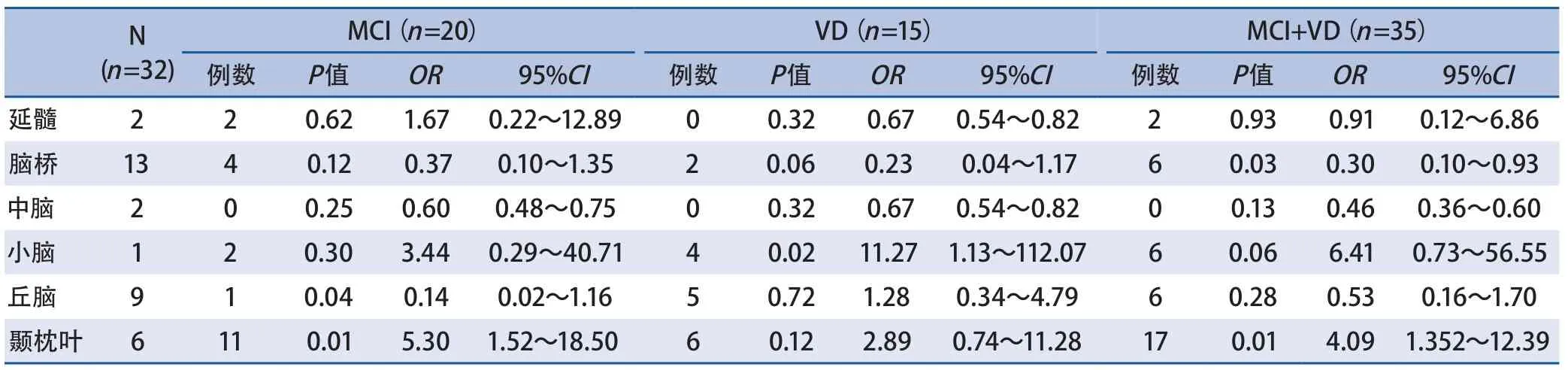
表2 后循环不同梗死部位与认知障碍发生风险的单因素分析
3 讨论
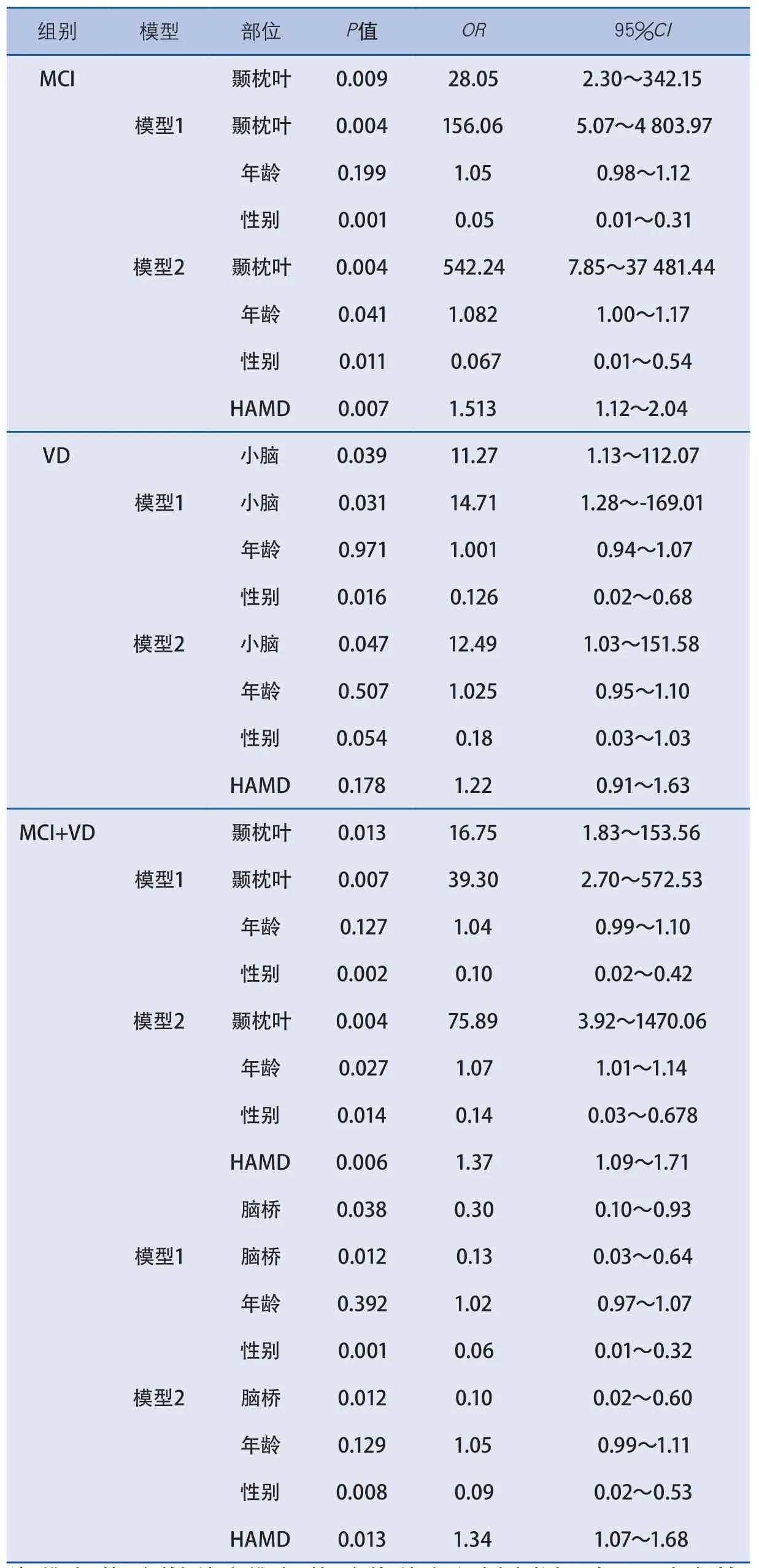
表3 后循环不同梗死部位与认知障碍发生风险的多因素分析
本研究中,急性后循环缺血性卒中50%以上患者发生卒中后认知障碍,颞枕叶及小脑梗死增加认知障碍发生风险,与国内外文献报道一致[11-13]。多项研究提示后循环脑区病变可引起多种神经心理功能缺陷,如口语不利、记忆障碍、失读、计算能力减退、定向力障碍、视觉失认、命名障碍等症状[14-15]。更进一步的研究证实后循环病变中视觉忽视、语言障碍等症状特点及它们所对应的损伤部位[16-17]。
颞枕叶损伤可引起多种认知障碍。Bird等[17]证实右侧颞叶病变患者存在视觉忽视;孤立性海马梗死可致长时情景记忆功能缺陷[18]。一项以卒中后血管性轻度认知障碍患者为研究对象的前瞻性队列研究发现,部分患者在随访过程中出现认知能力衰退,头颅MRI提示颞叶萎缩,表明颞叶萎缩与血管性MCI患者认知障碍发生及恶化相关[19]。尽管多项研究提出丘脑与认知功能有关,但本研究结果并未发现此类相关性。这种差异可能是因为丘脑性认知障碍发生与丘脑特殊核团病变有关。
近10年来,实验研究、临床观察表明小脑不仅与运动功能有关,还参与高级认知加工过程[20-22]。Schmahmann等[23]发现孤立性小脑病变患者存在执行功能和视空间能力障碍、情感异常等功能障碍,提出“小脑认知情感综合征”(cerebellar cognitive affective syndrome)这一概念。因此有学者猜测小脑可能与前额叶存在纤维连接,参与前额叶皮质认知加工过程。小脑所涉及的认知功能神经环路相对复杂,在动物模型中,脑桥脚盖区存在部分核团投射神经纤维至前额叶皮质,这些核团被破坏后可引起认知障碍[24];在慢性酒精中毒人群中,脑干白质体积与小脑前蚓部、小脑半球白质体积相关,丘脑部分核团体积与小脑皮质、后蚓部相关,表明小脑与丘脑、小脑与脑干有神经结构关联,该学者提出“小脑-丘脑连接系统”(cerebellothalamocortical systems)及“脑桥-小脑连接系统”(pontocerebellar systems)的概念,因此,研究者认为脑部认知系统中可能存在以脑干为中介的小脑-丘脑功能连接系统[25],而丘脑本身是前额叶认知环路重要组成部分。本研究发现小脑梗死与认知障碍,尤其是血管性痴呆,存在显著相关性,小脑梗死所致认知功能障碍可能与这一神经连接环路上神经纤维中断或神经元的直接破坏有关;而脑桥梗死与认知障碍发生无显著相关,可能与小脑与脑桥的功能连接区主要存在于腹侧脑桥有关[4]。
本研究尚且存在一些局限性:样本量相对较少,尚需大样本随机对照研究进一步证实;随访尚未完成,缺乏临床影像学资料的支持,如功能磁共振成像、弥散张量成像等。尽管存在上述局限性,但多因素回归模型数据分析结果进一步证实研究结论,也为临床医师及卒中患者提供了后循环缺血性卒中与认知障碍发生相关的重要证据。
1 Ferri CP, Schoenborn C, Kalra L, et al. Prevalence of stroke and related burden among older people living in latin america, india and china[J]. J Neurol Neurosurg Psychiatry, 2011, 82:1074-1082.
2 Toole JF, Bhadelia R, Williamson JD, et al. Progressive cognitive impairment after stroke[J]. J Stroke Cerebrovasc Dis, 2004, 13:99-103.
3 Jiménez Caballero PE. Bilateral paramedian thalamic artery infarcts:Report of 10 cases[J]. J Stroke Cerebrovasc Dis, 2010, 19:283-289.
4 Buklina SB, Gavriushin AV, Okishev DN. Clinicalneuropsychological study of patients with hematomas,cavernomas and arteriovenous malformations of the brain stem[J]. Zh Nevrol Psikhiatr Im S S Korsakova,2009, 109:8-14.
5 Kunitz SC, Gross CR, Heyman A, et al. The pilot stroke data bank:Definition, design, and data[J].Stroke, 1984, 15:740-746.
6 Mancia G, Fagard R, Narkiewicz K, et al. 2013 ESH/ESC Practice Guidelines for the Management of Arterial Hypertension[J]. Blood Press, 2014, 23:3-16.
7 Fox CS, Golden SH, Anderson C, et al. Update on prevention of cardiovascular disease in adults with type 2 diabetes mellitus in light of recent evidence:a scientific statement from the american heart association and the american diabetes association[J].Diabetes Care, 2015, 38:1777-1803.
8 Bitzur R, Rozenman Y, Vinker S, et al. Israeli guidelines for the treatment of hyperlipidemia - 2014 update[J]. Harefuah, 2015, 154:330-333, 337-338.
9 Stone NJ, Robinson JG, Lichtenstein AH, et al. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults:a report of the American College of Cardiology/American Heart Association Task Force on PracticeGuidelines[J]. J Am Coll Cardiol, 2014,63:2889-2934.
10 Gorelick PB, Scuteri A, Black SE, et al. Vascular contributions to cognitive impairment and dementia:A statement for healthcare professionals from the american heart association/american stroke association[J]. Stroke, 2011, 42:2672-2713.
11 Altinbas A, Hendrikse J, Algra A, et al. Ipsilateral foetal-type posterior cerebral artery is associated with cognitive decline after carotid revascularisation[J].BMC Neurol, 2014, 14:84.
12 Busigny T, Pagès B, Barbeau EJ, et al. A systematic study of topographical memory and posterior cerebral artery infarctions[J]. Neurology, 2014, 83:996-1003.
13 Campanholo KR, Conforto AB, Rimkus CM, et al.Cognitive and functional impairment in stroke survivors with basilar artery occlusive disease[J].Behav Neurol, 2015, 2015:971514.
14 De Renzi E, Zambolin A, Crisi G. The pattern of neuropsychological impairment associated with left posterior cerebral artery infarcts[J]. Brain, 1987,110:1099-1116.
15 Brandt T, Steinke W, Thie A, et al. Posterior cerebral artery territory infarcts:Clinical features, infarct topography, causes and outcome. Multicenter results and a review of the literature[J]. Cerebrovasc Dis,2000, 10:170-182.
16 Capitani E, Laiacona M, Pagani R, et al. Posterior cerebral artery infarcts and semantic category dissociations:A study of 28 patients[J]. Brain, 2009,132:965-981.
17 Baumann CR, Regard M, Trier S, et al. Lipoma on the corpus callosum in a patient with schizophrenia-like episode:Is there a causal relationship?[J]. Cogn Behav Neurol, 2006, 19:109-111.
18 Szabo K, Frster A, J ger T, et al. Hippocampal lesion patterns in acute posterior cerebral artery stroke clinical and mri findings[J]. Stroke, 2009,40:2042-2045.
19 Grau-Olivares M, Arboix A, Junque C, et al.Progressive gray matter atrophy in lacunar patients with vascular mild cognitive impairment[J].Cerebrovasc Dis, 2010, 30:157-166.
20 Peterburs J. The association between eye movements and cerebellar activation in a verbal working memory task[EB/OL]. (2015-08-18)[2015-08-26]. http://cercor.oxfordjournals.org/content/early/2015/08/17/cercor.bhv187.long.
21 Mothersill O. Emotion and theory of mind in schizophrenia-investigating the role of the cerebellum[EB/OL]. (2015-07-09)[2015-08-26]. http://link.springer.com/article/10.1007%2 Fs12311-015-0696-2.
22 Garriga-Grimau L, Aznar Lain G, Nascimiento MT,et al. Cerebellar cognitive affective syndrome[J]. Arch Argent Pediatr, 2015, 113:e268-270.
23 Schmahmann JD, Sherman JC. Cerebellar cognitive affective syndrome[J]. Int Rev Neurobiol, 1997,41:433-440.
24 Keating GL, Winn P. Examination of the role of the pedunculopontine tegmental nucleus in radial maze tasks with or without a delay[J]. Neuroscience, 2002,112:687-696.
25 Sullivan EV. Compromised pontocerebellar and cerebellothalamocortical systems:Speculations on their contributions to cognitive and motor impairment in nonamnesic alcoholism[J]. Alcohol Clin Exp Res,2003, 27:1409-1419.
【点睛】小脑及颞枕叶缺血性卒中增加认知障碍发生风险,小脑参与认知系统的工作。

