57例脑小血管病患者步态及平衡障碍特征分析
宗黎霞,姜 坤,崔丽英,2,朱以诚
脑小血管病以影像学上的脑白质病变(white matter lesions,WMLs)、腔隙性梗死(lacunar infarct,LI)、微出血(microbleeds,MB)、扩大的血管周围间隙(dilated perivascular spaces,DPS)和脑萎缩为特征,临床上可表现为卒中、认知障碍、步态和平衡功能障碍、情绪障碍、排尿障碍等[1]。其中步态和平衡功能障碍增加患者跌倒风险,是患者日常生活能力下降、住院率增加、并发症和死亡率增加的重要因素之一[2-3]。
正常的步态和平衡能力是锥体系和锥体外系共同协调的结果,由于WMLs、LI等破坏了脊髓运动系统和皮层、基底节纤维联系的完整性,因此脑小血管病患者往往表现出一定的步态和平衡功能障碍[4]。但目前对于脑小血管病步态和平衡障碍的研究,主要侧重于影像学特征如脑白质高信号(white matter hyperintensty,WMH)、腔隙等与步态特征相关性的分析[3,5],对于这一疾病整体表现出的运动特征缺乏全面描述。虽然有研究者将脑小血管病患者的运动障碍归于“帕金森综合征”[6-7],但在临床观察中我们发现此类患者运动障碍具有不同于帕金森病的特点,因此本研究收集影像学诊断为脑小血管病的患者,旨在一定程度上描述这一疾病表现出的整体运动特征及其步态和平衡障碍特点。
1 对象和方法
1.1 研究对象 选择2013年6月至2015年2月就诊于北京协和医院神经内科门诊的脑小血管病患者57例。纳入标准:①脑小血管病患者:头颅磁共振成像(magnetic resonance imaging,MRI)、T2加权成像及液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)上脑白质对称性高信号,Fazekas评分[8]≥2级和至少一个腔隙性梗死灶;②同意进行系统的认知和运动功能评价。排除标准:①有不能纠正的视力、听力障碍,或其他原因,不能配合检查者;②可能的心源性栓塞和大动脉硬化性脑梗死;③其他原因的脑白质高信号,如多发性硬化、代谢或中毒性脑病、感染等;④可疑存在其他神经系统疾病;⑤有严重的骨关节疾病,影响活动者。因卒中就诊者,在急性症状发生6个月后进行认知和运动功能评估。
1.2 研究方法 详细记录患者的性别、年龄、就诊原因(现病史)、既往史(缺血性卒中、出血性卒中、短暂性脑缺血发作、颈动脉狭窄、颅内动脉狭窄、高血压、糖尿病、高脂血症、冠状动脉粥样硬化性心脏病、心房颤动或心房扑动史、心脏瓣膜病、下肢动脉血管病等)、用药情况、吸烟史、饮酒史、家族史、神经系统查体、近期实验室检查及影像资料等。其中具备如下症状中1项或多项考虑为步态和平衡功能障碍[9]:运动速度减慢,步长减小,行走拖地,行走、转身、起立过程中不稳或不安全感,过去1年≥1次的摔倒史。
1.2.1 日常生活能力评价:采用Barthel指数评分(Barthel index,BI)。
1.2.2 总体运动功能评价:采用帕金森病统一评分量表(Unified Parkinson’s Disease Rating Scale,UPDRS)的运动功能评价(第3部分)和共济失调等级量表(Scale for the Assessment and Rating of Ataxia,SARA)[10]。其中,根据研究需要对UPDRS量表进行了改进,对肢体运动功能进行双侧评价分别评分;该量表共14项,最高分80分。SARA量表是基于小脑性共济失调的一种半定量评价,共8项,其中第5~8项是肢体运动功能评价,双侧分别评价取平均分后计入总分,总分40分,表示最严重的共济失调。
1.2.3 步态和平衡功能评价 采用Tinetti量表进行评价,一部分患者还进行了简明运动试验(Short Physical Performance Battery,SPPB)评价。Tinetti量表[11]包括步态和平衡测试2部分,总分28分;步态测试侧重于评价步行质量,满分12分;平衡测试侧重评价受试者由坐→站→转身→坐下过程中的动态平衡能力,满分16分。SPPB[12]包括站立平衡检查、3米行走和5次重复坐位起立测评,每部分0~4分,总分为各部分计分之和,最大12分,表示运动功能正常。
1.3 统计学方法 采用SPSS 19.0统计软件,对各变量进行描述性分析,计数资料采用频数(百分数)表示,满足正态分布的计量资料采用()表示,非正态分布计量资料采用中位数(四分位数间距)表示。
2 结果
2.1 基线资料 57例患者中,男性41例(71.9%),年龄(64.5±12.4)岁;26例(45.6%)主诉有步态障碍,40例(70.2%)有明确高血压病史;26例(45.6%)有明确缺血性卒中病史,7例(12.3%)有症状性脑出血病史;6.4%(3例/47例)有颈动脉狭窄(50%以上),6.5%(3例/46例)有颅内动脉狭窄;59.0%(23例/39例)有神经系统查体异常;13%(6例/46例)在过去的1年内至少不明原因跌倒1次(表1)。
2.2 日常生活能力和总体运动功能 73.7%(42例)的患者Barthel指数≥90分,≤65分者仅5.3%(3例);最易受累项是第2(小便失禁)、第9项(上下楼梯困难),为61.4%和64.9%(表1)。
UPDRS总分(14.2±10.1)分;60%以上(61.4%~96.5%)的患者分项评分在0~1分之间;受累明显(评分≥2分)的项目是手指捏合(拇指对掌)、双手轮替、躯体少动和姿势反射;49.1%(28例)存在步态异常(≥1分),其中仅8例受累明显(≥2分)。SARA总分(5.2±3.6)分,分项中,47例(82.5%)表现出步态异常,其中35例(61.4%)明显异常(≥2分);易受累(≥2分)分项有步态、双手轮替、跟膝胫试验、构音情况。坐姿、手指追踪试验几乎不受累(表2)。
2.3 步态和平衡功能特点 Tinetti总分25(18,28)分,Tinetti步态评分10(5,12)分;70.2%的患者步态评分<12分,54.4%≤10分。Tinetti平衡评分15(13,16)分;50.9%的患者平衡评分<16分,40.4%≤14分。
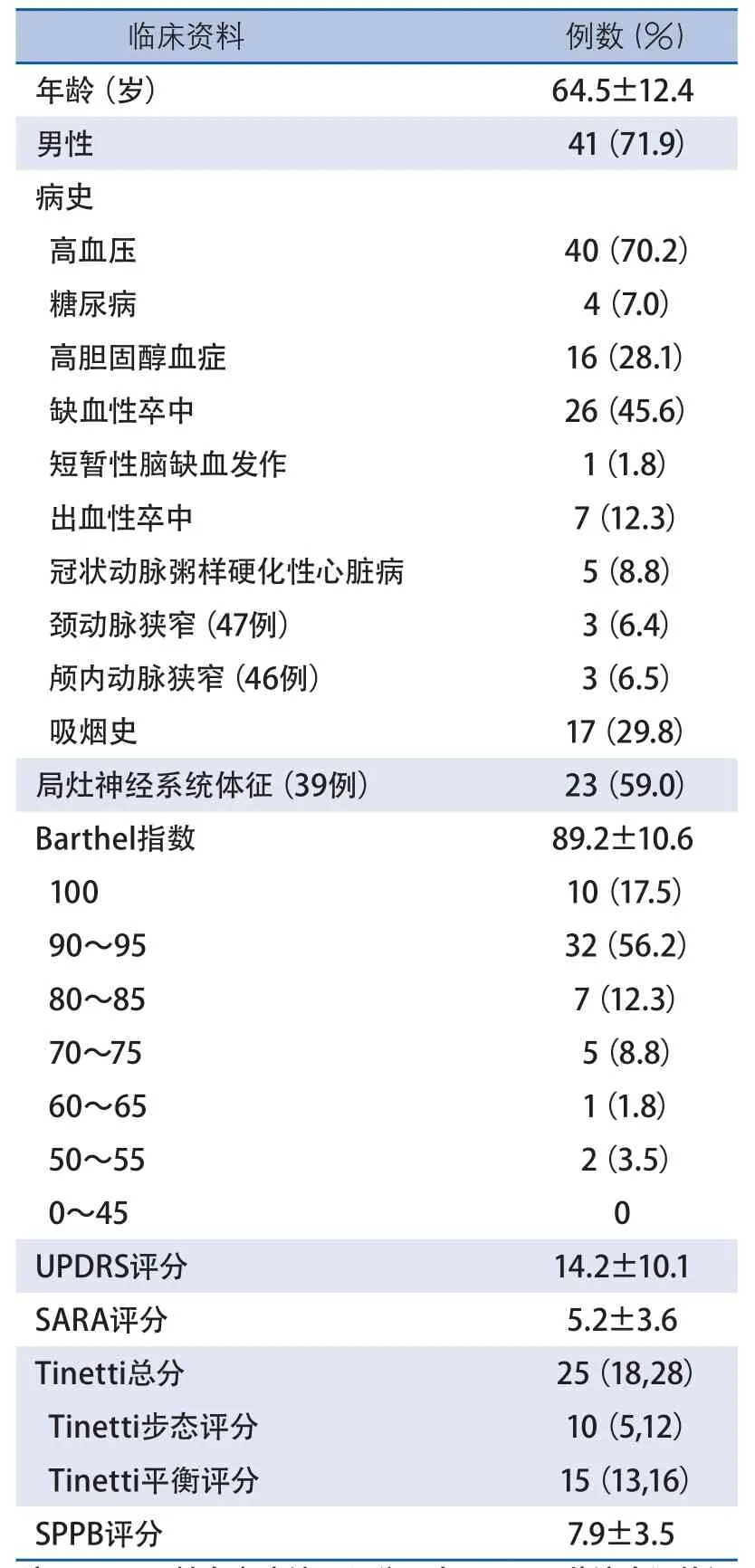
表1 57例脑小血管病患者临床资料
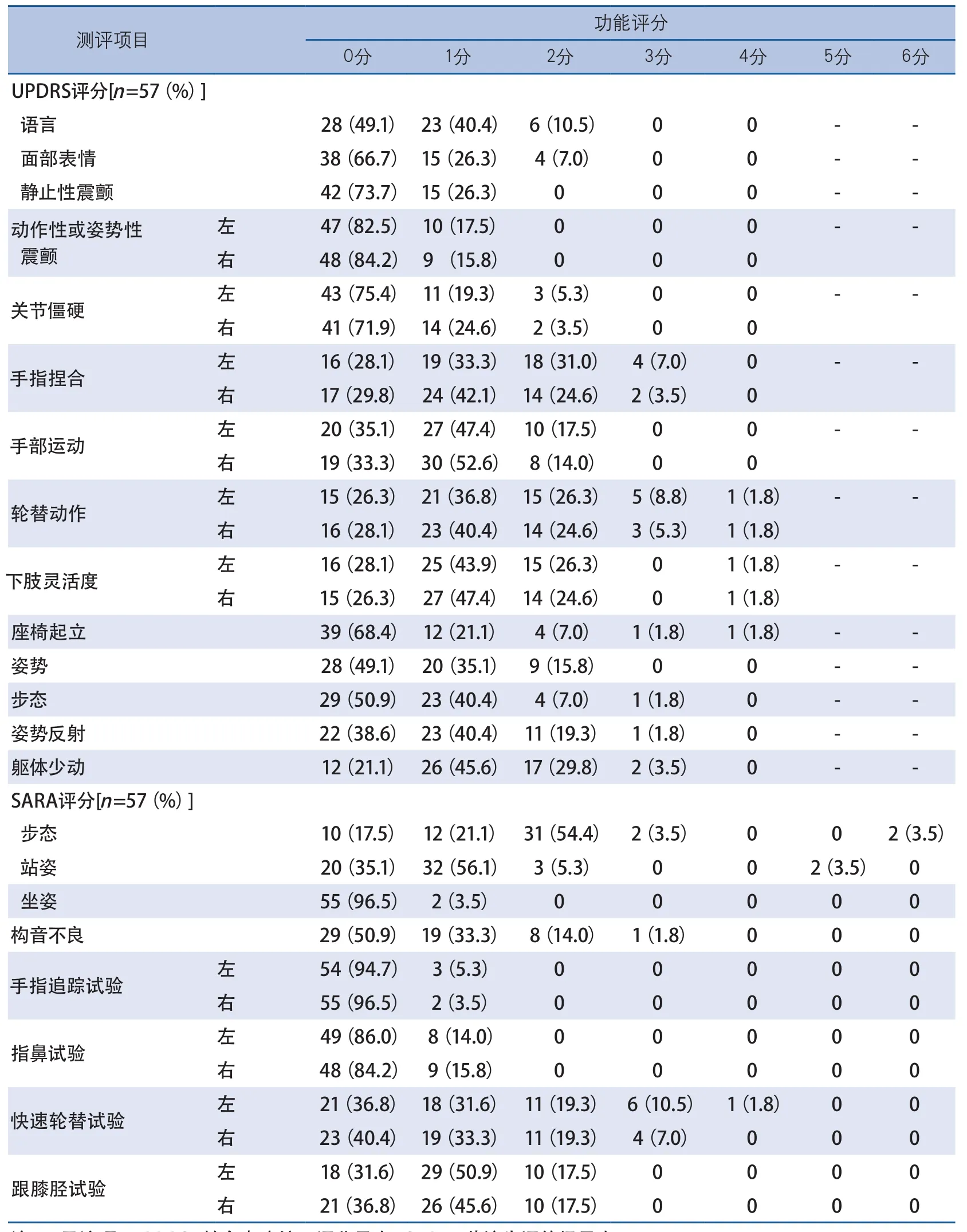
表2 总体运动功能分项评分
在各分项中,易累及的步态特征依次是步高(左、右分别为45.6%和43.9%)、步基(45.6%)、步态对称性(42.1%)、行走中躯干的稳定性(31.6%)、步长(左右分别为21.1%和28.1%)、路径偏移(26.3%)、转身动作(26.3%),仅1例(1.8%)表现出行走中步伐中断;易受累的平衡特征依次是360°转身(45.6%)、轻推试验(35.1%)、座位起立(26.3%)、坐下(22.8%)、起立后的即刻平衡(14.0%)、坐位平衡(10.5%)、闭目站立(10.5%)、起立5秒后的站立平衡(3.5%)(表3)。
33例进行了SPPB测评,42.4%(14例)总分≤8分。6.1%不能完成并联站立,36.4%不能完成半串联站立,60.6%不能完成串联站立;3米步行所需要的时间是(5.0±1.9)s,其中72.7%的患者3米步行时间≥3.62 s(评分≤3分);完成5次座位起立的时间是(13.6±5.3)s,其中15.2%不能连续完成5次座位起立(表3)。
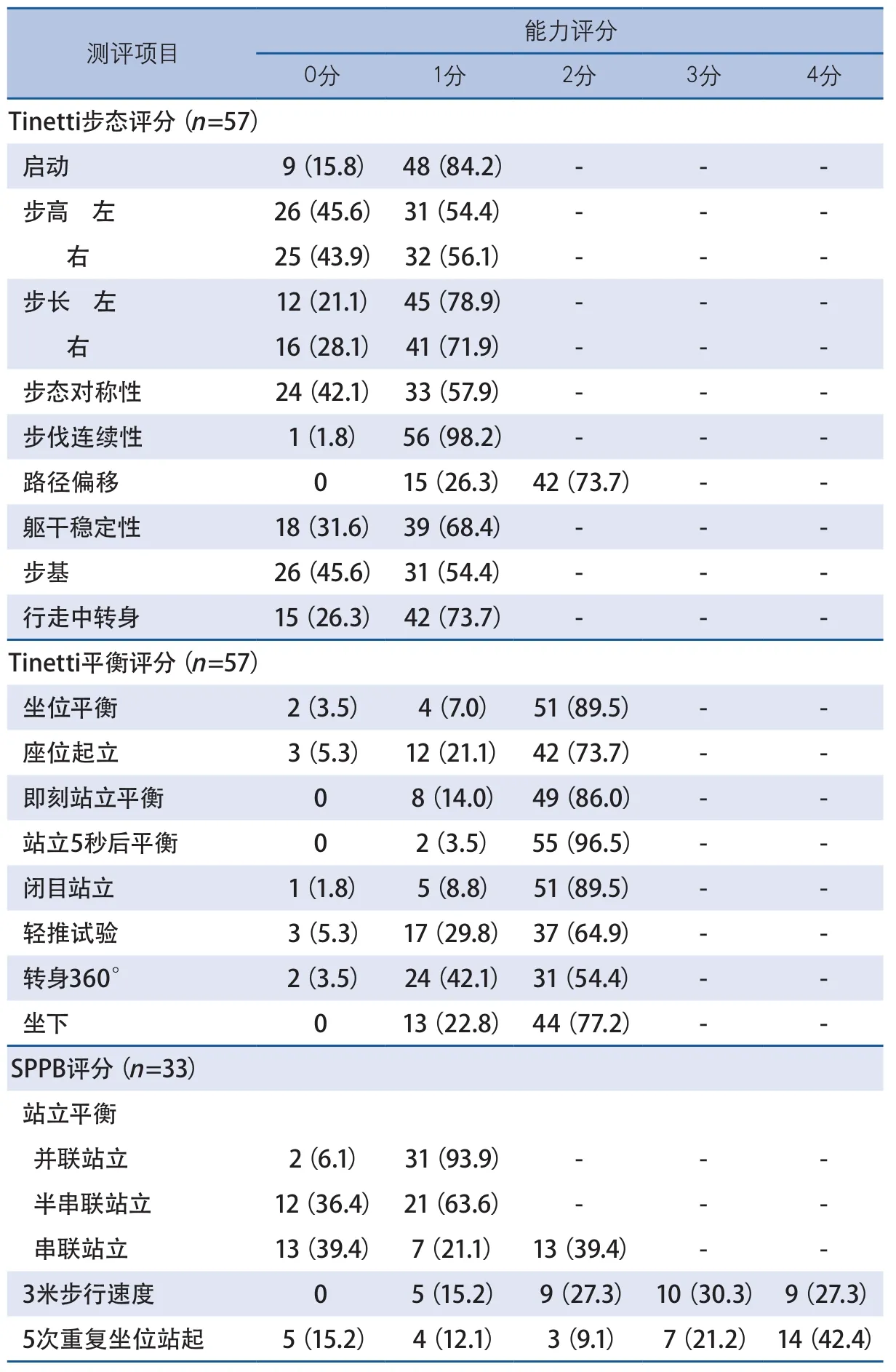
表3 步态和平衡能力评分(%)
3 讨论
步态和平衡障碍是老年人群中常见的健康问题,研究发现年龄并不足以解释其原因,而年龄相关的脑白质改变与其相关[5,13],进一步的研究表明除WMLs外,LI的严重程度、分布均与步态的时间、空间特征如双脚着地时间、迈步节律、步宽、步长及其变异性等具有独立相关性[3]。在本研究中,步高、步宽、步长对称性和行走速度均为最易受累的步态特征,与上述研究一致。值得注意的是,上述受累的步态特征中,步宽受累可能有别于帕金森病,这有待于进一步研究。在3米步行速度测定中,70%以上的患者行走速度小于每秒1 m,多于文献报道中的11.6%,这可能与本研究采用的脑小血管病定义标准中,脑白质病变程度重(Fazekas评分≥2),且同时合并腔隙性梗死有关,研究认为WMLs的严重程度、LI的数量与行走速度呈现“剂量效应”相关[3,5]。
在整体运动功能评价中,本组患者的UPDRS评分和SARA评分均比较低,且分项评分中多数得分为1分(轻度异常)。可见步态与平衡特征的改变对整体运动功能的影响并不大,这可以解释本组患者的日常生活能力保留良好的原因(70%以上的患者Barthel指数≥90分)。另一方面,本研究中45.6%的患者以“步态障碍”为主诉,但在Tinetti步态评分和SPPB评分中约70%的患者有步态和平衡障碍的表现。可见步态和平衡障碍的一些表现特征如步速减慢、步长不对称、步基增宽等并不足以引起患者及家属重视。因此早期筛查步态和平衡障碍的患者,对于预防跌倒和生活能力下降有重要意义。
目前脑小血管病患者运动障碍的机制并不清楚,多数的研究者认为WMLs、LI等造成与运动控制有关的皮层-皮层下神经环路的完整性破坏,从而造成运动协调的障碍[14-15]。在整体运动功能的评价中(UPDRS和SARA),上肢轮替动作受累比例及严重程度均比较一致。轮替动作的完成依赖于相关肌群运动的协调,可见运动协调功能障碍参与了脑小血管病运动障碍的发病机制,但是运动障碍的具体特点(包括受累部位、严重程度等)可能与受损神经纤维的分布、功能有关[13]。
综上,本研究对57例脑小血管病患者的运动功能进行评价,发现多数患者合并步态和平衡功能障碍,其中步宽、步高、步长对称性和步速是最易受累的步态特征,但这些特征的改变对整体运动功能和日常生活能力的影响较小,早期筛查步态特征的改变,对于预防跌倒和生活能力下降有重要意义。
1 Pantoni L. Cerebral small vessel disease:From pathogenesis and clinical characteristics to therapeutic challenges[J]. Lancet Neurology, 2010, 9:689-701.
2 Dumurgier J, Crivello F, Mazoyer B, et al. Mri atrophy of the caudate nucleus and slower walking speed in the elderly[J]. Neuroimage, 2012, 60:871-878.
3 de Laat KF, van Norden AG, Gons RA, et al. Gait in elderly with cerebral small vessel disease[J]. Stroke,2010, 41:1652-1658.
4 Baezner H, Hennerici M. From trepidant abasia to motor network failure--gait disorders as a consequence of subcortical vascular encephalopathy (sve):Review of historical and contemporary concepts[J]. J Neurolo Sci, 2005, 229-230:81-88.
5 Baezner H, Blahak C, Poggesi A, et al. Association of gait and balance disorders with age-related white matter changes:the LADIS study[J]. Neurology, 2008,70:935-942.
6 van Zagten M, Lodder J, Kessels F. Gait disorder and parkinsonian signs in patients with stroke related to small deep infarcts and white matter lesions[J]. Mov Disord, 1998, 13:89-95.
7 Rektor I, Rektorová I, Kubova D. Vascular parkinsonism-an update[J]. J Neurol Sci, 2006,248:185-191.
8 Fazekas F, Chawluk JB, Alavi A, et al. Mr signal abnormalities at 1.5t in alzheimer's dementia and normal aging[J]. Am J Roentgenol, 1987, 149:351-356.
9 Mahlknecht P, Kiechl S, Bloem BR, et al. Prevalence and burden of gait disorders in elderly men and women aged 60-97 years:a population-based study[J].PloS ONE, 2013, 8:e69627.
10 Schmitz-Hübsch T, du Montcel ST, Baliko L, et al. Scale for the assessment and rating of ataxia:Development of a new clinical scale[J]. Neurology, 2006, 66:1717-1720.
11 Canbek J, Fulk G, Nof L, et al. Test-retest reliability and construct validity of the tinetti performanceoriented mobility assessment in people with stroke[J].J Neurol Phys Ther, 2013, 37:14-19.
12 Fisher S, Ottenbacher KJ, Goodwin JS, et al. Short physical performance battery in hospitalized older adults[J]. Aging clin Exp Res, 2009, 21:445-452.
13 Blahak C, Baezner H, Pantoni L, et al. Deep frontal and periventricular age related white matter changes but not basal ganglia and infratentorial hyperintensities are associated with falls:Cross sectional results from the ladis study[J]. J Neurol Psychiatry, 2009, 80:608-613.
14 de Laat KF, van Norden AG, Gons RA, et al.Diffusion tensor imaging and gait in elderly persons with cerebral small vessel disease[J]. Stroke, 2011,42:373-379.
15 Reijmer YD, Fotiadis P, Martinez-Ramirez S, et al.Structural network alterations and neurological dysfunction in cerebral amyloid angiopathy[J]. Brain,2015, 138:179-188.
【点睛】本文通过对57例脑小血管病患者的运动功能的半定量评价,发现半数以上患者表现出步态障碍,主要表现为速度减慢、拖地、步基宽和双侧步长不等。

