影像学表现为“脑桥半切征”的急性脑桥梗死患者的临床特征分析
黄治飞, 朱幼玲, 徐乔乔
(安徽医科大学第三附属医院/安徽省合肥市第一人民医院 神经内科, 安徽 合肥, 230061)
急性孤立性脑桥梗死约占后循环梗死的15%, 是后循环脑梗死最常见的卒中类型[1-2], 因供血动脉基底动脉分支多呈直角发出,易受血流动力学变化的影响,故脑桥比脑干其他部位更易受缺血的影响。脑桥梗死最常见的部位是一侧脑桥的基底部,基于脑桥供血动脉分布的特点,该部位脑梗死有时形成特征性的不跨越中线,而且以脑桥中线为界,内缘与中线平齐呈刀切样,形如楔形的半切征象,称之为“脑桥半切征”。该征象对急性脑桥梗死有特异性诊断价值,目前国内外仅有少数文献[3-5]报道,但其病因和临床预后等仍存在争议。本研究回顾性分析11例“脑桥半切征”患者的临床特点、核磁共振成像(MRI)特征、病因以及临床预后,并结合文献进行分析,现将结果报告如下。
1 资料与方法
1.1 一般资料
回顾性收集合肥市第一人民医院神经内科2019年1—12月收治的MRI表现为“脑桥半切征”的急性脑桥梗死患者11例的临床资料,患者均符合中华医学会神经病学分会制订的《中国急性缺血性脑卒中诊治指南2018》中的诊断标准[6]。纳入标准: ① 发病时间≤1周者; ② 头颅弥散加权成像(DWI)证实为急性脑桥梗死者,且累及单侧脑桥。排除标准: ① 本次发病是由手术、外伤或其他医源性操作所致者; ② 合并严重心、肺、肝、肾功能不全以及恶性肿瘤和精神障碍者。
1.2 方法
详细收集纳入患者的临床资料,其中一般临床特征包括人口学资料、发病时间、临床表现和既往史,危险因素包括高血压病、糖尿病、高脂血症、卒中史、冠心病、心房颤动以及吸烟史、饮酒史; 实验室检查包括空腹血糖、血脂分析、同型半胱氨酸等; 辅助检查包括心电图、超声心动图、颈部血管彩超、头颅CT、头颅MRI、DWI及磁共振血管造影(MRA); 临床神经系统查体; 临床病情评估需记录入院和出院时美国国立卫生研究院卒中量表(NIHSS)评分,NIHSS评分增加≥2分定义为神经功能缺损进展。
1.3 头颅MRI检查方法和图像分析
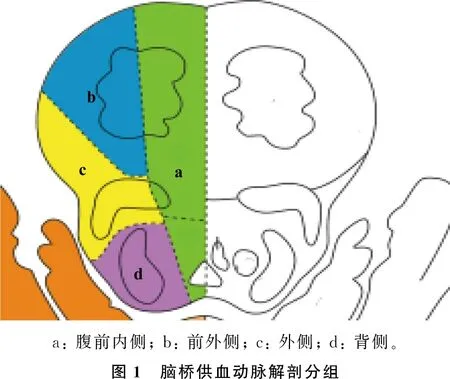
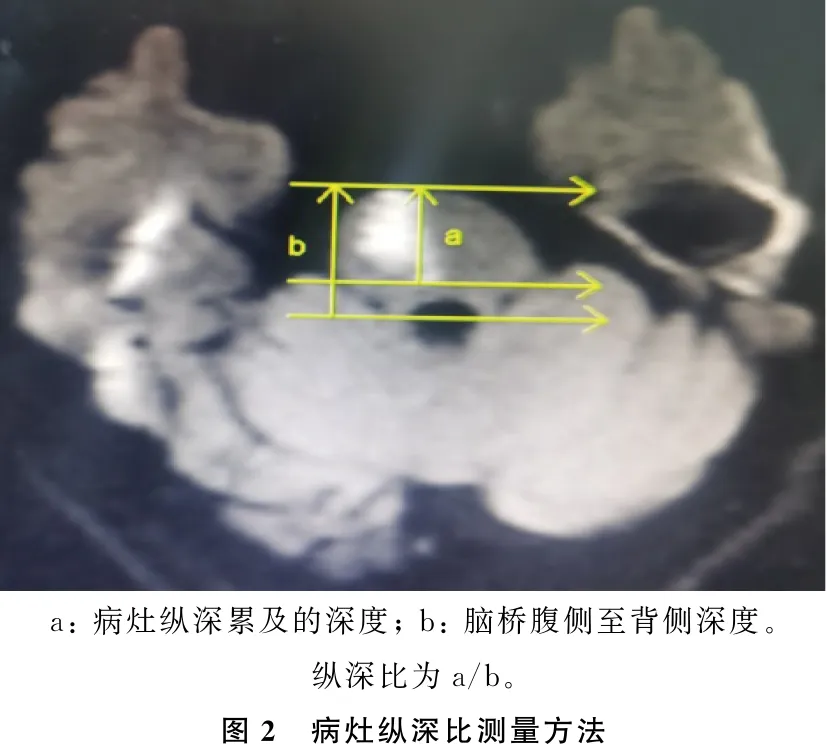
本研究采用仪器为西门子MagnetomAvanto1.5T MRI 扫描仪,患者入院3 d内常规行 MRI检查,包括头颅 MRI 平扫、DWI和头颅MRA。MRI常规扫描参数: T1WI序列横轴位[重复时间(TR)=2 113.0 ms, 回波时间(TE)=25.2 ms, 层厚5.0 mm], T2WI 序列横轴位和矢状位(TR=4 000.0 ms, TE=102.0 ms, 层厚5.0 mm), DWI序列横轴位[TR=12 000.0 ms, TE=100.0 ms, 层厚5.0 mm, 层距1.7 mm, 视野(FOV) 400 mm×200 mm, 矩阵256×128, 选取b=0和b=1 000]。头颅MRA采用三维时间飞跃法(3DTOF)扰相梯度回波脉冲序列(GRE)(TR=33.0 ms, TE=3.8 ms, 层厚1.2 mm, 矩阵256×256)。通过MRI图像确定病灶具体部位(脑桥腹前内侧、前外侧、外侧和背侧)和计算病灶纵深比值。见图1、2。
1.4 临床治疗方案
所有入选患者无静脉溶栓和血管内治疗适应证,入院后均予以阿司匹林联合氯吡格雷双重抗血小板聚集、他汀降脂稳定斑块、清除自由基、营养神经等综合治疗。
2 结 果
2.1 临床特征、危险因素及辅助检查结果
“脑桥半切征”患者共11例,男6例,女5例,发病年龄60~82岁,平均年龄(72.64±8.26)岁。11例患者临床症状均表现为病灶对侧肢体瘫痪和构音障碍,其中伴有对侧偏身感觉减退5例,中枢性面瘫8例,中枢性舌瘫7例,眩晕或头晕5例,眼震4例以及共济失调3例。2例患者住院期间进展性加重。11例患者入院时平均NIHSS评分为(5.45±1.44)分,出院时为(4.91±2.54)分。
本组患者有高血压病史8例,糖尿病史6例,高脂血症病史2例,卒中史2例,冠心病及房颤史0例,吸烟史2例,饮酒史1例。实验室检查结果提示高同型半胱氨酸血症4例,血脂异常5例; 颈动脉粥样硬化伴斑块6例,颈动脉中重度狭窄1例,心电图均未见房颤等严重心律失常,心脏彩超未见附壁血栓形成以及严重瓣膜疾病。见表1。
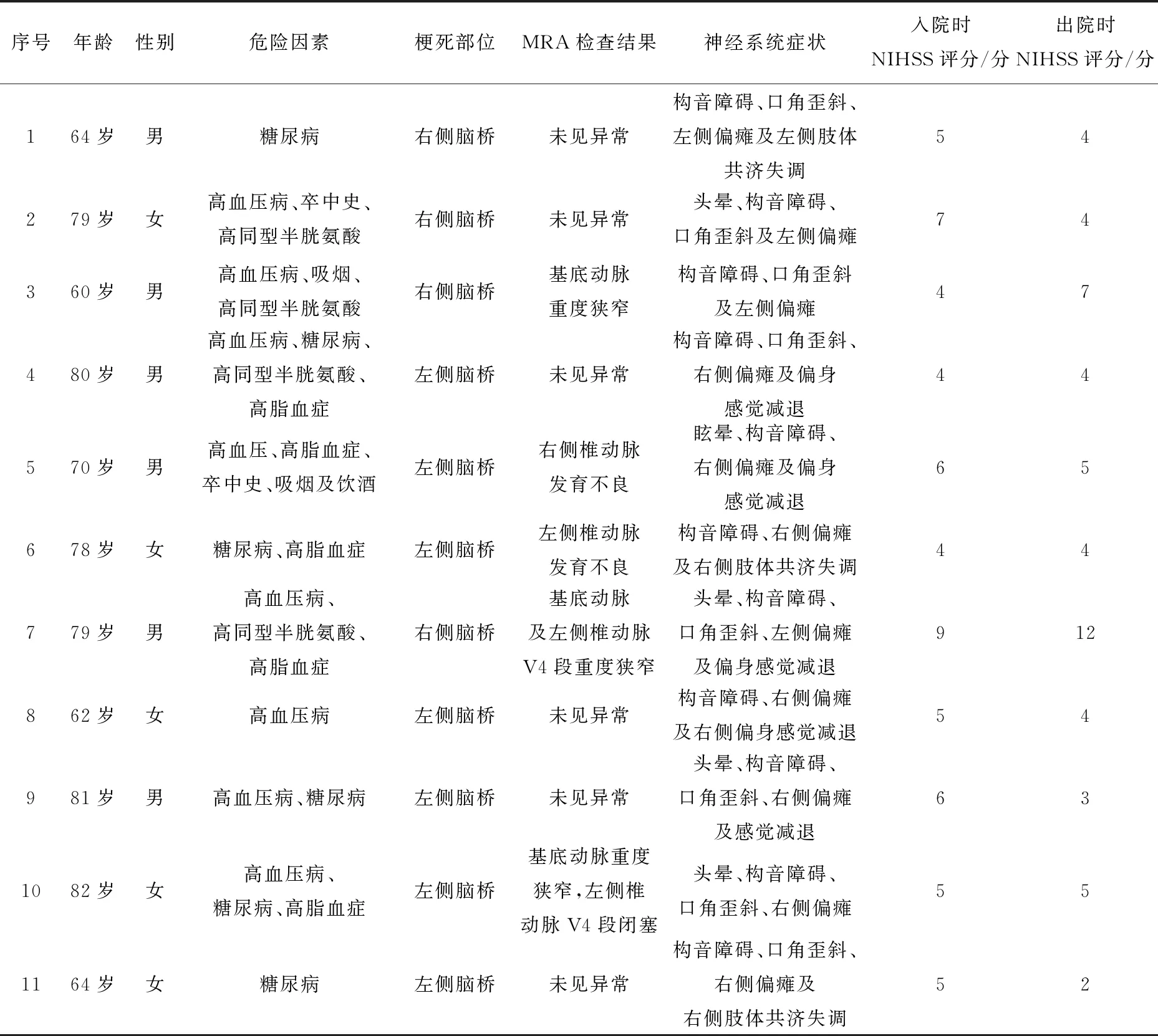
表1 11例表现为“脑桥半切征”的急性脑桥梗死患者临床资料
2.2 影像学检查结果
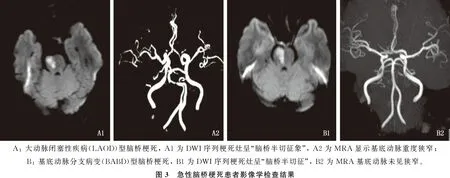
所有患者MRI检查均显示病灶累及脑桥腹前内侧区,其中3例患者合并累及前外侧区。7例病灶位于左侧脑桥, 4例位于右侧脑桥。11例患者病灶平均纵深比为74.4%(67.1%~80.9%)。3例患者MRA检查发现存在椎基底动脉局部重度狭窄或闭塞, 2例存在椎动脉V4段发育不良。见表2、图3。

表2 11例急性脑桥梗死患者具体梗死部位和病灶纵深比
3 讨 论
“脑桥半切征”是急性脑桥梗死的一种特殊影像学表现,虽然发病率较低,但易导致严重的不良预后,因此对其进行识别具有重要的临床意义。“脑桥半切征”的形成与脑桥动脉供血特点有密切关系,根据脑桥供血动脉解剖,脑桥灌注区可分为腹前内侧、前外侧、外侧和背侧共4组[7]。前内侧区由旁正中动脉供应,前外侧区由短旋动脉供应,外侧区由长旋动脉供应,背侧区仅由小脑上动脉(SCA)分支供应[7-8]。由于桥脑背外侧部侧支循环丰富,而旁正中动脉和短旋动脉以中线为界两侧对称分布且无交叉,侧支循环少,所以“脑桥半切征”常累及腹前内侧区和前外侧区。
脑桥含有多种脑神经核团和上下行神经纤维,故脑桥梗死具有复杂的临床症状和体征。本研究影像学结果发现,“脑桥半切征”主要累及腹前内侧区和前外侧区,而该区域含有锥体束、感觉神经传导束、皮质脑干束和被盖等结构,因此其临床表现主要为对侧肢体偏瘫及偏身感觉障碍、构音障碍等症状。本研究共纳入了11例“脑桥半切征”患者,均表现为构音障碍和对侧肢体偏瘫,其中8例中枢性面瘫,7例中枢性舌瘫,6例对侧感觉减退以及5例伴有头晕或眩晕等症状。“脑桥半切征”若仅依靠患者临床症状及体征进行定位,常常会被误诊为大脑半球,但对于伴有眩晕或头晕和眼震并存患者,可能首要考虑定位于脑桥位置。此外,本研究中11例“脑桥半切征”患者临床症状表现相对不严重,仅2例住院期间进展性加重,出院时NIHSS平均分为(4.91±2.54)分,临床预后均较好,与既往研究[7, 9-10]结论一致,可能与“脑桥半切征”累及脑桥部位有关。由于皮质脊髓束位于脑桥基底部的背外侧,位于上脑桥水平,并汇入上髓质的前内侧面,形成致密束,脑桥上部皮质脊髓束在大量横穿的非锥体纤维内以松散分散的方式沿皮质桥脑纤维走行[11]。因此,脑桥上区(通常是旁正中腹侧)的梗死可能较脑桥下区的梗死对皮质脊髓束造成的损害更小。
本研究中11例急性脑桥梗死患者头颅MRI均可见典型的“半切征”,对侧脑桥以及其他部位均未见新发梗死灶,因此其本质上属于孤立性脑桥梗死范畴。对于孤立性脑桥梗死,KUMRAL E等[12]在一项基于MRI的研究中发现,75%的孤立性脑桥梗死位于脑桥腹侧。另一项研究[13]发现50%的单侧脑桥梗死位于脑桥腹侧,腹侧梗死包括前内侧区和前外侧区,且大部分腹侧梗死位于前内侧区。急性孤立性脑桥梗死的病因学是近年来研究的热点,针对其病因学分型主要有Kumral分型和TOAST分型,而Kumral分型是依据脑桥病灶形态学、血管解剖学和病理生理学机制,将其病因分为LAOD、BABD及小动脉疾病(SAD)等。孤立性脑桥梗死的最常见病因亚型是BABD, 其次是SAD和LAOD。ZHOU L等[14]基于SMART研究进行亚组分析,结果证实了BABD是急性孤立性脑桥梗死最常见的病因,其次是SAD和LAOD。KOBAYASHI J等[15]共纳入205例急性孤立性脑桥梗死患者,观察不同部位脑桥梗死的病因机制,结果发现基底动脉粥样硬化病因在前内侧梗死中更常见。目前认为分支动脉粥样硬化性疾病发病机制即穿支动脉口被载体动脉粥样硬化斑块阻塞,或起源于载体动脉粥样硬化斑块延伸至穿支动脉口,另一种机制是穿支动脉本身产生微小动脉粥样硬化斑块[16-18]。由于目前影像技术无法准确地描述穿支动脉管腔和管壁情况,因此BABD病因主要由间接影像学成像特征来确定。近几年已有多项关于MRI检查脑桥梗死病灶形态与病因的相关性研究[9, 12-13, 16-18], 形态学特征被认为是区分BABD相关梗死与SAD的重要依据,目前大多数学者认为表现为与基底面相邻的脑桥旁正中梗死(影像学有时表现为“脑桥半切征”)归因于BABD和LAOD, 而表现为不延伸到基底面的腔隙性梗死(直径≤15 mm)通常归因于SAD。本研究11例“脑桥半切征”患者中3例MRA提示为椎基底动脉中重度狭窄或闭塞, 8例基底动脉未见明显狭窄,且11例患者病灶平均纵深比为74.4%, 因此其病因机制主要考虑为BABD和LAOD, 和既往报道[11, 14-17]一致。
综上所述,“脑桥半切征”是因脑桥特殊的血管解剖分布而在脑桥梗死时出现的特征性影像学征象,临床上正确识别表现为该征象的脑桥梗死的常见临床特征和病因机制,对于指导早期治疗和二级预防有着重要的意义。本研究为回顾性研究,所纳入病例较少,存在局限性,后续需通过开展大样本、多中心前瞻性研究,利用高场强高分辨率核磁对急性脑桥梗死的形态特征、基底动脉及其穿支动脉进行研究,以期获得更准确的病因依据。

