长链非编码RNA肿瘤易感候选基因11在卵巢癌组织中的表达及意义
万淑琼, 刘佳栋, 陈静青, 谢 环
(1. 鄂东医疗集团黄石市中心医院, 湖北 黄石, 435200;2. 湖北省宜昌市第二人民医院/三峡大学第二人民医院 妇科, 湖北 宜昌, 443000)
卵巢癌是女性生殖系统高发恶性肿瘤之一,早期症状较为隐匿,且侵袭力强、进展迅速[1], 虽然卵巢癌的诊疗手段近年来不断发展,但治疗后仍易复发,导致患者病死率较高,长期预后依然不佳[2]。长链非编码RNA(lncRNA)是长度在200个核苷酸以上且缺失或具有少量编码蛋白能力的非编码RNA, 可通过调控基因表达而在细胞增殖、生长、分化、代谢等多种生理过程中发挥重要作用[3], 参与多种疾病的发生过程[4], 同时与多种恶性肿瘤的发生、进展过程密切相关[5]。肿瘤易感候选基因11(CASC11)作为新近发现的一种lncRNA, 在小细胞肺癌组织中表达异常且与预后有一定关系[6], 但其是否参与卵巢癌的发生与进展过程尚鲜有报道。本研究分析了卵巢癌组织中CASC11表达情况及其与不同临床病理指标的关系,并通过小干扰RNA(siRNA)技术抑制SKOV3细胞中CASC11表达,观察其对细胞生物学功能的影响,以期为卵巢癌的机制研究及早期诊疗提供参考依据。
1 资料与方法
1.1 一般资料
选取2017年1月—2019年12月在鄂东医疗集团黄石市中心医院妇科接受手术治疗的104例卵巢癌患者作为研究对象,患者术前均未行放化疗治疗,且术后病理确诊为卵巢上皮性癌。患者年龄30~75岁,平均(49.38±10.37)岁; 组织学类型为浆液性61例,其他43例; 分化程度为中高分化67例,低分化37例; 国际妇产科联盟(FIGO)分期为Ⅰ~Ⅱ期48例, Ⅲ~Ⅳ期56例; 发生淋巴结转移者48例。术中留取卵巢癌组织以及癌旁>2 cm正常癌旁组织,快速置于液氮中, -80 ℃保存。本研究经医院伦理委员会审核批准,且所有患者均对研究知情同意。
1.2 主要试剂和设备
总RNA试剂(Trizol法)和Lipofectamine 2 000转染试剂购自美国Invitrogen公司,逆转录试剂盒和聚合酶链反应(PCR)扩增试剂盒均购自大连宝生物工程有限公司, CASC11和内参引物由上海斯信生物科技有限公司设计合成, SKOV3细胞购自上海通派生物科技有限公司,达氏修正依氏培养基(DMEM)/F12培养液购自美国Sigma公司,胎牛血清和胰蛋白酶购自美国Gibco公司, CASC11干扰序列和阴性对照序列由上海吉凯基因化学技术有限公司设计合成,噻唑蓝(MTT)购自广东翁江化学试剂有限公司,二甲基亚砜(DMSO)购自上海一研生物科技有限公司, Matrigel基质胶购自美国BD公司, Transwell小室购自美国Corning公司, CFX-96实时荧光定量PCR仪购自美国Bio-Rad公司。
1.3 方法
1.3.1 实时荧光定量PCR法检测组织中CASC11表达情况: 取卵巢癌组织和癌旁正常组织,剪碎、研磨,按试剂盒说明提取总RNA并检测纯度,合格标准为A260/A280≥1.80。将总RNA逆转录为cDNA, 使用实时荧光定量PCR仪参照PCR扩增试剂盒说明对引物进行扩增。CASC11上游引物5′-GGTCCGAAGAAAGAGGAGTTAC-3′, 下游引物5′-TTTGTGTCTCGGTTCTCCATAG-3′; U6上游引物5′-CAGAGCTCCTCGTCTTGCC-3′, 下游引物5′-GTCGCCACCATGAGAGAC-3′。反应条件为94 ℃ 2 min, 94 ℃ 30 s, 60 ℃ 30 s, 75 ℃ 30 s, 连续36个循环。采用2-△△Ct法计算CASC11相对表达量。
1.3.2 细胞培养和分组: 应用含5% CO2的37 ℃培养箱对SKOV3细胞进行培养,胰酶消化对数生长期细胞,接种于6孔板, 2×105个/孔。将细胞分成3组,用Lipofectamine 2 000转染试剂分别对3组细胞进行转染。① si-CASC11组,转染CASC11基因的干扰序列为5′-GGAACTCACCAGCCAAGTT-3′; ② 阴性对照组,转染阴性对照序列为5′-CAGCGCTGACAACAGTTTCAT-3′; ③ 空白组,仅加入转染试剂,不进行其他处理。3组均继续培养48 h。
1.3.3 实时荧光定量PCR法检测细胞中CASC11表达情况: 各组细胞于转染后培养48 h时,胰酶消化,离心,取细胞沉淀,加入细胞裂解液,其余步骤同1.3.1。
1.3.4 MTT法检测细胞增殖情况: 取各组细胞,胰酶消化,接种于96孔板,密度为2×103个/孔,分别于培养12、24、48、72、96 h时,将MTT液20 μL加入各孔,培养4 h, 将上清去除,各孔加入DMSO液150 μL, 充分振荡20 min, 应用酶标仪取450 nm波长对各孔吸光度(A)值进行检测。重复实验3次[7]。
1.3.5 划痕实验检测细胞迁移能力: 各组细胞于转染后培养48 h时,胰酶消化,接种于6孔板,密度为5×105个/孔,过夜培养,用200 μL移液枪枪头垂直于孔板划横线,磷酸盐缓冲液(PBS)冲洗3次,用不含血清培养液培养24 h或48 h,观察并测量细胞迁移距离,计算细胞划痕愈合率,公式为细胞划痕愈合率=(初始划痕宽度-24 h或48 h划痕宽度)/初始划痕宽度×100%[8]。
1.3.6 Transwell法检测细胞侵袭能力: 用不含胎牛血清培养液稀释基质胶,平铺在小室上室,过夜风干。各组细胞行胰酶消化,离心,用不含血清培养液重悬,密度5×105个/mL, 取200 μL加入上室,将含20%胎牛血清培养液600 μL加入下室,培养24 h, 将小室取出,多聚甲醛固定, 0.1%结晶紫染色, PBS冲洗3次,用棉签除去散落细胞,镜下观察,计数穿膜细胞数。重复实验3次[9-10]。
1.4 统计学分析
2 结 果
2.1 卵巢癌组织和癌旁正常组织中CASC11表达情况比较
卵巢癌组织中CASC11相对表达量为(1.89±0.14), 高于癌旁组织的(1.00±0.07), 差异有统计学意义(t=57.272,P<0.001)。
2.2 卵巢癌组织中CASC11表达与临床病理指标的关系
卵巢癌组织中CASC11相对表达量在不同年龄、组织学类型和腹腔积液差异无统计学意义(P>0.05), 而在不同分化程度、FIGO分期和淋巴结转移差异有统计学意义(P<0.05), 见表1。

表1 卵巢癌组织中CASC11表达与临床病理指标间的关系
2.3 转染si-CASC11对细胞中CASC11表达的影响
实时荧光定量PCR结果显示, si-CASC11组、阴性对照组和空白组细胞中CASC11相对表达量分别为(0.22±0.11)、(0.98±0.06)和(1.02±0.12)。si-CASC11组细胞中CASC11相对表达量低于阴性对照组和空白组,差异有统计学意义(P<0.001), 表明si-CASC11转染能够显著抑制SKOV3细胞中CASC11的表达。见图1。
2.4 抑制CASC11对SKOV3细胞增殖活性的影响
MTT法检测结果显示,培养24、48、72、96 h时, si-CASC11组A值均低于空白组、阴性对照组,差异有统计学意义(P<0.05); 培养12 h时, 3组A值比较,差异无统计学意义(P>0.05)。见表2。
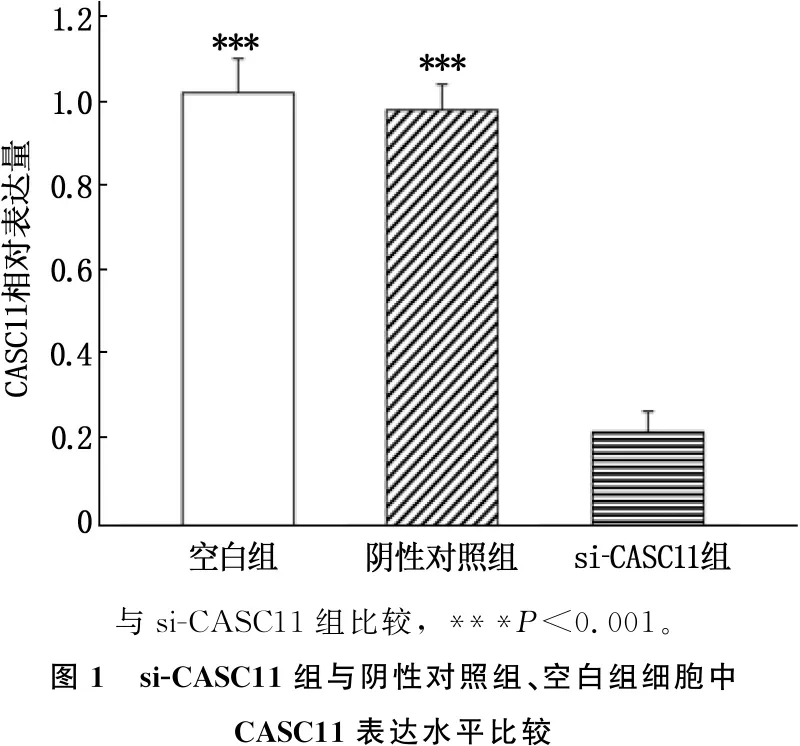

表2 3组细胞不同时点吸光度值比较
2.5 抑制CASC11对SKOV3细胞迁移能力的影响
划痕实验结果显示, si-CASC11组24、48 h时的细胞划痕愈合率均低于阴性对照组、空白组,差异有统计学意义(P<0.05), 表明抑制CASC11表达能够显著抑制SKOV3细胞的迁移能力。见表3、图2。

表3 3组细胞划痕愈合率比较 %
2.6 抑制CASC11对SKOV3细胞侵袭能力的影响
si-CASC11组侵袭细胞数为(85.67±6.47)个,低于阴性对照组的(121.17±6.65)个和空白组的(124.50±5.65)个,差异有统计学意义(P<0.01), 表明抑制CASC11表达能够显著抑制SKOV3细胞的迁移能力。见图3。
3 讨 论
卵巢癌是女性高发恶性肿瘤之一,病死率高,其发病机制复杂,涉及众多遗传及环境因素,至今尚未完全阐明。多项研究[11-12]提示,卵巢癌细胞恶性增殖及高侵袭转移性与患者预后差密切相关。因此,积极寻找与卵巢癌生长及侵袭转移相关的关键性基因有望为卵巢癌的精准诊疗及预后改善提供新的方向。近年来, lncRNA在肿瘤发生、进展中的作用越来越被重视,多种lncRNA参与了卵巢癌进程[13], 且与卵巢癌预后关系密切[14]。CASC11是新近发现的一种lncRNA, 位于人染色体8q24.21,参与人体多种疾病的发生过程[15], 且在肝癌[16]、骨肉瘤[17]等多种恶性肿瘤组织中呈高表达,其可能参与了恶性肿瘤的发生、发展过程。本研究结果显示,卵巢癌组织中CASC11相对表达量高于癌旁正常组织,说明CASC11在卵巢癌组织中呈高表达,可能参与了卵巢癌发生过程。本研究还发现, CASC11在低分化、FIGO分期Ⅲ~Ⅳ期和发生淋巴结转移的卵巢癌组织中相对表达量明显更高,进一步说明CASC11可能在卵巢癌进展中发挥重要作用。


为进一步明确CASC11在卵巢癌细胞增殖及侵袭转移中的作用,本研究采用转染干扰序列的方法特异性抑制卵巢癌SKOV3细胞中CASC11的表达,发现si-CASC11细胞中CASC11相对表达量相较于阴性对照组和空白组显著降低,说明SKOV3细胞中CASC11表达被成功抑制。相关研究[18]指出, CASC11通过阻断胃癌细胞周期,抑制细胞增殖,促进细胞凋亡。研究[19]指出, CASC11通过miRNA-150促进膀胱癌细胞增殖。本研究结果显示,抑制CASC11表达可抑制SKOV3细胞增殖,提示CASC11可能参与了SKOV3细胞的增殖过程。相关研究[20]指出, CASC11通过激活Wnt/β-catenin信号通路促进宫颈癌细胞的迁移和侵袭。SU X H等[21]指出, lncRNA CASC11可促进胃癌细胞的增殖、迁移和侵袭。本研究结果提示,抑制CASC11表达可抑制SKOV3细胞迁移和侵袭力,提示CASC11可能参与了卵巢癌迁移和侵袭过程。
综上所述,卵巢癌组织中CASC11呈高表达,且与恶性进展的临床病理指标有关,抑制CASC11表达可抑制SKOV3细胞增殖、迁移和侵袭力,但其具体作用机制尚待进一步深入研究加以明确。

