新型Cervista酶切信号扩大法检测高危型HPV用于宫颈癌筛查结果分析
赵婷婷,袁 亚,蒋舒平,涂焕平
(上海市普陀区人民医院,上海200060)
宫颈癌的发生与多种因素相关,如病毒感染、宿主免疫状况、基因特质性、环境因素、生活方式等[1]。目前认为HPV感染是宫颈癌的主要病因,90%以上的宫颈癌患者癌组织中可检测到HPV[2]。目前宫颈细胞学检查广泛用于宫颈癌的筛查,但因检测结果受宫颈病变位置深浅、细胞采集量及阅片经验等影响,有时会造成假阴性结果[3]。2012年3月~2013年11月,我们将新型Cervista酶切信号扩大法(以下简称Cervista技术)用于高危型人乳头瘤病毒(HR-HPV)检测,现分析结果,探讨其在宫颈癌筛查中的价值。
1 临床资料
1.1 基本资料 3206例同期于我院行妇科检查的妇女,年龄19~86岁,平均40.2岁。均行宫颈液基薄层细胞学检查(TCT)及HR-HPV基因检测。对细胞学异常、HR-HPV阳性患者行宫颈活检。
1.2 检查方法
1.2.1 TCT 按2004年TBS系统标准,诊断结论包括未见上皮内病变细胞或恶性细胞(NILM)、不能明确意义的非典型鳞状细胞(ASC-US)、非典型鳞状细胞不能除外高级别上皮内病变(ASC-H)、低级别鳞状上皮内病变(LSIL)和高级别鳞状上皮内病变(HISL)及鳞状细胞癌、腺上皮异常。
1.2.2 HR-HPV基因检测 采用新型 Cervista技术。实验材料:ThinPrep新柏氏制片,Cervista HRHPV检测实验试剂、仪器、耗材均来自美国Hologic(豪洛捷)公司。HR-HPV检测与TCT细胞学检测均来自同一样本同一份细胞保存液。按构型采用三组寡核苷酸混合物进行14种HR-HPV检测,其中A9 组检测 16、31、33、35、52、58 型,A5/A6 组检测51、56、66 型,A7 组检测 18、39、45、59、68 型。DNA样本提取及检测参照试剂盒说明书,阳性者判为HR-HPV感染。
1.2.3 宫颈活组织检查 对95例诊断为宫颈上皮内病变的患者进行随访及宫颈活组织检查。按2010年WHO妇科肿瘤分类及诊断标准判定结果。统计其HR-HPV感染率。
1.3 统计学方法 采用SPSS17.0统计学软件进行非参数检验χ2检验,P≤0.05为差异有统计学意义。
2 结果
2.1 TCT细胞学诊断 3206例样本中NILM 3031例(占94.54%),ASC-US 93 例(占2.90%),ASC-H 10例(占 0.31%),LSIL43 例(占 1.34%),HSIL29例,(占0.90%)。ASC-US及以上级别者共175例,占5.45%。
2.2 HR-HPV感染情况 3206例样本中,HR-HPV阳性665例,感染率为20.74%;175例 ASC-US及其以上级别者 HR-HPV阳性121例,感染率为69.14%。HR-HPV感染率随细胞学诊断级别升高而升高(χ2=8.00 ,P < 0.05)。见表 1。HR-HPV A9、A5/A6、A7组感染情况:3206例样本中,A9组感染403例,A5/A6组感染275例,A7组感染181例,感染率分别为 46.91%、32.01%、21.07%;A9组感染率最高。感染1个组529例、2个组89例、3个组 47例,感染率分别为 79.55%、13.38%、7.07%。NILM、ASC-US、ASC-H 、LSIL 、HSIL 者HR-HPV A9、A5/A6、A7组感染率差别有统计学意义(χ2=8.316,P <0.05)。见表 2。
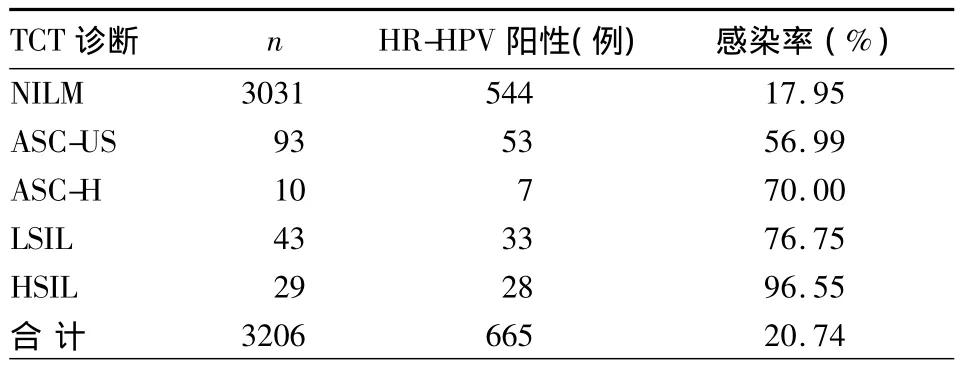
表1 不同TCT诊断者HR-HPV感染情况比较

表2 不同TCT诊断者HR-HPV A9、A5/A6、A7组感染率比较
2.3 宫颈活检诊断及HR-HPV感染率 95例患者宫颈活检诊断为LSIL55例,HISL30例,鳞状细胞癌10例,HR-HPV感染率随病变级别升高而升高(χ2=6.37,P <0.05);A9 组感染率分别为 57.97%、67.50%、76.92%。见表 3。
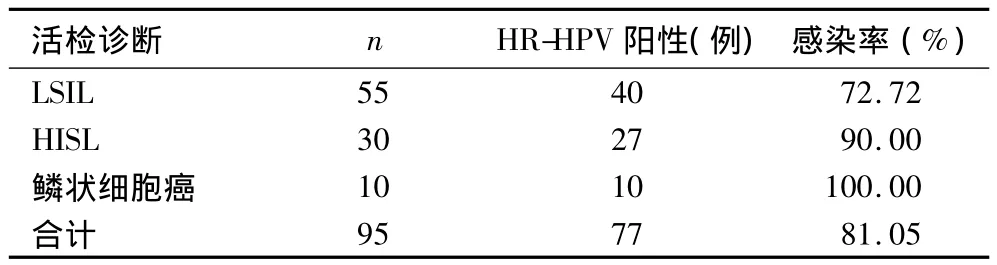
表3 宫颈活检证实的LSIL、HISL及鳞状细胞癌者HR-HPV感染率比较
3 讨论
TCT为一种简便、无创的方法,是宫颈癌筛查的主要方法。目前临床将TCT的TBS分类用于宫颈病变分级,协助临床诊疗。妇女在一生中都可能感染HPV,80%以上感染可通过自身免疫调节清除[4]。低危型HPV主要引起生殖器疣,HR-HPV对评估异常宫颈细胞学结果具有重要价值[5]。少数HR-HPV持续感染后,其病毒基因可整合到宿主细胞 DNA,激活癌基因 E6、E7[6],导致抑癌基因 P53、Rb等基因失活,诱导G1/S细胞周期分化异常、细胞无限增殖,导致宫颈癌的发生[7]。
目前,临床及实验中HPV检测方法种类繁多。本研究采用新型Cervista技术检测HR-HPV,初级反应为探针寡核苷酸、Invader寡核苷酸 与DNA目标序列结合进行切割,次级反应切割片段与荧光素标记的寡核苷酸结合,再与Cleavase酶识别结合,产生荧光放大信号[8]。其检测 HR-HPV 的 L1、E6、E7区,每次检测均设置人组蛋白Ⅱ基因特异的寡核苷酸作为内部质控,可消除因样本量不足导致的假阴性结果;不与低危型HPV发生交叉反应,可避免假阳性结果。检测中的外部质控(阴性对照和阳性对照),保证每次结果准确性、特异性更高[8,9]。本组HR-HPV的感染率为20.74%,存在同时感染一组或多组病毒情况,说明个体差异、免疫状态及对病毒的易感性各有不同。随细胞学诊断分级升高,HRHPV感染率逐渐增高,说明高级别细胞学病变与HR-HPV感染关系最为密切。ASC提示为鳞状上皮内病变的细胞改变,但从质和量上不足以作出明确诊断,分为 ASC-US、ASC-H,与 ASC-US相比,ASC-H的高级别鳞状上皮内病变发生率较高。本研究ASC-H者HR-HPV感染率为70%,可认为HR-HPV阳性的ASC-H细胞可能更倾向于高度病变。
病理组织学检查为宫颈病变诊断的金标准。本研究检测结果表明,随病理组织学级别升高,HRHPV感染率逐渐升高。结合细胞学和病理组织学诊断结果,表明HR-HPV感染与高级别上皮内病变、宫颈癌关系紧密,是导致宫颈癌发生的主要因素。Cervista技术按HPV构型分为三组,能检测14种不同分组的HR-HPV,阳性结果表明DNA标本中至少存在一种HR-HPV。本研究各组HR-HPV感染率中,A9组构成比均为最高值。在中国HPV感染前三位是 HPV16、HPV52 及 HPV58[10],其均包括在A9组中,说明HR-HPV A9组具有高致病性,导致宫颈癌的危险程度最高,对HR-HPV感染者、尤其是A9组持续感染者应引以高度重视,给予早期干预。
LSIL、HSIL、ASC-H患者具有高癌变风险,均应行阴道镜检查和宫颈活检进一步明确诊断。按2011年子宫颈病变诊断与治疗指南,对于年龄>20岁的ASC-US者可采取以下处理方法,①HPV检测和分流;②间隔6个月连续2次重复细胞学检查;③行阴道镜检查[11]。对ASC-US的处理一直是宫颈病变规范治疗的难点,存在因诊疗过度引起宫颈损伤、炎症、增生,或认识不清导致治疗不足、延误诊疗的现象。HR-HPV检测敏感性、特异性高,HR-HPVA9组具有高致病性,因此TCT、HR-HPV两者联合检查能对ASC-US患者进行评估和分流筛检,对早期发现宫颈癌及改善患者预后有重要意义。
[1]Cardoso FA,Campaner AB,Silva MA.Prognostic value of p16INK4a as a marker of clinical evolution in patients with cervical intraepithelial neoplasia grade 3(CIN 3)treated by cervical conization[J].APMIS,122(3):192-199.
[2]Tarallo PA,Smolowitz J,Carriero D,et al.Prevalence of high-risk human papilloma virus among women with hepatitis C virus before liver transplantation[J].Transpl Infect Dis,2013 ,15(4):400-404.
[3]Guan P,Clifford GM,Franceschi S,et al.Human papillomavirus types in glandular lesions of the cervix:A meta-analysis of published studies[J].Int J Cancer,2013,132(1):248-250 .
[4]Bierkens M,Wilting SM,van Wieringen Wm,et al.Chromosomal profiles of high-grade cervical intraepithelial neoplasia relate to duration of preceding high-risk human papillomavirus infection[J].Int J Cancer,2012,131(4):579-585 .
[5] Ramogola-Masire D,McGrath CM,Barnhart KT,et al.Subtype distribution of human papillomavirus in HIV-infected woman with cervical intraepithelial neoplasia stages 2 and 3 in Botswana[J].Int J Gynecol Pathol,2011 ,30(6):591-596.
[6]李翎,罗红敏,陈琳,等.HPV16E6/E7基因及蛋白表达与宫颈癌的相关性研究[J].山东医药,2006,46(8):11-13.
[7]Tzenov YR,Andrews PG,Voisey K,et al.Human papilloma virus(HPV)E7-Mediated attenuation of retinoblastoma(Rb)induces hpygopus2 expression via Elf-1 in cervical cancer[J].Mol Cancer Res,2013,11(1):19-30.
[8]Kenneth E.Youens.Gregory A.Hosler,Paula J,et al.Clinical experience with the cervista HPV HP Assay correlation of cytology and HPV ststus from 56501 specimens[J].J Mol Diagn,2011,13(2):160-166.
[9]赵健,张晓光,陈锐,等.高危型人乳头瘤病毒DNA检测方法在宫颈疾病中的临床意义[J].中华试验和临床病毒学杂志,2011,25(2):149-151.
[10]关婷,张志文,谢燕芳,等.人乳头瘤病毒基因型与宫颈上皮内瘤样病变的关系[J].中国妇幼保健,2006,21(7):960-963.
[11]牛凤霞,齐向红,李季滨,等.液基薄层细胞学联合阴道镜检查对宫颈癌及癌前病变的早期诊断价值[J].山东医药,2008,48(41):88-90.

