蜂胶黄酮对人结肠癌细胞PDE4D及Gadd45G基因表达的影响
其曼古丽·吐尔洪,布威海丽且木·阿巴拜科日,祖丽比亚·司马义,买热艳木·艾尔肯,阿达莱提·麦麦提,依米提·热合曼
(新疆大学生命科学与技术学院,乌鲁木齐830046)
近年研究发现,蜂胶中含有多种对肿瘤细胞具有抑制作用的活性成分,如黄酮类及黄酮醇类,可阻滞细胞周期和诱导肿瘤细胞凋亡;蜂胶黄酮(PB3A)具有一定的抗氧化活性[1]。磷酸二酯酶 4D(PDE4D)、DNA损伤诱导基因G(Gadd45G)分别是肿瘤生长的下调基因和上调基因,两者在前期研究基因芯片分析中的差异表达倍数为10倍以上。PDE4D基因是环磷酸腺苷(cAMP)特异性PDE,具有促进肿瘤细胞增殖作用[2~4];Gadd45G 具有抑制肿瘤细胞增殖和促进其凋亡的作用[5],其表达缺失可致细胞的无限增殖,从而引起肿瘤发生[6]。2008年1月以来,我们观察了PB3A对结肠癌SW480细胞生长的抑制作用及PDE4D、Gadd45G表达的影响,现分析结果,探讨其作用机制。
1 材料与方法
1.1 材料 结肠癌SW480细胞购自上海细胞生物学研究所细胞库。RIPA-1640培养基购自Hyclone;胎牛血清购自Gibco;Trizol Reagent购自Invitrogen;cDNA反转录试剂盒购自 Fermentas;PDE4D、Gadd45G及 β-actin引物、SYBR®Premix Ex TaqTMPerfect Real Time和 DEPC购自 TaKaRa公司(大连);辣根酶标记兔抗山羊IgG、PDE4D、Gadd45G、βactin等抗体购自博奥森生物有限公司;protein ladder、BCA蛋白定量试剂盒购自 thermo;蜂胶黄酮PB3A(质量分数≥99%)由依米提·热合曼博士提供。
1.2 细胞培养及分组 结肠癌SW480细胞常规培养与含10%胎牛血清的RPMI 1640培养液中(青霉素100 U/mL,链霉素100 U/mL),置于37℃、5%CO2培养箱中培养,隔日传代,取处于对数生长期细胞分为PB3A组和对照组。
1.3 细胞干预及细胞形态学观察 PB3A组予100 μg/mL PB3A干预24 h,对照组不干预;干预24 h倒置显微镜下观察两组细胞形态变化。
1.4 细胞干预及 PDE4D、Gadd45G mRNA表达测定 取两组对数生长期SW480细胞,经2.5 g/L胰蛋白酶消化后,以每孔3×106个细胞接种于6孔培养板培养,20 h后吸除原培养液,PB3A组加入含100 μg/mLPB3A 的RPMI-1640培养液每孔2 mL,对照组加入相同浓度的DMSO。继续培养24 h后收集两组细胞,采用Trizol试剂提取总RNA,1%琼脂糖凝胶电泳检测完整性,核酸蛋白快速检测仪上检测260、280及230 nm处吸光度,经浓度纯度测定,RNA 纯度 A260/280值均为2.0~1.80,说明纯度好;经1.5%琼脂糖凝胶电泳后,比较28 S和18 S两条核糖体RNA(rRNA)带,显色强度约为2∶1。
1.5 细胞PDE4D及Gadd45GcDNA检测 采用实时荧光定量PCR法。取两组细胞总RNA 0.5 μg,按SYBR Green Real-time PCR试剂盒说明,采用实时荧光定量PCR法合成PDE4D及Gadd45G cDNA。引物序列:β-actin:F:5'-CATCCGTAAAGACCTC TATGCCAAC-3';R:5'-ATGGAGCCACCGATCCACA-3';PDE4D:F:5'-TCAGAGTG GTAAATTGTG TGTGAGA-3';R:5'-GGCAGAATCAACCCATGCTT-3';Gadd45G:F:5'-CGAGTCGGCCAA GTTGATGA-3';R:5'-ACCCGCACGATGTTGATGTC-3'。25 μL 反 应 体系中含 cDNA模板1 μL,SYBR®Premix Ex TaqTM12.5 μL,上游引物 0.6 μL,下游引物 0.6 μL,ddH2O 10.3 μL。PCR 扩增程序:95 ℃ 预变性 3 min;95℃变性10 s,65℃退火30 s,40个循环;72℃延伸45 s,共61个循环,末次延伸72℃、5 min。每次扩增均设标准品组和目的基因组以及2管空白对照组(以ddH2O代替模板)。以β-actin 134 bp作为阳性内参对照,对cDNA模板的细胞拷贝数进行校正。扩增效率为90%~115%。△循环阈值(Ct)=样品 Ct均值 -内参照 Ct均值,ΔΔCT=(CT靶基因-CT内参)PB3A 组 -(CT靶基因-CT内参)对照组;2-ΔΔCT为目的基因的相对总量;2-ΔΔCT>1表示目的基因表达上调,2-ΔΔCT<1 表示基因表达下调。
1.6 细胞干预及PDE4D、Gadd45G蛋白检测 采用蛋白免疫印迹法。待培养的细胞以80%汇合状态时,PB3A组用100 μg/mL的 PB3A干预24 h,对照组不干预。将0.25%胰蛋白酶消化的3×106个细胞用冰冷的PBS冲洗2次,加入RIPA细胞裂解液300 μL,孵育 30 min,12 000 r/min 4 ℃ 离心 15 min,取上清,用BCA法定量总蛋白,每孔上样总蛋白量为50 μg。经12%SDS-PAGE分离Gadd45G蛋白,8%SDS-PAGE分离PDE4D蛋白,4℃时将蛋白质分别于90 V、100 V下转到PVDF膜60 min,用含5% 牛血清蛋白封闭液封闭处理60 min,分别加入一抗(1∶2 000稀释的兔抗人Rb单克隆抗体)4℃过夜;用TBST缓冲液充分漂洗后,加入二抗(1∶3 000稀释)室温反应2 h,辣根酶标记兔抗山羊IgG显色,用Image lab(4.0)软件检测两组Gadd45G和PDE4D与内参β-actin蛋白条带的体积。
1.7 统计学方法 应用SPSS16.0软件行统计学处理。组间比较采用t检验。P<0.01为差异有统计学意义。
2 结果
2.1 细胞形态变化 PB3A干预后24 h,倒置显微镜下见PB3A组细胞培养液混浊,细胞体缩小、变圆、皱缩,并出现折光性减弱的细胞,细胞内出现颗粒状物质;见图1。对照组无明显变化。
2.2 PDE4D及 Gadd45G mRNA表达 PB3A组PDE4D mRNA表达低于对照组(P<0.01),两者差异倍数为0.071;而Gadd45G mRNA表达高于对照组(P <0.01),两者差异倍数为8.11,见图 2。
2.3 PDE4D及 Gadd45G蛋白表达 PB3A组PDE4D蛋白表达低于对照组,Gadd45G蛋白高于对照组(P <0.01),见图3。
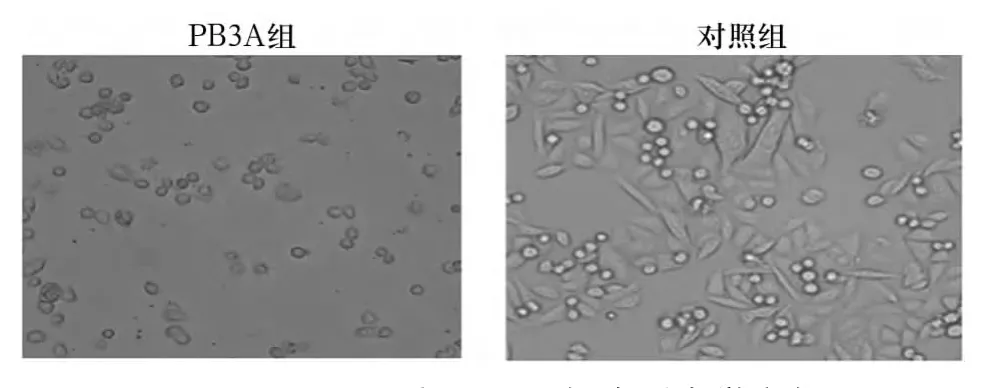
图1 PB3A干预24 h后SW480细胞形态学变化(200×)
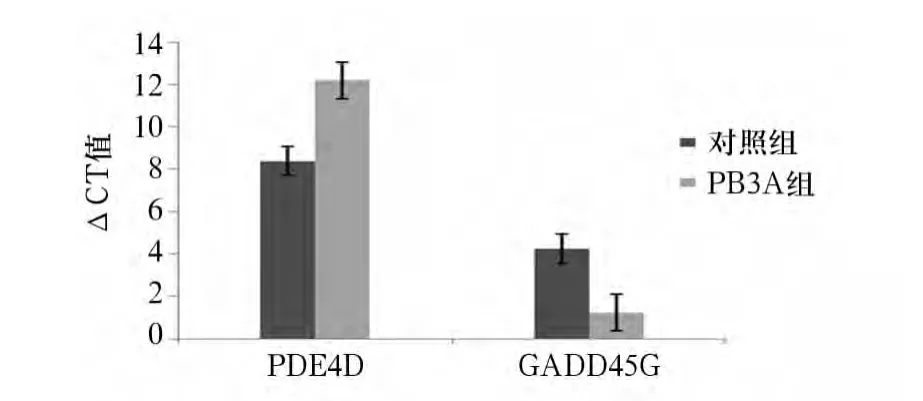
图2 两组PDE4D及Gadd45GmRNA表达

图3 两组PDE4D及Gadd45G蛋白表达
3 讨论
PB3A类具有抗肿瘤、降血脂和机体免疫调节功能等作用,对人体正常细胞和组织几乎没有毒副作用[7],对结肠癌细胞具有抑制增殖及诱导凋亡的作用。PDE4D在人前列腺癌组织和细胞中PDE4D呈过度表达,用短发夹RNA(shRNA)敲除PDE4D后在体外和体内可减少前列腺癌细胞的扩散[3];PDE4D过度表达可促进人肺癌细胞增殖,而PDE4D抑制剂可抑制或沉默PDE4D表达,减少人肺肿瘤细胞的增殖和集落形成[8,9],表明 PDE4D 是一种肿瘤细胞增殖的促进因子。近期研究表明,用shRNA耗尽内源性PDE4D基因可引起乳腺癌、肺癌、卵巢癌、子宫内膜癌、胃癌、黑色素瘤细胞增值抑制和凋亡,但是PDE4D的缺失对相邻正常组织和良性肿瘤几乎没有影响[10];可见PDE4D基因可能是恶性肿瘤的指标基因之一。PB3A可能通过诱导肿瘤细胞增殖的促进因子PDE4D的下调表达而发挥其抗癌活性。
研究发现,Gadd45G基因表达缺失可导致细胞的无限增殖,从而引起肿瘤的形成;相反其过度表达可使减慢体内细胞碱基的摄取速度,抑制细胞形成克隆的能力,从而影响 DNA 的修复[11,12];脑垂体腺瘤[13]、霍奇金淋巴瘤、非霍奇金淋巴瘤、宫颈癌、肺癌和鼻咽癌[14]、胃癌、胰腺癌和结肠癌组织中Gadd45G表达降低,其机制涉及启动子甲基化或转录后修饰的改变[15,16];Gadd45G 可通过激活 c-Jun氮末端激酶途径而诱导细胞发生凋亡[17]。研究发现,人肝癌细胞株HepG2及结肠癌细胞株SW480中Gadd45G mRNA表达增高。提示PB3A可能通过诱导Gadd45G基因的上调表达而抑制结肠癌细胞增殖并促进凋亡。
本研究发现,PB3A组PDE4D mRNA及蛋白表达水平均低于对照组,Gadd45G mRNA及蛋白表达水平均高于对照组。提示两条基因差异表达可能在结肠癌的发生和发展中起重要作用;PB3A可通过诱导PDE4D和Gadd45G基因表达而抑制SW480细胞生长,诱导其凋亡;但其确切的作用机制尚待进一步研究。
[1]热合曼·依米提,大塚靖之,呉暁聞,等.中国産プロポリス中に含まる抗腫瘍活性成分の探索[J].機能性食品と薬理栄養,2005,5(2):17-21.
[2]Gross NJ,Giembycz MA,Rennard SI.Treatment of chronic obstructive pulmonary disease with roflumilast,a new phosphodiesterase 4 inhibitor[J].COPD,2010,7(2):141-153.
[3]刘括,王晋伟,余治平,等.PDE4D基因多态性与缺血性卒中的关联性研究[J].北京大学学报(医学版),2013,45(3):359-363.
[4]Lin DC,Xu L,Ding LW,et al.Genomic and functional characterizations of phosphodiesterase subtype 4D in human cancers[J].Proc Natl Acad Sci USA,2013,110(15):6109-6114.
[5]Zhang W,Li T,Shao Y,et al.S e m i-quantitative detection o f Gadd45G-gamma methylation levels in gastric,colorectal a n d pancreatic cancers using methylation-sensitive high-resolution melting analysis[J].J Cancer Res Clin Oncol,2010,136(8):1267-1273.
[6]张力,杨兆娟,刘永忠.应激蛋白 Gadd45G对人结肠癌细胞增殖影响的研究[J].肿瘤,2013,33(3):207-213.
[7]Suh Y1,Afaq F,Johnson JJ,et al.A plant flavonoid fisetin induces apoptosis in colon cancer cells by inhibition of COX2 and Wnt/EGFR/NFkappaB-signaling pathways [J].Carcinogenesis,2009,30(2):300-307.
[8]Pullamsetti SS,Banat GA,Schmall A,et al.Phosphodiesterase-4 promotes proliferation and angiogenesis of lung cancer by crosstalk with HIF[J].Oncogene,2012,32(9):1121-1134.
[9]Lindstrand A,Grigelioniene G,Nilsson D,et al.Different mutations in PDE4D associated with developmental disorders with mirror phenotypes[J].J Med Genet,2014,51(1):45-54.
[10]Lin DC,Xu L,Ding LW,et al.Genomic and functional characterizations of phosphodiesterase subtype 4D in human cancers[J].Proc Natl Acad Sci USA,2013,110(15):6109-6114.
[11]冯雪凤,王迎伟.DNA损伤修复相关基因Gadd45的研究进展[J].癌变·畸变·突变,2009,21(5):404-407.
[12]Yang ZI,Song L,Huang C.Gadd45 proteins as critical signal transducers linking NF-kappa B to MAPK cascades[J].Curr Cancer Drug Targets,2009,9(8):915-930 .
[13]Scuto A,Kirschbaum M,Buettner R,et al.SIRT1 activation enhances HDAC inhibition-mediated up regulation of Gadd45G by repressing the binding of NF-κB/STAT3 complex to its promoter in malignant lymphoid cells[J].Cell Death Dis,2013,4:635.
[14]Regenbrecht CR,Jung M,Lehrach H,et al.The molecular basis of genistein-induced mitotic arrest and exit of self-renewal in embryonal carcinoma and primary cancer cell lines[J].BMC Med Genomics,2008,1(1):49.
[15]郭炜,朱铁年,董稚明,等.Gadd45G基因在食管鳞癌组织中的异常甲基化及表达[J].肿瘤,2013,33(1):74-80.
[16]Ishida K,Yuge Y,Hanaoka M,et al.Gadd45G regulates dental epithelial cell proliferation through p38 MAPK-mediated p21 expression[J].Genes Cells,2013,18(8):660-671.
[17]曾妍,章程,曲立科,等.肿瘤转移灶克隆形成机制的研究进展[J].肿瘤,2013,33(2):202-206.

