Notch1 siRNA对小鼠恶性黑色素瘤细胞体内外增殖的抑制作用研究
齐艳霞,康世均,刘新会,罗荣城
(南方医科大学中西医结合医院,广州510315)
恶性黑色素瘤(Malignant Melanoma,MM)为恶性程度较高的肿瘤,该病起病隐匿,易转移且病死率高,治疗棘手。研究发现,Notch信号通路不仅对正常细胞的分化起作用,而且可影响肿瘤细胞的增殖、分化及凋亡。Notch1是Notch的4个受体之一,近年来证实其间接参与了黑色素细胞的早期恶变[1]。RNA干扰是由双链RNA引发的诱导转录后基因沉默的过程,能特异性抑制与肿瘤发生发展相关的基因表达。目前靶向Notch1基因小干扰RNA(Notch1 siRNA,以下简称siNotch1),抑制肿瘤细胞生长的作用已在胶质瘤、肾癌、宫颈癌等疾病的研究中得到了证实[2~4]。2013年4~11月,我们观察了对小鼠MM细胞体内外生长的抑制作用。现分析结果,探讨siNotch1治疗MM的可行性。
1 材料与方法
1.1 材料 实验动物:C57BL/6小鼠,雌性,6~8周龄,体质量18~22 g,购自南方医科大学动物实验中心,SPF级环境中饲养;细胞系:小鼠MM细胞株B16F1由美国芝加哥大学孟玉茹教授赠与;主要试剂:PrimeScript®RT reagent试剂盒、SYBR®Premix Ex TaqTM试剂盒购自TaKaRa公司;Notch1及β-actin抗体购自 Santa Cruz公司;Trizol、Lipofectamine2000、Notch1及β-actin引物购自Invitrogen公司;PVDF膜和化学发光液购自 Pierce公司;胎牛血清、高糖DMEM培养基购自美国HyClone公司;siNotch1 Oligo及阴性对照购自上海吉玛生物公司;HRP标记的兔抗山羊二抗试剂盒(PV-9003)购自北京中衫金桥生物公司;MTT试剂盒、DMSO购自Sigma公司。
1.2 体外实验
1.2.1 细胞培养 B16F1细胞株用含10%胎牛血清的高糖DMEM培养液培养,置于37℃、5%CO2的细胞培养箱内,倒置显微镜下观察细胞生长情况,每2~3 d传代一次。
1.2.2 siNotch1的设计与合成 siNotch1的设计合成由上海吉玛生物公司完成,前期从预先设计的6对序列中选出1对作为目的siRNA,序列为:siRNANotch1-mus-4650,正义链:5'-GCAACCUGCAGUGUAAUAATT-3',反义链 5'-UUAUUACACUGCAGGUUGCTT-3'。同时选取与Notch1 mRNA及其他基因均无同源性的siRNA(siNC)作为阴性对照。
1.2.3 细胞瞬时转染 用Lipofectamine2000转染技术转染细胞。转染前1天,消化收集B16F1细胞,接种至6孔板中。第2天,当细胞达30%~50%融合时,分别将siNotch1及siNC转染入B16F1细胞中。细胞转染后于温箱内无血清培养4 h,更换完全培养基,用于后续实验。细胞分为siNotch组、siNC组和只加转染试剂对照的mock组。
1.2.4 细胞Notch1 mRNA及蛋白表达检测 分别采用RT-PCR和Western blot法。转染后24 h,TRIzol提取总 RNA,计算各组 RNA浓度和纯度,总RNA(1μg)在20 μL体系中去除基因组DNA,进行逆转录反应:42 ℃、60 min,95 ℃、5 min,4℃、5 min。荧光定量PCR:将反应管置入LightCycler480 RTPCR 系统中,反应条件为 95℃、30 s,95℃、5 s+60℃、20 s(40个循环),监测荧光信号,相对定量结果参考 ΔΔCT方法计算。Notch1引物正义链:5'-TCAATGTTCGAGGACCAGATG-3',反 义 链:3'-TCACTGTTGCCTGTCTCAAG-5'。转染后72 h采用Western blot法检测各组Notch1蛋白表达:①提取细胞蛋白质采用BCA法定量,计算总蛋白浓度;②蛋白质凝胶电泳后转膜;③室温封闭1 h,加山羊抗小鼠Notch1抗体,4℃孵育过夜,加入二抗,室温孵育1 h;④采用化学发光检测Notch1蛋白表达并进行灰度分析。
1.2.5 细胞克隆形成试验 各组细胞消化后按100个/孔接种于6孔板内,培养14 d,当出现肉眼可见的点状细胞克隆时,终止培养,甲醛固定、干燥、结晶紫染色;显微镜下行克隆计数(≥50个细胞为一个克隆),克隆形成率=形成克隆的数目/接种细胞的数目×100%。
1.2.6 细胞增殖能力检测 各组细胞转染后,以800个/孔接种于96孔板中常规培养,分别于0、24、48、72 h采用MTT法检测细胞增殖能力。检测时每孔按1 mg/mL加入MTT溶液,培养4 h,弃去培养液,每孔加入DMSO 150 μL,酶标仪测定每孔吸光度(OD)值。
1.3 体内实验
1.3.1 小鼠MM 模型制作 将15只C57BL/6雌性小鼠随机分为siNotch组、siNC组及mock组,每组各5只;分别选取相应的转染细胞及未转染的B16F1细胞,于每只小鼠皮下注射100 μL细胞悬液(1×106个/mL)。转染后,观察各组肿瘤生长情况并测量体积(V)。V=(ab2)/2(a为肿瘤长径;b为肿瘤宽径),绘制肿瘤生长曲线。肿瘤体积达100~150 mm3时(细胞接种后第10 d)为维持稳定的转染效果,siNotch组、siNC组注射相应的 siRNA(50 μg ,25 μL/只)或 PBS(25 μL/只),每周 2 次,共 7次。转染后28 d断颈处死小鼠,取肿瘤标本比较各组肿瘤体积。
1.3.2 肿瘤组织病理学观察及Notch1蛋白表达测定 4%多聚甲醛固定上述三组肿瘤组织,常规制成石蜡切片,HE染色观察病理改变;同时切片予脱蜡、水化、抗原修复,免疫组化法观察肿瘤细胞Notch1蛋白表达情况。Notch1表达于细胞质和细胞膜,呈棕黄色染色为Notch1蛋白阳性表达。结果采用双盲法判定,每张切片随机选择5个高倍视野(400×),每个视野计数100个细胞,计算阳性细胞所占百分比。
1.4 统计学方法 采用SPSS13.0统计软件行统计学处理。实验数据采用±s表示,采用单因素方差分析、析因方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 体外实验
2.1.1 细胞Notch1基因及蛋白表达水平 siNotch组、siNC组和mock组 Notch1 mRNA表达水平分别为0.14 ± 0.01、0.96 ± 0.05、1.00 ± 0.03,siNotch组、siNC组显著低于 mock组(F=634.84,P <0.01),siNotch组、siNC组和 mock组 Notch1蛋白表达水平分别为 0.31 ± 0.01、1.00 ± 0.04、1.02 ±0.03,siNotch组、siNC 组显著低于 mock组(F=536.69,P <0.01)。
2.1.2 细胞克隆形成情况 siNotch组、siNC组和mock 组细胞克隆形成率分别为0.16 ±0.02、0.76 ±0.03、0.79 ±0.03,siNotch 组显著低于 siNC 和 mock组(F=504.02,P <0.01)。
2.1.3 细胞增殖能力 从转染的第2天开始,si-Notch组增殖速度显著慢于siNC组和mock组(P<0.01),且细胞增殖受到明显抑制。各组细胞增殖情况见图1。

图1 各组细胞增殖情况
2.2 体内实验
2.2.1 肿瘤生长情况 各组肿瘤生长曲线如图2。由图2可见,siNC组及mock组肿瘤生长曲线较为一致,且生长速度明显快于siNotch组;从转染第17天开始,siNotch组生长速度明显小于另两组(F=24.24,P <0.01)。第 31天处死小鼠测量肿瘤体积,siNotch组、siNC组及mock组肿瘤体积分别为(1 307.95 ± 161.91)、(2 970.68 ± 140.95)和(3 078.99 ±252.26)mm3,siNotch 组显著小于另两组(F=134.74,P <0.01)。
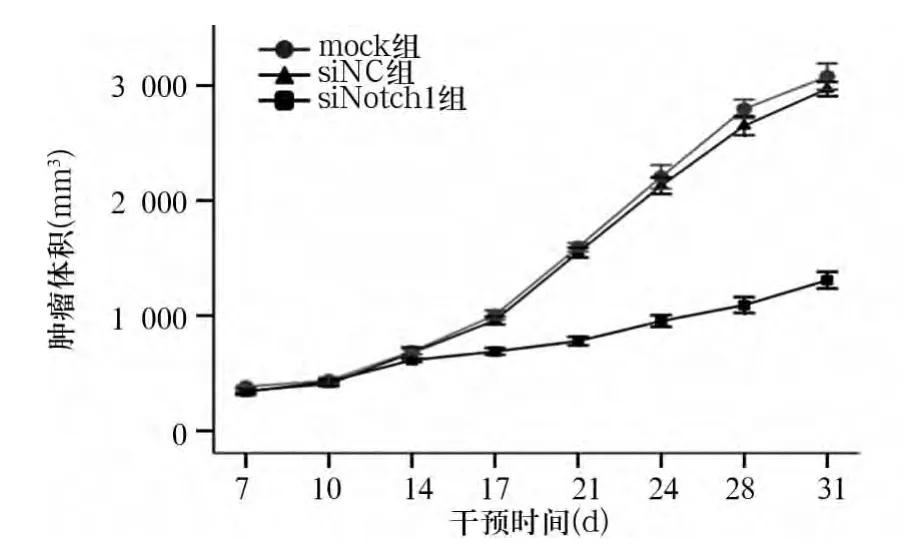
图2 各组肿瘤生长曲线
2.2.2 肿瘤组织病理学变化及Notch1表达 转染后第31天,siNotch组肿瘤组织镜下见多处大片坏死灶,肿瘤细胞异型性不明显,siNC组及mock组肿瘤细胞异型性明显,组织中含丰富的新生血管,坏死灶较少。siNotch组、siNC组及mock组Notchl蛋白阳性细胞百分率分别为41.44% ±6.84% 、87.20%±4.53%、90.36% ±5.25%,siNotch 组明显低于另两组(F=592.78,P <0.01)。
3 讨论
1916年,Morgan 等[5]首次发现 Notch信号蛋白,因其部分丧失功能的突变体可在果蝇翅膀的边缘造成缺口(Notch)而得名,1983年成功克隆出果蝇的Notch基因。研究表明,Notch信号通路与细胞分化和肿瘤的发生发展密切相关,可能扮演着原癌基因的角色。Notch通路激活是通过Notch受体与相邻细胞表面的配体结合,引起Notch受体细胞外结构的改变,导致γ-分泌酶复合体切割,释放Notch受体胞内区(NICD)进入细胞核,NICD与CSL蛋白结合导致共抑制复合物解离,并募集共活化分子MAML1组成共三聚体,从而启动下游基因的转录。在哺乳动物中,Notch是由4个受体(Notch1~Notch4)及5个配体组成,目前已经发现多种人类肿瘤的发生发展与其中的Notch1表达异常有直接关系[6],Massi等[1,7]也证实 Notch1 在人 MM 细胞中呈高表达。为探索治疗MM的新途径,研究者们试图通过多种方法阻断Notch通路,如干扰Notch共活化因子MAML1、阻断其配体与受体的结合等[8],研究较多的γ-分泌酶抑制剂不仅可阻断Notch受体,且可阻断Notch配体以及其他蛋白酶的生理功能,但其有一定毒性[9],临床应用受限。
RNA干扰技术是近年来基因表达调控的研究热点之一,己成为研究基因功能、表达调控及识别复杂调控信号通路的有效工具,在基因治疗中具有很高的应用价值;但其作用时间短,转染的siRNA在细胞中的作用仅能维持5~7 d[10]。为此我们在动物皮下成瘤后每3~4 d进行一次siNotch1瘤内注射,以保证稳定的转染效果。
本研究结果表明,siNotch1转染细胞的增殖能力与克隆形成明显受到抑制,siNotch组肿瘤生长速度明显慢于另两组;免疫组化结果提示,肿瘤细胞生长受抑制程度与肿瘤组织内Notch1蛋白表达受抑制程度呈正相关。证实siRNA干扰技术体内外均可抑制B16F1细胞生长;其作用机制可能为抑制Notch1基因与蛋白表达。Notch1可能是人MM基因治疗的侯选靶点。
[1]Massi D,Tarantini F,Franchi A,et al.Evidence for differential expression of Notch receptors and their ligands in melanocytic nevi and cutaneous malignant melanoma[J].Mod Pathol,2006,19(2):246-254.
[2]Sjolund J,Johansson M,Manna S,et al.Suppression of renal cell carcinoma growth by inhibition of Notch signaling in vitro and in vivo[J].J Clin Invest,2008,118(1):217-228.
[3]Rose SL,Kunnimalaiyaan M,Drenzek J,et al.Notch 1 signaling is active in ovarian cancer[J].Gynecol Oncol,2010,117(1):130-133.
[4]Wang J,Wang C,Meng Q,et al.siRNA targeting Notch1 decreases glioma stem cell proliferation and tumor growth[J].Mol Biol Rep,2012,39(3):2497-2503.
[5]Morgan MM,Mahowald AP.Multiple signaling pathways establish both the individuation and the polarity of the oocyte follicle in Drosophila[J].Arch Insect Biochem Physiol,1996,33(3-4):211-230.
[6]Nickoloff BJ,Osborne BA,Miele L.Notch signaling as a therapeutic target in cancer:a new approach to the development of cell fate modifying agents[J].Oncogene,2003,22(42):6598-6608.
[7]Balint K,Xiao M,Pinnix CC,et al.Activation of Notch1 signaling is required for beta-catenin-mediated human primary melanoma progression[J].J Clin Invest,2005,115(11):3166-3176.
[8]Kang S,Xie J,Miao J,et al.A knockdown of Maml1 that results in melanoma cell senescence promotes an innate and adaptive immune response[J].Cancer Immunol Immunother,2013,62(1):183-190.
[9]Panelos J,Massi D.Emerging role of Notch signaling in epidermal differentiation and skin cancer[J].Cancer Biol Ther,2009,8(21):1986-1993.
[10]Holen T,Amarzguioui M,Wiiger MT,et al.Positional effects of short interfering RNAs targeting the human coagulation trigger Tissue Factor[J].Nucleic Acids Res,2002,30(8):1757-1766.

