PEG4000用量对溶胶-凝胶法制备多孔钛酸锶光催化剂的影响
王 宏,都 玲,孙 欣,张文杰
(沈阳理工大学 环境与化学工程学院,沈阳110159)
光催化氧化技术采用半导体材料为光催化剂,通过光催化氧化还原反应降解有机和无机污染物[1,2]。钙钛矿型多元复合金属氧化物的晶体结构和电子结构具有多样性,具备高的光生载流子移动性,是一种高效光催化材料[3,4]。钛酸锶属于钙钛矿型结构,是一种用途广泛的电子功能陶瓷材料,具有热稳定性好、介电损耗低、介电常数高等特点[5]。此外,钛酸锶具有良好的光催化活性和适宜的禁带宽度(3.2~3.8eV),在光化学电池[6]、光催化分解水制氢[7]、光催化降解有机污染物[8]等领域具有广泛的应用前景。近年来陆续有关于纳米钛酸锶制备新方法的报道[9-14],但在合成条件、晶粒尺寸控制、生产成本等方面还有待于完善,尤其是关于多孔钛酸锶制备方面的研究报道较少。
表面活性剂模板法是制备多孔材料的常见方法,其中应用最多的是非离子表面活性剂。本工作采用溶胶-凝胶法,以钛酸四正丁酯和硝酸锶为主要原料合成钛酸锶光催化剂。在钛酸锶溶胶体系中引入非离子型表面活性剂聚乙二醇PEG4000,探讨表面活性剂的加入量对钛酸锶结构和性能的影响。
1 实验
1.1 钛酸锶的制备
采用溶胶-凝胶法制备多孔钛酸锶。首先将10mL冰醋酸溶于10mL去离子水中,然后分别加入不同量的PEG4000,再按一定摩尔比加入硝酸锶,搅拌均匀后制得溶液A。另取1.7mL钛酸四正丁酯溶入到6.8mL无水乙醇中,搅拌10min后得到淡黄色溶液B。将溶液B滴加到高速搅拌的溶液A中,并滴入少许乙二醇做稳定剂。溶胶前驱体中锶钛原子摩尔比n(Sr)∶n(Ti)=1∶1。随着溶剂不断蒸发,形成溶胶。将溶胶在室温下陈化24h后,在干燥箱内110℃下干燥8h,形成凝胶。将凝胶研磨后在800℃煅烧3h,即可制得多孔钛酸锶粉体。
1.2 催化剂的表征
采用D/max-rB型X射线衍射仪(CuKα射线)测定催化剂的晶体结构;样品表面形貌由S-3400N型扫描电子显微镜测定,样品表面喷金以消除电荷积累;采用WQF-410型傅里叶变换红外光谱仪检测催化剂分子振动光谱;采用MULTILAB2000型X射线光电子能谱仪分析催化剂表面元素状态;N2吸附-脱附测试在F-Sorb 3400型比表面积及孔径分析仪上进行,催化剂的比表面积由BET公式计算。
1.3 光催化反应
通过甲基橙溶液降解率的变化来评价所制备的钛酸锶材料的催化性能。光催化反应光源为主辐射波长253.7nm的20W石英紫外灯。在60mL石英烧杯中加入30mL甲基橙溶液和30mg光催化剂,甲基橙的初始浓度为5mg·L-1,用721E型可见分光光度计在甲基橙的最大吸收波长468nm处测定初始吸光度。首先将溶液在磁力搅拌器上避光搅拌,待吸附平衡后取样5mL,用孔径为0.45μm的微滤膜过滤后测定其吸光度。然后将溶液置于开启的紫外灯正下方,液面距灯高5cm,光照强度为2200μW·cm-2。经光照一定时间后用微滤膜过滤,再次测定吸光度,计算甲基橙溶液的光催化降解率。
根据朗伯-比尔定律[15]计算甲基橙溶液浓度C和脱色率ω:

式中:C0,C1,C2分别表示甲基橙溶液初始、吸附平衡后和光照后的浓度;A0,A1,A2分别表示甲基橙溶液初始、吸附平衡后和光照后的吸光度。
2 结果与讨论
2.1 钛酸锶样品的表征
聚乙二醇PEG分子式为H—(O—CH2—CH2)n—OH,其中的桥氧原子—O—亲水,—CH2—CH2—亲油。通常情况下,聚乙二醇分子属于锯齿形长链,当溶于乙醇时变成曲折形长链。PEG在溶胶-凝胶体系中不仅对颗粒表面有包覆作用,且对溶胶中簇团的交联具有导向作用。由于PEG是高分子添加剂,可经高温煅烧除去,从而在产物中留下丰富的孔洞,形成样品的高孔隙率和高比表面积。

图1 添加不同量PEG4000制备的样品SEM 照片(a)0g;(b)0.5g;(c)1.0g;(d)1.5g;(e)2.0gFig.1 Images of samples with different amounts of PEG4000(a)0g;(b)0.5g;(c)1.0g;(d)1.5g;(e)2.0g
图1是添加不同量PEG4000所制备多孔钛酸锶样品的扫描电镜照片。可以看出,随着PEG4000添加量的增大,颗粒粒径逐渐变小,粉体的细化现象显著。PEG对材料颗粒的包裹作用限制了单个颗粒的长大,且对钛酸四正丁酯的水解具有抑制作用,能够减缓钛酸四正丁酯的水解速率;同时,钛酸四正丁酯的不完全水解会使溶胶中不断地生成小颗粒。小颗粒催化剂的比表面积较大,这有助于提高材料的光催化活性。样品颗粒有一定的团聚,可能是因为在煅烧中发生了烧结所致。
图2是添加了不同量PEG4000所制得样品的XRD图谱。可知,未添加PEG4000的样品主要由Sr2TiO4和少量的锐钛矿相TiO2组成。添加PEG4000后样品中钛酸锶的物相由Sr2TiO4转变成SrTiO3,并且有SrCO3生成。添加PEG4000后样品的XRD图谱与未添加PEG4000样品的图谱相比,衍射最强峰由双峰变成了单峰,Sr2TiO4的衍射峰消失,出现SrTiO3相的衍射峰。随着PEG4000添加量的增大,SrTiO3和SrCO3的特征衍射峰变得越来越尖锐,晶型趋于完整。在PEG4000添加量为1.5g时,Sr-TiO3相的衍射峰强度达到最大。根据Scherrer公式[16]计算,PEG4000添加量分别为0.5,1.0,1.5g和2g时制备的样品中,SrTiO3相(110)晶面的晶粒尺寸分别为22.1,19.9,15.7,10.4nm,PEG4000的添加导致SrTiO3晶粒尺寸下降。

图2 添加不同量PEG4000制备的样品XRD图谱Fig.2 XRD patterns of samples with different amounts of PEG4000
对添加不同量PEG4000制得的钛酸锶样品进行比表面积分析,结果如表1所示。随着PEG4000添加量的增大,样品的比表面积也逐渐变大,当添加量为2g时,多孔钛酸锶的比表面积达到57.0m2·g-1。样品的光催化活性与其表面特性有密切关系,其中比表面积就是一个重要的影响因素。
对添加不同量PEG4000所制备的钛酸锶样品进行红外光谱分析,如图3所示。可知,在2500cm-1之后几乎没有吸收峰出现,表明热处理使有机物基本分解。在1565cm-1附近的吸收峰为OH弯曲振动峰,说明样品中含有少量的吸附水[17]。1062,1174cm-1处的吸收峰是C-O振动峰,1011~1046cm-1的是Sr-O振动峰,842cm-1附近的峰为COOH-与Sr或Ti的结合振动峰。在485cm-1附近出现的吸收峰为Ti-OTi的弯曲振动吸收峰[18]。

表1 添加不同量PEG4000制备的样品比表面积Table1 The specific surface areas of the samples with different amounts of PEG4000

图3 添加不同量PEG4000制备的钛酸锶样品FT-IR图谱Fig.3 FT-IR spectra of strontium titanate samples with different amounts of PEG4000
图4为添加1.5g PEG4000制备的多孔钛酸锶和未添加模板剂制备的钛酸锶XPS Ti2p,Sr3d和O1s谱图。钛酸锶Ti2p的谱图中有2个孤立的对称峰位于458.1eV和463.8eV,分别对应着Ti2p3/2和Ti2p1/2,其峰距为5.7eV,在标准值范围内(5.6~5.7eV)。这表明Ti处在一个八面体环境中,主要以Ti4+的形式存在[19,20]。由Sr3d的XPS 谱图知,Sr-TiO3的Sr3d5/2和S3d3/2分 别对应 着 135.7eV和134.4eV 两个结合能峰,峰距为1.3eV[21]。当加入PEG4000后,多孔钛酸锶Sr3d结合能峰为134.7,134.1,133.4eV 三个响应峰。134.7eV和133.4eV分别对应 Sr3d3/2和S3d5/2,峰距没有变化。134.1eV对应SrCO3中Sr的结合能峰[22],XRD分析也指出此时样品中有SrCO3生成。添加PEG4000后,Sr3d的结合能峰向低能端偏移,表明SrCO3的生成影响到SrTiO3中Sr的结合能。O1s结合能峰可以分为529.3eV和531.4eV 两个响应峰,529.3eV对应于SrTiO3中O的结合能,531.4eV对应于Sr2TiO4中O的结合能[21]。未添加PEG4000样品中531.4eV处的峰强度明显强于529.3eV处的结合能峰,而多孔样品中529.3eV结合能峰明显增强,531.4eV结合能峰强显著减弱。这说明钛酸锶物相发生转变,添加PEG4000后钛酸锶由Sr2TiO4相转变为SrTiO3相。多孔样品中钛酸锶主要以SrTiO3存在,并且有少量的SrCO3生成,这与XRD分析结果一致。

图4 添加1.5g PEG4000制备的多孔钛酸锶和未添加PEG4000制备的钛酸锶XPS谱图(a)Ti2p;(b)Sr3d;(c)O1sFig.4 XPS spectra of porous strontium titanates with 1.5g PEG4000and strontium titanate without PEG4000(a)Ti2p;(b)Sr3d;(c)O1s
2.2 光催化活性
图5为PEG4000添加量对多孔钛酸锶样品光催化活性的影响。由XRD结果已知,未添加PEG4000制备的样品主要由Sr2TiO4和少量的锐钛矿相TiO2组成,添加模板剂后钛酸锶的物相由Sr2TiO4转变为SrTiO3,TiO2相逐渐消失。当PEG4000的添加量为1.5g时,SrTiO3相的衍射峰强度最大,结晶性最好,样品的光催化降解活性达到最大,说明SrTiO3是样品中主要的活性物质。经30min光照后,甲基橙在未添加PEG4000样品上的降解率为32.5%,而在添加1.5g PEG4000制备的多孔样品上的降解率达到40%。随着PEG4000添加量的继续增加,一方面,样品粉体细化,比表面积增大;另一方面,SrTiO3晶粒尺寸随之下降,说明其结晶情况变差。尽管添加2.0g PEG4000的样品具有更大的比表面积,其光催化活性却有较明显的降低。
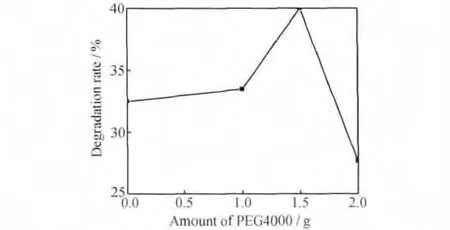
图5 PEG4000添加量对样品光催化活性的影响Fig.5 Effect of PEG4000amount on photocatalytic activity of the samples
添加1.5g PEG4000制备的多孔样品光催化剂用量与其降解活性之间的关系如图6所示。可知,甲基橙的降解率随着多孔钛酸锶添加量的增加而增大。当添加量增加到1g·L-1时,甲基橙的降解率明显增大,随后增长趋势变缓。在催化剂颗粒较小的情况下,过多的催化剂颗粒会因团聚而减少其在溶液中的分散程度,同时悬浮的颗粒也会阻挡下层光催化剂对入射光的吸收,不能充分发挥其降解活性。

图6 多孔光催化剂用量对甲基橙降解率的影响Fig.6 Effect of dosage of porous photocatalyst on degradation rate of methyl orange
图7对比了经过不同光照时间时,添加与未添加模板剂制备的钛酸锶样品的光催化和吸附活性。可知,二者对甲基橙的吸附率差别不大,但光催化反应活性有明显差异。随着光催化时间的延长,甲基橙在两个样品上的降解率都逐渐升高。当光催化时间为120min时,甲基橙在添加PEG4000的多孔样品上的降解率为97.9%,明显高于未添加PEG4000的样品(78.0%)。
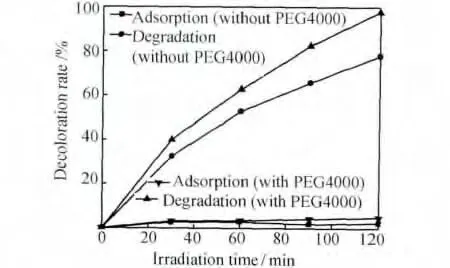
图7 光照时间对甲基橙吸附和降解的影响Fig.7 Effect of irradiation time on adsorption and degradation of methyl orange
3 结论
(1)PEG4000模板剂的加入,使钛酸锶材料的比表面积显著增加,样品颗粒粒径和SrTiO3相的晶粒尺寸随着PEG4000添加量的增大而下降。
(2)添加PEG4000后样品中钛酸锶的物相由Sr2TiO4转变成SrTiO3。
(3)添加PEG4000前后样品对甲基橙的吸附率变化不大。经过120min光照,甲基橙在添加PEG4000的多孔样品和未添加PEG4000样品上的降解率分别为97.9%和78.0%。
[1]HOFFMANN M R,MARTIN S T,CHOI W,et al.Environmental applications of semiconductor photocatalysis[J].Chemical Review,1995,95(1):69-96.
[2]FUJISHIMA A,RAO T N,TRYK D A.Titanium dioxide photocatalysis[J].Journal of Photochemistry and Photobiology C:Photochemistry Reviews,2000,1(1):1-21.
[3]ENG H W,BARNES P W,AUER B M,et al.Investigations of the electronic structure of d0transition metal oxides belonging to the perovskite family[J].Solid State Chemistry,2003,175(1):94-96.
[4]KATO H,KUDO A.Energy structure and photocatalytic activity for water splitting of Sr2(Ta1-xNbx)2O7solid solution[J].Journal of Photochemistry and Photobiology A:Chemistry,2001,145(1-2):129-132.
[5]SBAOLSKY E M,JMAE A R,KOWOM S,et al.Piezoelectric porperties of(001)textured Pb(Mgl/3Nb2/3)O3-PbTiO3[J].Applied Physics Letters,2001,78(17):2551-2553.
[6]AKUTO K,SAKURAI Y.Photochargeable metal hydride/air battery[J].Journal of Electrochemical Society,2001,148(2):121-125.
[7]AVUDAITHAI M,KUTTY T R N.Ultrafine powders of Sr-TiO3from the hydrothermal preparation and their catalytic activity in the photolysis of water[J].Materials Research Bulletin,1987,22(5):641-650.
[8]KATO H,KUDO A.Visible-light-response and photocatalytic activities of TiO2and SrTiO3photocatalysts codoped with antimony and chromium[J].Journal of Chemical Physics B,2002,106(19):5029-5034.
[9]ZHANG S C,LIU J X,HAN Y X,et al.Formation mechanisms of SrTiO3nanoparticles under hydrothermal conditions[J].Materials Science and Engineering B,2004,110(1):11-17.
[10]LIU H X,SUN X Q,ZHAO Q L,et al.The syntheses and microstructures of tabular SrTiO3crystal[J].Solid-State Electron,2003,47(12):2295-2298.
[11]WANG J S,YIN S,KOMATSU M,et al.Preparation and characterization of nitrogen doped SrTiO3photocatalyst[J].Journal of Photochemistry and Photobiochemistry A:Chemistry,2004,165(1-3):149-156.
[12]WANG X W,ZHANG Z Y,ZHOU S X.Preparation of nanocrystalline SrTiO3powder in sol-gel process[J].Materials Science and Engineering B,2001,86(1):29-33.
[13]SELVARAJ U,ALAMANDA V,SRIDHAR K,et al.Sol-gel processing of oriented SrTiO3thin films[J].Materials Letters,1995,23(1-3):123-137.
[14]POHT J,HABERKOM R,BECK H P.Combustion-synthesis of SrTiO3[J].Journal of European Ceramic Society,2000,20(6):707-713.
[15]华中师范大学.分析化学上册[M].北京:高等教育出版社,2005.277-284.Cental China Normal University.Analytical Chemitry,First Volume[M].Beijing:Higher Education Press,2005.277-284.
[16]ZHANG W J,YU Y,BI F F,et al.Calcination effects on properties of TiO2/HZSM-5photocatalyst using pretreated HZSM-5 support[J].Journal of Advanced Oxidation Technologies,2013,16(1):198-205.
[17]SCHWARZ A,HARTIG K J,GETOFF N.Diffusion controlled photocurrent transients at the surface of thin polycrystalline n-TiO2layers[J].International Journal of Hydrogen Energy,1988,13(2):81-86.
[18]PARIDA K M,SAHU N.Visible light induced photocatalytic activity of rare earth titania nanocomposites[J].Journal of Molecular Catalysis A,2008,287(1-2):151-158.
[19]CHEN X Q,ZHANG X W,LEI L C.Electronic structures and photocatalysis properties under visible irradiation of F-doped TiO2nanotube arrays[J].Journal of Inorganic Material,2011,26(4):369-374.
[20]POUILLEAU J,DEVILLIERS D,GROULT H,et al.Surface study of a titanium-based ceramic electrode material by X-ray photoelectron spectroscopy[J].Journal of Materials Science,1997,32(21):5645-5651.
[21]LIU S Z,WANG T X,YANG L Y.Low temperature preparation of nanocrystalline SrTiO3and BaTiO3from alkaline earth nitrates and TiO2nanocrystals[J].Powder Technology,2011,212(2):378-381.
[22]WANG K,JI S F,SHI X J,et al.Autothermal oxidative coupling of methane on the SrCO3/Sm2O3catalysts[J].Catalysis Communication,2009,10(6):807-810.

