PC-1解除S6K对AKT信号通路的负反馈抑制
张晓清 ,王健,王洪涛,李山虎,王芃,黄芳,洪鎏,邓楚中,周建光
1.军事医学科学院 生物工程研究所,北京 100850;2.贵阳医学院,贵州 贵阳 550004
前列腺癌是男性生殖系统常见恶性肿瘤之一,在欧美国家其发病率居首位,死亡率高居第二位[1]。PC-1/PrLZ基因是癌基因D52家族成员,其在雄激素非依赖性前列腺癌C4-2 细胞中高表达而在雄激素依赖性LNCaP 细胞中低表达,且随着前列腺癌分级的增加表达上升[2-3]。研究发现,PC-1 可以激活PI3K/AKT 信号通路,进而抑制雄激素,剥夺对前列腺癌细胞的凋亡诱导作用[4-5]。PI3K/AKT 信号通路可以通过调节细胞凋亡、细胞增殖、促进血管生成和肿瘤发育等促进前列腺癌雄激素非依赖进展,而PC-1如何激活该信号通路还不清楚。
我们利用慢病毒系统建立了过表达和干扰PC-1表达的前列腺癌细胞模型,在此基础上发现PC-1可以抑制mTOR 激酶信号通路下游分子S6K 的活性,进而解除了S6K对AKT的负反馈抑制功能,从而激活AKT激酶的活性。
1 材料与方法
1.1 材料
293T、LNCaP 及C4-2 细胞,大肠杆菌DH5α,PC-1基因真核表达质粒pCDNA-HA-PC-1,慢病毒包装辅助质粒由本室保存;DMEM 及RPMI1640培养基购自GIBCO 公司;优等胎牛血清(FBS)为Hyclone公司产品;慢病毒过表达载体pCDH-EF1-Myc-MCS-T2A-Puro和干扰表达载体pSIH1-H1-Puro 由金蕊博士馈赠;限制性内切酶、Pfu酶和DNA 连接酶购自TaKaRa 公司;质粒提取、胶回收和PCR 回收试剂盒,转染试剂VigoFect 均为维格拉斯公司产品;聚凝胺(Polybrene)、嘌呤霉素购自Santa Cruz 公司;PC-1 多克隆抗体由本室自制;γ-tubulin 及抗S6Kp389、S6K、AKT、p308-AKT 抗体购自Cell Signaling公司;蛋白酶抑制剂购自Sigma 公司;雷帕霉素、RAD001和AG1024购自Selleck公司。
1.2 短发夹RNA(shRNA)慢病毒重组质粒的构建与鉴定
PC-1的shRNA 靶点为GCTATCTCTACTTGTC TCC,以此设计shRNA 正义链序列(5'-GATCCGCT ATCTCTACTTGTCTCCCTTCCTGTCAGAGGAGACA AGTAGAGATAGCTTTTTG-3')和反义链序列(5'-AATTCAAAAAGCTATCTCTACTTGTCTCCTCTGAC AGGAAGGGAGACAAGTAGAGATAGCG-3')。用BamHⅠ和EcoRⅠ双酶切shRNA 表达载体pSIH1-H1-Puro,回收后与退火的PC-1shRNA 片段连接,构建PC-1shRNA 慢病毒重组质粒,转化大肠杆菌DH5α感受态细胞,挑取阳性克隆送上海英骏生物技术公司测序鉴定。
1.3 PC-1过表达慢病毒重组质粒的构建
PC-1基因正向引物为5'-ACGGATCCGATTGT AGAGAGATGGAC-3',反向引物为5'-GAGCGGCC GCCAGGCTCTCCTGTGTCTT-3'。以pcDNA-HAPC-1 为模板,PCR 扩增并切胶回收PC-1基因DNA片段;分别将载体pCDH-EF1-Myc-MCS-Puro和PC-1回收片段用BamHⅠ/NotⅠ于37℃双酶切12 h,酶切产物切胶回收后于16℃连接12 h,转化大肠杆菌DH5α感受态细胞,挑取单克隆提取质粒,用BamHⅠ/NotⅠ双酶切鉴定。
1.4 慢病毒的包装
适量293T 细胞接种于100 mm 培养皿,约24 h后转染,包装4种质粒慢病毒,即PC-1shRNA、其对照载体pSIH1-H1-Puro、过表达PC-1载体和对照载体pCDH-EF1-Myc-MCS-Puro。将4 种质粒分别与3 个包装质粒(REV,VSVG,RRE)在空白DMEM 中混合,加入VigoFect 转染试剂混匀后室温静置20 min,分别加入4 皿细胞培养液中,37℃孵箱培养12 h 后,换成含10% FBS 的RPMI1640 培养液,48 h 后收集上清,经0.45μm 滤膜过滤即得包装好的病毒,直接加到待感染细胞中或于-80℃保存。
1.5 前列腺癌细胞系的建立
接种LNCaP、C4-2细胞于100 mm 培养皿中,用含10% FBS 的RPMI1640 培养液培养,24 h 后加入包装好的含有过表达PC-1及其对照载体、敲低PC-1表达及其对照载体的4种病毒液,同时加入终浓度为5μg/mL 的Polybrene,病毒感染10 h 后换成普通培养液,48 h后传代,传代时培养液里加入2μg/mL嘌呤霉素筛选,进一步培养鉴定。
1.6 Western印迹分析
收集细胞,提取总蛋白,将蛋白提取液与5×SDS上样缓冲液以4∶1 的体积比混匀,煮沸10 min 后离心,取样进行SDS-PAGE 后,电转移至硝酸纤维素膜上;将膜用5%脱脂奶粉于室温封闭30 min;加入所需一抗于室温孵育1 h 或4℃过夜后,TBST 洗膜3次,每次7 min;用相应的二抗孵育后,洗膜3 次,每次5 min;用化学发光法压片显影。
2 结果
2.1 建立过表达PC-1 的LNCaP 稳定细胞系及敲低PC-1表达的C4-2稳定细胞系
包装慢病毒后分别感染前列腺癌LNCaP和C4-2 细胞,嘌呤霉素筛选后收集细胞,提取总蛋白,Western 印迹检测细胞内PC-1 的表达水平,结果见图1。相对于各自对照细胞,LNCaP 细胞中的PC-1蛋白表达水平明显上升,而感染PC-1shRNA 慢病毒C4-2 细胞中的PC-1 蛋白表达水平明显下降,表明稳定细胞系构建成功。
2.2 PC-1抑制前列腺癌细胞中S6K激酶的活性
为检测PC-1 是否影响AKT 信号通路下游mTOR信号通路活性,我们检测了细胞内S6K-p389、70S6K 表达水平。结果表明LNCaP 细胞中PC-1 过表达对总蛋白表达水平没有影响,但抑制其磷酸化水平(图2A);在C4-2细胞中,敲低PC-1表达使S6K磷酸化水平上升(图2B),对总蛋白水平没有影响。提示PC-1能够调控S6K激酶的活性。
为进一步证实这一结果,我们用不同浓度的mTOR 抑制剂雷帕霉素平行处理这4 种细胞,24 h后提取细胞总蛋白进行Western 印迹检测。结果显示(图2C),雷帕霉素呈剂量效应型抑制S6K-p389水平;而PC-1 高表达能够增强雷帕霉素对S6Kp389 的抑制作用,敲低PC-1 表达能够抑制雷帕霉素对S6K-p389的抑制作用。进一步表明PC-1能够抑制前列腺癌细胞中S6K激酶的活性。
2.3 PC-1 解除S6K 激酶对AKT 激酶活性的负反馈抑制
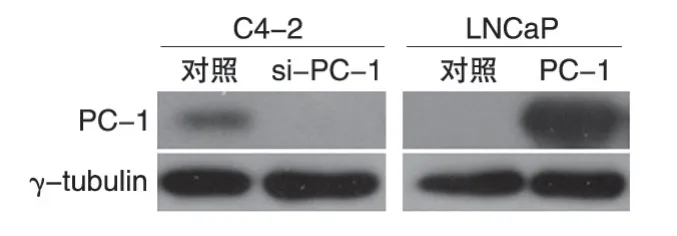
图1 PC-1过表达及敲低表达前列腺癌稳定细胞系的鉴定
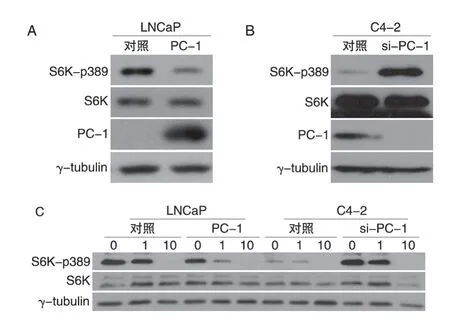
图2 PC-1调控前列腺癌细胞中S6K激酶的活性
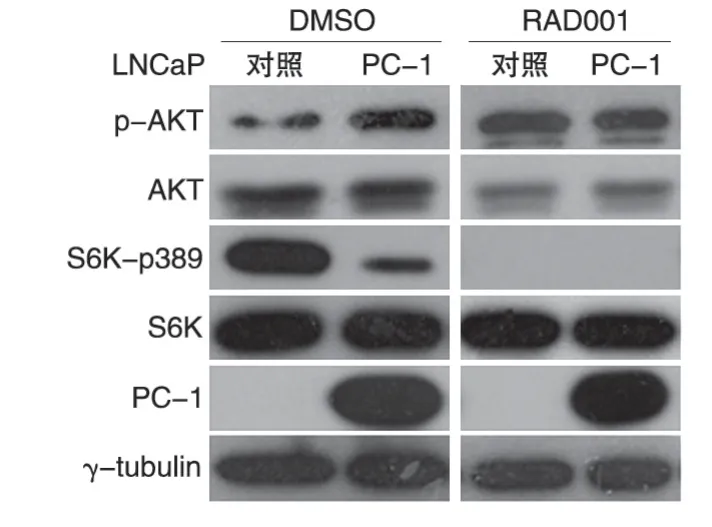
图3 PC-1解除S6K负反馈调控AKT信号通路
LNCaP、LNCaP-PC-1 细胞中S6K和AKT 磷酸化水平检测结果见图3。PC-1过表达时S6K 磷酸化水平下降,而AKT的磷酸化水平上升;当用mTOR抑制剂RAD001 处理细胞完全抑制S6K 的活性后,PC-1过表达和对照细胞中AKT 的磷酸化水平相当。提示PC-1可能通过抑制S6K 活性,解除S6K 对AKT 激酶活性的负反馈抑制作用,进而上调AKT活性。
3 讨论
AKT信号通路在肿瘤细胞中异常激活导致细胞的表型恶性转化,mTOR 蛋白激酶是PI3K/AKT 信号通路下游的重要组分。mTOR 信号通路主要包含2个蛋白复合体mTORC1和mTORC2。mTORC1 通过调控它的2 个底物分子S6K和4E-BP1 来调控细胞的大小和蛋白质翻译;mTORC2 参与了对AKT 第473氨基酸残基的磷酸化调控[6-7]。
mTOR 依赖的S6K 磷酸化激活参与了蛋白质的翻译起始和延伸,但该分子的激活又启动了一条负反馈通路抑制AKT 信号通路活性[8]。我们首先发现过表达PC-1 在前列腺癌细胞中能够激活AKT 信号通路,同时能抑制S6K 的磷酸化水平,提示PC-1 可能解除了S6K对AKT活性的负反馈抑制作用。雷帕霉素及其衍生物RAD001 是mTOR 信号通路的有效抑制剂,能抑制其下游底物分子如S6K 的活性。用RAD001 处理PC-1 过表达及对照LNCaP 细胞,当S6K 活性被完全抑制后,PC-1 对AKT 激酶的激活作用消失,提示PC-1对S6K 激酶活性的调控参与了其对AKT活性的调控。
本研究表明PC-1 通过抑制mTOR 信号通路下游分子S6K 激酶的活性,解除了S6K 对AKT 信号通路的负反馈抑制,从而激活AKT 信号通路。这一结果揭示了PC-1激活AKT活性的可能分子机制。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2008[J].CA Cancer J Clin,2008,58:71-96.
[2]Wang R,Xu J,Saramaki O,et al.PrLZ,a novel prostate-specific and androgen-responsive gene of the TPD52 family,amplified in chromosome 8q21.1 and overexpressed in human prostate cancer[J].Cancer Res,2004,64:1589-1594.
[3]Wang R,Xu J,Mabjeesh N,et al.PrLZ is expressed in normal prostate development and in human prostate cancer progression[J].Clin Cancer Res,2007,13:6040-6048.
[4]Zhang H,Wang J,Pang B,et al.PC-1/PrLZ contributes to malignant progression in prostate cancer[J].Cancer Res,2007,67:8906-8913.
[5]Zhang D,He D,Xue Y,et al.PrLZ protects prostate cancer cells from apoptosis induced by androgen deprivation via the activation of Stat3/Bcl-2 pathway[J].Cancer Res,2011,71:2193-2202.
[6]Guertin D A,Sabatini D M.Defining the role of mTOR in cancer[J].Cancer Cell,2007,12:9-22.
[7]Sarbassov D D,Guertin D A,Ali S M,et al.Phosphorylation and regulation of Akt/PKB by the rictor-mTOR complex[J].Science,2005,307:1098-1101.
[8]Harrington L S,Findlay G M,Gray A,et al.The TSC1-2 tumor suppressor controls insulin-PI3K signaling via regulation of IRS proteins[J].J Cell Biol,2004,166:213-223.

