霍乱弧菌中环腺苷酸受体蛋白对高丝氨酸脱氢酶基因的调控作用
蔡红艳 ,陈保立,梁未丽,王多春,李杰,段国贤,阚飙
1.河北联合大学 基础医学院,河北 唐山 063000;2.山东省疾病预防控制中心,山东省传染病预防控制重点实验室,山东 济南 250014;3.中国疾病预防控制中心 传染病预防控制所,传染病预防控制国家重点实验室,北京 102206
细菌中的环腺苷酸受体蛋白(cAMP receptor protein,CRP)是一种全局性调控因子,最早在大肠杆菌分解代谢产物阻遏过程中被鉴定出[1]。CRP 与cAMP 形成cAMP-CRP 聚合体后与启动子上游保守序列TGTGA-(N6)-TCACA 结合,从而调控基因的转录[1-2]。在大肠杆菌中CRP 的调控作用已经得到较深入的研究,已发现至少有378 个基因受到CRP的调控[3],转录组分析数据表明CRP 对碳源核心代谢通路上的酶及转运载体的转录有调控作用[4]。霍乱弧菌CRP 的基因和蛋白序列与大肠杆菌的CRP分别有81%和95%的一致性[5-6],这提示CRP 在霍乱弧菌与大肠杆菌中有着相似的作用。CRP在霍乱弧菌中功能的研究主要集中在其对毒力基因的调控上,如CRP 调控霍乱毒素和菌素共调节菌毛基因的转录[7]、调控血凝素/蛋白酶的产生[8]。另外,CRP 还影响密度感应系统及霍乱弧菌在肠道中生存所必需基因的转录[9]。
我们曾利用表型芯片检测、转录水平分析、调控蛋白结合DNA 调控区的实验方式,分析了霍乱弧菌中CRP 对不同碳源利用的调节作用,找到24 种被CRP 调控利用的碳源,其中11 种未在细菌中见到受CRP 调控的报道[10]。其中,发现参与L-天冬氨酸代谢的VC0391(编码天冬氨酸激酶,aspartokinase isozymes,AK)和VC2364(编码高丝氨酸脱氢酶,homoserine dehydrogenase,HDH)基因受CRP 的调控。天冬氨酸是一种α-氨基酸,其异构物L-天冬氨酸是20种蛋白氨基酸之一。天冬氨酸代谢通路广泛存在于植物及微生物中,涉及的步骤及参与的酶均比较保守。在大肠杆菌中,天冬氨酸在AK的作用下生成磷酸化天门氨酰。共有3 类AK,其中AKⅠ和AKⅡ是双功能酶,酶的活性分别受到苏氨酸和甲硫氨酸的反馈抑制;AKⅢ为单功能酶,受到赖氨酸的反馈抑制。磷酸化天门氨酰在天冬氨酸-β-半醛脱氢酶(aspartate-β-semialdehyde dehydrogenase,ASADH)的作用下生成天冬氨酸-β-半醛,而后在HDH 的作用下生成高丝氨酸,进而生成甲硫氨酸、苏氨酸和异亮氨酸,或者在二氢吡啶二羧酸合成酶(dihydrodipicolinate synthase)的作用下生成四氢吡啶二羧酸,进而生成赖氨酸。
我们的前期研究证实,参与L-天冬氨酸代谢的VC0391基因启动子区与CRP 直接结合,虽看到CRP对编码HDH 的VC2364 基因的调控效果,但未发现VC2364 基因调控区典型的CRP 结合位点及CRP 的直接结合作用[10]。在本研究中,我们进一步分析了CRP对VC2364基因的调控作用,发现将霍乱弧菌中VC2364 基因启动子区非典型的CRP 结合序列该造为典型序列后,增强了受CRP 调控的作用,显示原VC2364基因序列能促使CRP的弱调控,提示霍乱弧菌中可能存在的受CRP精细调节的作用。
1 材料和方法
1.1 材料
菌株与质粒见表1。大肠杆菌与霍乱弧菌在LB培养基中于37℃培养,培养基中加入合适的抗生素。大肠杆菌培养所加氯霉素(Cm)终浓度为10 mg/mL;霍乱弧菌所加Cm 终浓度为2 mg/mL,多黏菌素B终浓度为0.1 U/mL。
PCR 产物纯化试剂盒、质粒提取试剂盒、琼脂糖凝胶回收试剂盒购自Omega 公司;DNA 提取试剂盒、PCR 扩增用2×Pfumaster Mix 购自天根公司;限制性内切酶、T4DNA 连接酶购自TaKaRa 公司;酶联检测仪Infinite M200 Pro 购自Tecan 公司;细胞培养板购自Corning 公司;PCR 仪、电泳仪、电泳槽、凝胶成像仪购自Bio-Rad 公司;生物安全柜Forma ClassⅡ,A2,购自Thermo公司。
1.2 CRP结合位点预测与搭桥PCR
分别用Virtual Footprint[11]和Regulatory Sequence Analysis Tools(RSAT)[12]软件预测可能的CRP 结合位点。为了将VC2364 基因的启动子序列中与CRP 结合位点保守序列不一致的3 个碱基替换成保守序列,我们在预测碱基位点上下游500 bp 同源臂处设计引物P1、P2、P3、P4,通过P2、P3 的设计将不一致的序列置换为CRP 保守序列。在引物P2、P3 的5'端各取10 个碱基反向互补,将P2 反向互补序列加在P3 的5'端,P3 反向互补序列加在P2 的5'端,并在P1、P4 引物的5'端加上酶切位点与保护碱基。以C7258 基因组DNA 为模板,分别以引物P1、P2和P3、P4 扩增得到同源臂,将扩增得到的2 个PCR 产物片段按1∶1 的比例混合后纯化回收,以纯化回收的PCR 产物为模板,用引物P1、P4 进行搭桥PCR 扩增,得到上下游同源臂搭桥序列片段。引物序列见表2。
1.3 质粒的构建
未改造的PCR 产物、搭桥PCR 产物、pBBRlux 质粒分别用PvuⅠ和SacⅠ双酶切后切胶回收,酶切产物用T4DNA 连接酶连接1 h,取5μL 转入100μL大肠杆菌DH5α感受态细胞中,冰浴30 min,42℃热激90 s,加入1 mL液体LB,37℃摇床振摇40 min后离心,取100μL液体涂布于含Cm的平板培养基上,待长出菌落后,挑取50 个菌落用pBBRlux-PvUⅠ、pBBRLux-BamHⅠ引物进行PCR扩增、测序,挑取阳性菌落,将构建成功的质粒命名为pvc2364-lux、pvc2364s-lux。

表1 研究使用的菌株与质粒
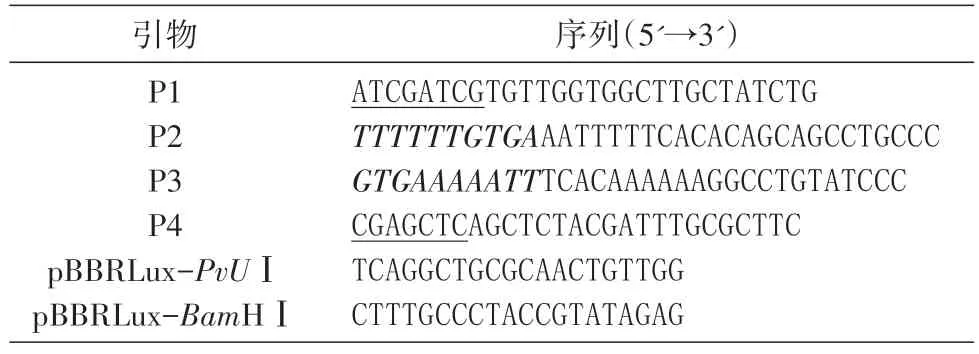
表2 质粒构建所用引物及序列
1.4 接合转移
将质粒pvc2364-lux、pvc2364s-lux 分别转 入SM10 供体菌、受体菌(C7258、WL7258),各取0.6 mL 菌液混合,5000 r/min 离心5 min,弃上清,用1 mL LB 悬菌后再次离心,弃上清,用80μL LB 悬菌,将菌液点到高压灭菌并平贴于LB 平板上的0.45μm 的微孔水系滤膜上,菌液吸收后于37℃温箱中培养4~6 h,用LB 冲洗滤膜,收集洗液,离心后沉淀重悬于适量LB,涂布于质粒所带抗性多黏菌素B和霍乱弧菌所带抗性Cm 的培养基平板,37℃培养过夜。
1.5 荧光值的测定
将含有pvc2364-lux,pvc2364s-lux 质粒的霍乱弧菌活化过夜,接种于含Cm和多黏菌素B 的5 mL液体培养基中,第2 d 按1/1000 的比例转接到2 mL无菌LB 中,37℃振荡培养,到一定时间分别取200μL 菌液转移到96 孔板中,于Tecan Infinite M200 Pro酶标仪中检测荧光值,同时在该仪器中测定菌浊度(D600nm值),以时间点为横坐标、荧光值/D600nm为纵坐标,得到光值曲线。
2 结果
2.1 CRP结合位点预测
分别用Virtual Footprint和RSAT 软件预测基因VC2364 上游是否有CRP 可能的结合位点。Virtual Footprint预测结果显示VC2364基因上游431~452处有可能的CRP 结合位点,与保守序列有7 个位点一致;RSAT 未预测到VC2364 上游有CRP 可能的结合位点。
2.2 质粒构建
用搭桥PCR 的方法,将VC2364 基因启动子上游序列中与CRP 结合位点保守序列不一致的3 个碱基替换成保守序列,未改造的序列经PCR 扩增后与pBBRlux 连接并导入感受态大肠杆菌DH5α,挑取PCR 扩增阳性的菌落,提取质粒进行酶切验证,选取酶切条带大小合适的质粒测序,结果显示构建的报告质粒正确。图1为改造前与改造后的序列对比。
2.3 报告质粒在不同菌株中荧光值的测定

图1 基因VC2364启动子CRP结合位点碱基的改造
质粒pBBRlux 利用luxCDABE 基因作为报告基因,其荧光表达需要借助插入的启动子。将VC2364基因启动子上游可能的CRP结合位点原始序列和改造序列构建到报告质粒pBBRlux 中,检测报告质粒pBBRlux 在C7258 与WL7258 菌株中的荧光值,发现改造的质粒在C7258 株中的荧光值高于未改造的,在WL7258 株中的差异更明显。另外,序列改造与未改造的质粒在CRP野生株C7258中的荧光值均高于CRP突变株WL7258中。见图2。
3 讨论
本研究论证了细菌中CRP调控单元中一个CRP结合位点序列的特殊例子。我们在分析CRP对霍乱弧菌碳源代谢的影响中,发现了多种碳源的代谢受到CRP 调控,参与L-天冬氨酸代谢的VC2364 基因在转录水平上受CRP 的调控,但其启动子区未发现典型的CRP结合位点序列。CRP与启动子区保守序列TGTGA-(N6)-TCACA 结合从而调控基因的转录,软件预测发现在VC2364基因启动子区上游有可能的CRP 结合位点AGCGC-(N6)-TCACA,因此这是一个不典型的CRP 结合序列,与典型序列相比有7个碱基序列一致。但从前期研究结果来看,这7个碱基序列很可能已促进了CRP的结合和调控。为了阐明CRP 是否直接调控VC2364 的转录,我们利用报告质粒比较了其启动子在CRP野生株和缺失株中的转录表达,发现在野生株中VC2364启动子序列启动的表达是受CRP 调节的,因为其在CRP 野生株中的表达高于在CRP缺失株中。这是对我们前期研究结果的确认。我们也看到,在缺失株中也有启动子序列启动的表达,这说明该启动子同时受到其他因素的调控。

图2 报告质粒在CRP野生株C7258及其突变株WL7258中荧光值的差异
CRP 识别调控区的典型结合位点序列是TGTGA-(N6)-TCACA,在VC2364 基因前面仅有7 个碱基与经典结合位点一致,为此我们改构了VC2364启动子区的该区域序列,使其形成典型的CRP 结合位点。实验测定证实,改造为典型CRP结合序列后,启动子受CRP 的作用大为增强,改造序列在CRP 缺失株中的荧光变化不大,但在野生株中明显增强,而且改造的启动子在CRP 野生株中,其促进表达的荧光也超过了VC2364的野生型启动子的作用。因此,这些结果提示,VC2364启动子区非典型的CRP结合序列AGCGC-(N6)-TCACA 也是能被CRP 作用的,但改造为典型序列后受到CRP 更强的作用,激发了更强的转录作用。在细菌中,CRP被别构效应物cAMP激活并与之结合形成二聚体复合物,该复合物结合于靶启动子上游特异的DNA 位点TGTGA-(N6)-TCACA 后与RNA聚合酶直接作用,增强后者在启动子上的结合能力,从而起始转录。我们推测,VC2364启动子区的这个非典型CRP结合序列,依然能够使CRP二聚体形成较微弱的结合并发挥一定的激活作用。
在大部分植物和微生物中,天冬氨酸代谢是合成赖氨酸、苏氨酸、异亮氨酸、甲硫氨酸所必需的,另外该途径还产生许多重要的中间产物,如在细胞壁合成过程中起交联作用的二氨基庚二酸及革兰阳性菌芽胞的重要组成成分吡啶二羧酸[13]。在霍乱弧菌中,天冬氨酸代谢涉及的高丝氨酸脱氢酶基因VC2364启动子CRP结合位点可能发生了突变,形成了非典型结合序列,弱化了被CRP 调控的作用。为什么没有出现典型的CRP结合序列?这种序列变化弱化了CRP的调控作用,但这种突变却被保留,其中的机制目前还不清楚,是否是适应某类微环境而形成的适应性改变,还需要进一步的实验分析。
[1]Kolb A,Busby S,Buc H,et al.Transcriptional regulation by cAMP and its receptor protein[J].Annu Rev Biochem,1993,62:749-795.
[2]Busby S,Ebright R H,Transcription activation by catabolite activator protein(CAP)[J].J Mol Biol,1999,293(2):199-213.
[3]Shimada T,Fujita N,Yamamoto K,et al.Novel roles of cAMP receptor protein(CRP) in regulation of transport and metabolism of carbon sources[J].Plos One,2011,6(6):e20081.
[4]Gosset G,Zhang Z,Nayyar S,et al.Transcriptome analysis of Crp-dependent catabolite control of gene expression in Escherichia coli[J].J Bacteriol,2004,186(11):3516-3524.
[5]Zhan L,Han Y,Yang L,et al.The cyclic AMP receptor protein,CRP,is required for both virulence and expression of the minimal CRP regulon in Yersinia pestis biovar microtus[J].Infect Immun,2008,76(11):5028-5037.
[6]Espert S M,Elsinghorst E A,Munson G P.The tib adherence locus of enterotoxigenic Escherichia coli is regulated by cyclic AMP receptor protein[J].J Bacteriol,2011,193(6):1369-1376.
[7]Skorupski K,Taylor R K.Cyclic AMP and its receptor protein negatively regulate the coordinate expression of cholera toxin and toxin-coregulated pilus in Vibrio cholerae[J].Proc Natl Acad Sci USA,1997,94(1):265-270.
[8]Silva A J,Benitez J A.Transcriptional regulation of Vibrio cholerae hemagglutinin/protease by the cyclic AMP receptor protein and RpoS[J].J Bacteriol,2004,186(19):6374-6382.
[9]Liang W,Pascual-Montano A,Silva A J,et al.The cyclic AMP receptor protein modulates quorum sensing,motility and multiple genes that affect intestinal colonization in Vibrio cholerae[J].Microbiology,2007,153(Pt 9):2964-2975.
[10]Chen B,Liang W,Wu R,et al.Phenotype microarray screening of carbon sources used by Vibrio cholerae identifies genes regulated by the cAMP receptor protein[J].Can J Microbiol,2013,59(7):472-478.
[11]Munch R,Hiller K,Grote A,et al.Virtual footprint and PRODORIC:an integrative framework for regulon prediction in prokaryotes[J].Bioinformatics,2005,21(22):4187-4189.
[12]Turatsinze J V,Thomas-Chollier M,Defrance M,et al.Using RSAT to scan genome sequences for transcription factor binding sites and cis-regulatory modules[J].Nat Protoc,2008,3(10):1578-1588.
[13]Viola R E.The central enzymes of the aspartate family of amino acid biosynthesis[J].Acc Chem Res,2001,34(5):339-349.

