抗结核分枝杆菌RpfB结构域单克隆抗体的制备及鉴定
樊爱琳,马越云,郑善銮,杨麦贵,郝晓柯
第四军医大学 西京医院检验科,陕西 西安 710032
结核病是危害人类健康的重要传染病,我国的肺结核患者数量位居世界第二。结核分枝杆菌(Mycobacterium tuberculosis,MTB)感染人体后,绝大多数以潜伏感染(休眠菌)的形式存在。现有的抗结核药物可以有效杀死处于生长状态的结核分枝杆菌,但对处在休眠状态的结核分枝杆菌效果甚微。当患者的抵抗力低下时,休眠的MTB 就会大量繁殖,重新处于致病状态[1-2]。
研究发现,在MTB 休眠菌的复苏过程中,5 种促进复活因子(resuscitation promoting factor,Rpf)发挥了重要作用,它们分别为RpfA、RpfB、RpfC、RpfD和RpfE[3],是由MTB分泌的。Rpf最早在藤黄微球菌(Micrococcus luteus)中被发现[4],它也是发现的第一个能够促使休眠菌恢复生长繁殖能力的分泌型蛋白,是宿主免疫系统识别的靶抗原,其产生的特异性抗体能阻断Rpf 蛋白对MTB 休眠菌的复苏作用,因此Rpf 蛋白可能是预防和控制MTB 感染的新途径。同源性分析发现,在多种富含G+C 的革兰阳性细菌中有Rpf样蛋白存在,均具有Rpf样结构域[4]。Rpf蛋白结构域是一个含77 个氨基酸残基的截断肽,位于Rpf 蛋白全长的A42~L118。研究发现Rpf 蛋白结构域具有与Rpf 蛋白一致的生物学功能,其体外复活休眠菌的作用与完整的Rpf蛋白相同,也具有Rpf蛋白相似的免疫原性,诱导产生的特异性抗体可能会阻断MTB的Rpf家族的全部Rpf样蛋白,抑制细菌的复苏和生长[5]。MTB的5种Rpf样蛋白功能重叠[6],实验表明敲除其中任何一个Rpf 基因时,其生长不会受到明显影响[7]。这表明MTB 的5 种Rpf 样蛋白存在协同作用,共同对MTB 的休眠进行控制。因此,如何对其进行优化组合将成为疫苗研发及实验室检测方法建立的重要障碍。研究表明,RpfB 在MTB 的生长中发挥较为重要的作用。RpfB 蛋白为膜蛋白,具有多种T 细胞和B 细胞抗原表位,突变RpfB 可明显减缓H37Ra 的生长速度[8]。本实验室前期的研究也发现RpfB 具有较强的生物学和免疫学特性[9]。因此,RpfB 结构域可能是研究MTB Rpf 蛋白免疫学特性及生物学功能的切入点。为此,我们以原核表达纯化的RpfB 结构域多肽作为免疫原,制备其单克隆抗体,为进一步研究其生物学和免疫学特性提供了重要工具。
1 材料和方法
1.1 材料
BALB/c 小鼠(雌性,6~8 周龄)由第四军医大学动物实验中心提供;结核杆菌H37Ra 株为陕西省结核病防治研究所惠赠;藤黄微球菌标准株、大肠杆菌DH5α为西京医院检验科细菌室保存;Sp2/0 细胞系由第四军医大学微生物教研室馈赠;pPRO-EXHTRpfB domain 重组质粒为本实验室制备[10];PEG、HT及HAT 购自Promega 公司;6×His 单抗、HRP 山羊抗小鼠IgG 抗体购自华美生物公司;Ni2+-NTA 纯化试剂盒购自Invitrogen公司。
1.2 结核分枝杆菌RpfB结构域多肽的表达和纯化
将pPRO-EXHT-RpfB domain 原核表达载体接种于大肠杆菌DH5,用0.5 mmol/L IPTG 诱导表达4 h,表达的融合蛋白经SDS-PAGE 及Western 印迹鉴定,采用Ni2+-NTA 纯化试剂盒按变性条件进行亲和色谱纯化目的蛋白,采取逐步降低尿素浓度的方法除去尿素,使变性蛋白自然复性。
1.3 单抗细胞株的建立
用纯化的RpfB 结构域多肽免疫BALB/c 小鼠3次,每次间隔2 周;采用PEG1500 融合剂,将免疫小鼠的脾细胞和骨髓瘤细胞Sp2/0 融合,用含HAT 的培养液培养融合细胞5 d,之后改用含HT 的培养液培养3 d 至第8 d,用间接ELISA 法检测培养上清抗体效价,将阳性孔用有限稀释法进行克隆化,建立单克隆细胞株。
1.4 含单抗腹水的制备及纯化
将单克隆细胞株细胞密度调至1×109~2×109/L,进行小鼠腹腔注射制备腹水,每只小鼠注射0.5 mL,注射后10~15 d可发现小鼠腹部明显膨大,抽取腹水,采用正辛酸-硫酸铵法进行纯化。
1.5 间接夹心ELISA法检测纯化抗体效价
用10 g/L 的RpfB 结构域多肽包被板子,加入系列稀释的纯化抗体,以HRP 标记的羊抗鼠为二抗,用OPD 显色。以Sp2/0 细胞培养上清作为阴性对照,免疫小鼠血清作为阳性对照。
1.6 Western印迹鉴定纯化单抗的特异性
将表达产物经SDS-PAGE 后转移至硝酸纤维素膜上,在37℃用50 g/L 脱脂奶粉封闭1 h,加入纯化的单抗,浓度为100 mg/L,孵育1 h,用PBS 洗涤3次,再加入HRP-山羊抗小鼠IgG 抗体,37℃摇床孵育1 h,PBS洗涤3次,加入底物,用OPD显色。
1.7 ELISA法检测单抗的特异性
用RpfB结构域多肽和无关的带His标签的融合蛋白同时包被板子,以纯化的单抗作为一抗,37℃孵育1 h,PBS 洗涤后与1∶1000 稀释的HRP-山羊抗小鼠IgG抗体37℃反应1 h,PBS洗涤,OPD显色。
1.8 ELISA法鉴定单抗类和亚类
用6 种类和亚类特异性羊抗鼠多克隆抗体检测不含血清的杂交瘤细胞培养上清,呈阳性反应的即可确定型别。
1.9 单抗相对亲和力测定
包被RpfB 结构域2 mg/L,4℃过夜,洗涤后用10%小牛血清封闭1 h,加入系列稀释(200~10-7μg/mL)的纯化单抗孵育1 h,PBS洗涤后与1∶1000稀释的HRP-山羊抗小鼠IgG 反应1 h,洗涤后用OPD 显色,读取D490nm值并绘制曲线,观察相对亲和力。
1.10 抗RpfB结构域单抗的交叉实验
分别用藤黄微球菌Rpf、Rpf 结构域、MTB RpfB结构域和MTB RpfA、H37Ra 菌株作为抗原包被板子,以制备的单抗(选取效价最高的一株B8G11)作为一抗,用ELISA 法检测,观察抗RpfB 结构域单抗与Rpf家族蛋白及MTB的交叉反应。
1.11 抗RpfB结构域单抗的抑制实验
取休眠状态的MTB H37Ra 100 μL 转接到5 mL 7H9培养基中,藤黄微球菌100 μL转接到5 mL葡萄糖肉汤液体培养基中,分别加入不同浓度的RpfB结构域蛋白和抗RpfB结构域单抗,以0.01 mol/L PBS为阴性对照,每个浓度重复5管,37℃培养,每3 h(27 h 后每6 h)取少量藤黄微球菌培养液测D600nm值,每5 d取少量MTB H37Ra株培养液测D600nm值,绘制各组MTB H37Ra和藤黄微球菌生长曲线。
2 结果
2.1 RpfB结构域蛋白的表达和纯化
原核系统表达的RpfB 结构域蛋白为不可溶性的,SDS-PAGE 分析表明在Mr约为12×103处有蛋白表达带,与目的蛋白大小吻合。在变性条件下纯化目的蛋白,收集洗脱液进行160 g/L SDS-PAGE 分析,发现在Mr为12×103处有清晰的条带,经薄层扫描分析融合蛋白纯度可达90%以上(图1)。
2.2 抗Rpf结构域单抗的制备及鉴定
取小鼠骨髓瘤细胞Sp2/0 与已免疫小鼠的脾细胞融合,融合后第8 d用间接ELISA 法检测,有20孔为阳性,用有限稀释法进行克隆化,经过3 次克隆化得到3 株可稳定分泌单抗的杂交瘤细胞系,分别命名为D3A5、B8G11、A9C8,其中D3A5、B8G11 属IgG1亚类,A9C8 属IgM 亚类。3 株单抗腹水纯化后显著增高(表1),Western 印迹分析表明该单抗可特异性识别RpfB 结构域多肽(图2)。ELISA 结果显示,带His 标签的无关蛋白检测为阴性,而RpfB 结构域检测为阳性,说明所获得的单抗是针对RpfB 结构域的,不是针对His标签的。根据间接ELISA检测系列稀释的单抗与RpfB 结构域反应的D490nm值绘制曲线,以抗原抗体结合平台期50%的D490nm值的抗体浓度表示单抗的相对亲和力,结果D3A5、B8G11、A9C8的相对亲和力分别为0.1、1和0.05 μg/mL,即A9C8>D3A5>B8G11(图3)。
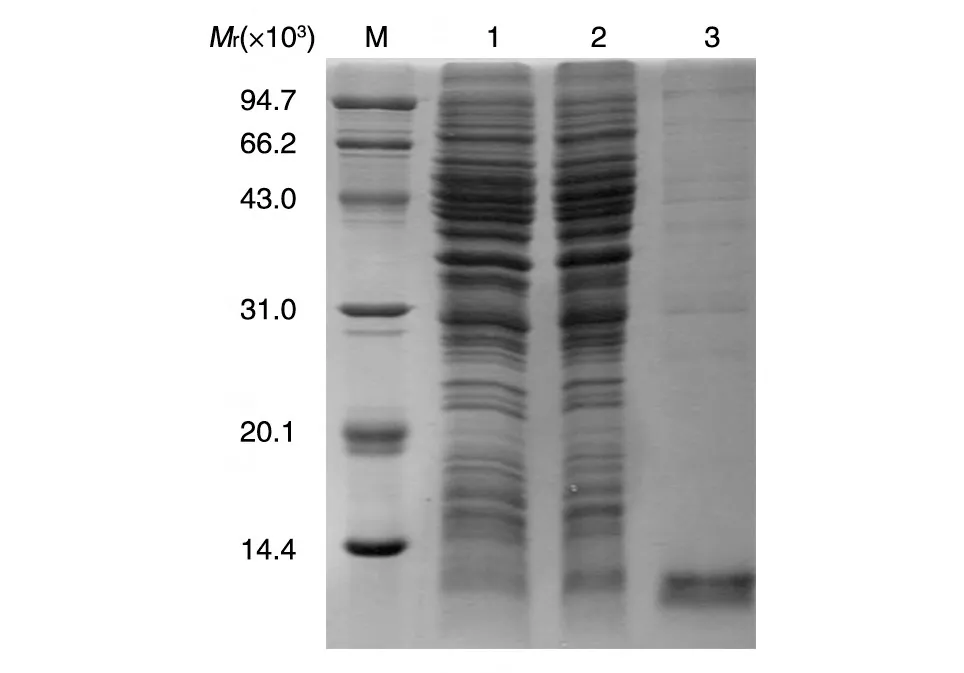
图1 结核分枝杆菌RpfB结构域融合表达蛋白的SDS-PAGE分析

表1 D3A5、B8G11、A9C8单抗效价
2.3 抗RpfB结构域单抗的交叉实验
从表2 可以看出,抗RpfB 结构域单抗可以与MTB RpfB 结构域、MTB RpfA、藤黄微球菌Rpf、Rpf结构域、H37Ra 菌株发生反应,说明抗RpfB 结构域单抗可识别Rpf样蛋白及其结构域。
2.4 抗RpfB结构域单抗对MTB的生长抑制作用
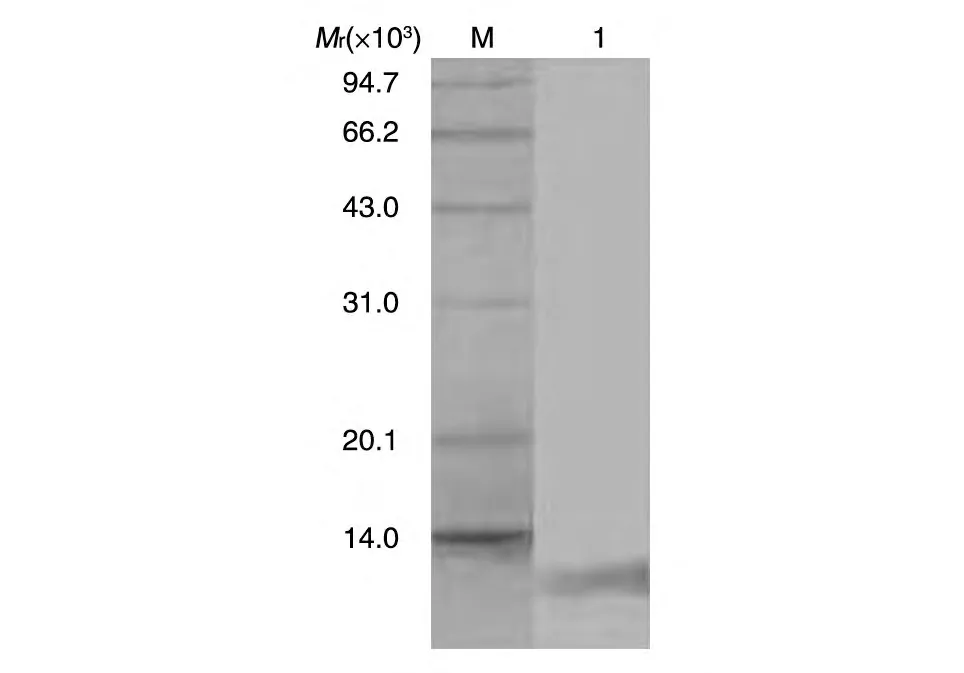
图2 纯化单抗的Western印迹
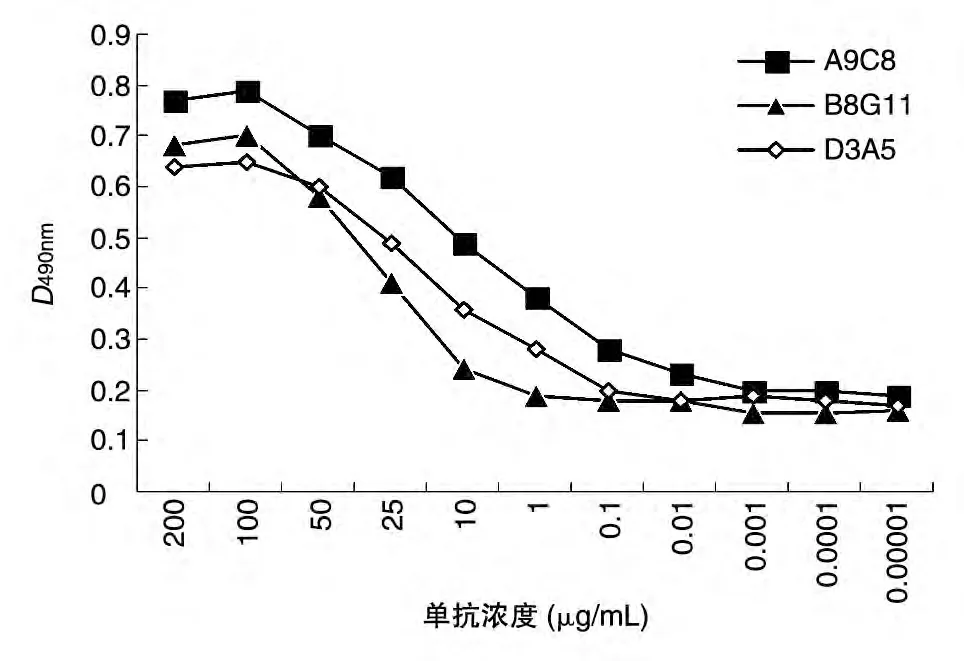
图3 抗RpfB结构域单抗的相对亲和力
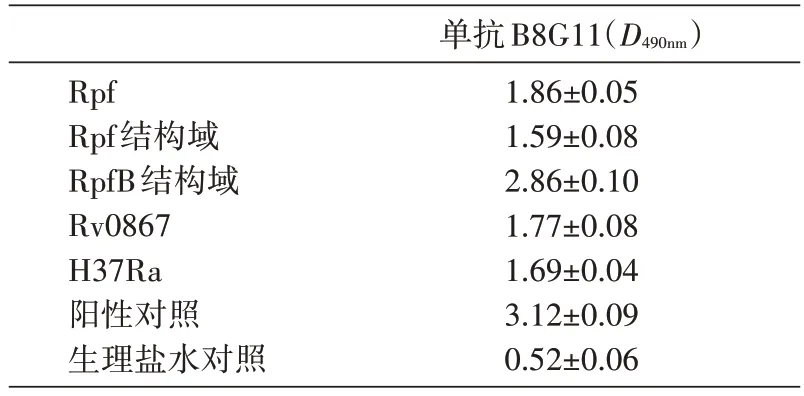
表2 ELISA法检测抗RpfB结构域单抗的交叉实验
从不同浓度的RpfB 结构域蛋白刺激藤黄微球菌和MTB H37Ra 的生长曲线可以看出,当RpfB 结构域浓度为1000 pmol/L 时刺激藤黄微球菌的复苏和生长作用明显,当RpfB 结构域浓度为500 pmol/L时刺激MTB H37Ra的复苏和生长作用明显,而且这种刺激作用在加入了1∶1000 的抗RpfB 结构域单抗后明显被抑制(图4、5)。
3 讨论
结核分枝杆菌感染率很高,多数感染者并不发病,是因为MTB 以休眠体状态存在于体内。Rpf 最先在藤黄微球菌中发现[5],它在细胞外以皮克(10-12g)水平通过自分泌和旁分泌形式发挥促进休眠期细菌复活的作用。MTB含有5种Rpf样蛋白,在功能上有一定的重叠,删除任何一个编码Rpf 蛋白的基因都不能明显影响MTB 的生长,而当3 个以上基因被删除时,MTB 在体外才不能自发复苏[7]。提示单个抗Rpf 抗体并不能完全阻断所有Rpf 蛋白对结核菌复苏和生长的促进作用,只有3个以上抗Rpf抗体联合应用才能有效阻断Rpf 蛋白对结核菌的促复苏和生长作用。但如何对其进行优化组合,成为疫苗研发及实验室检测方法建立的重要障碍。
Vladimir 等的研究表明,藤黄微球菌Rpf 蛋白具有很强的免疫原性,用其免疫C57BL/6 小鼠后,可诱发T细胞增殖,引起IL-10、IL-12、γ-干扰素升高,其免疫血清可以抑制MTB H37Ra 的生长与增殖[11]。研究发现,藤黄微球菌的Rpf蛋白与其Rpf蛋白结构域具有一致的生物学功能[12]。Rpf 蛋白结构域可能是一种理想的保护性抗原。
我们利用原核系统表达获得了RpfB 结构域蛋白,将纯化的蛋白作为免疫原免疫小鼠,制备了3 株单克隆抗体,特异性高,亲和力较强,经小鼠腹腔注射制备腹水纯化后获得了较高纯度的单抗,可识别多种Rpf 样蛋白及其结构域蛋白。由于Rpf 样蛋白高度同源、Rpf样蛋白结构域高度保守[12],因此,推测抗RpfB 结构域单抗可能会识别MTB Rpf 家族的全部Rpf 样蛋白,这种推测有待于进一步验证。据此,有可能建立MTB 相关抗原的检测方法,可以检测处于不同感染阶段的MTB Rpf 蛋白,这样不仅可以克服Rpf 蛋白表达具有时相性难以检测的缺陷,又达到了多种抗原联合检测的目的,可以提高MTB 检测的敏感性和特异性。
在观察RpfB 结构域蛋白对藤黄微球菌和MTB H37Ra 休眠菌促复苏和生长作用的同时,我们还观察了抗RpfB 结构域单抗对这种促复苏和生长的抑制作用。结果显示,抗RpfB 结构域单抗可明显抑制RpfB 结构域蛋白对MTB H37Ra 和藤黄微球菌休眠菌的复苏和生长作用。表明RpfB 蛋白结构域诱导的特异性抗体可能会抑制机体内潜伏感染的MTB的再次激活,具有控制隐性感染复发的作用。抗RpfB结构域单抗的制备,为进一步研究RpfB结构域的生物学和免疫特性,评价其是否可作为候选结核亚单位疫苗的组分提供了实验工具。
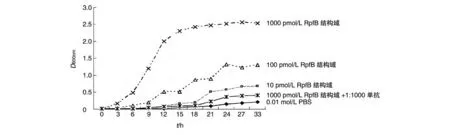
图4 藤黄微球菌在RpfB结构域蛋白及抗RpfB结构域单抗作用下的生长曲线
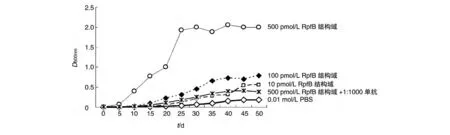
图5 MTB H37Ra在RpfB结构域蛋白及抗RpfB结构域单抗作用下的生长曲线
[1]Flynn J L,Chan J.Tuberculosis:latency and reactivation[J].Infect Immun,2001,69(7):4195-4201.
[2]Ulrichs T,Kaufmann S H.Mycobacterial persistence and immunity[J].Front Biosci,2002,7:458-469.
[3]Mukamolova G V,Turapov O A,Young D I,et al.A family of autocrine growth factors in Mycobacterium tuberculosis[J].Mol Microbiol,2002,46(3):623-635.
[4]Mukamolova G V,Kaprelyants A S,Young D I,et al.A bacterial cytokine[J].Proc Natl Acad Sci USA,1998,95(15):8916-8921.
[5]Mukamolova G V,Turapov O A,Kazarian K,et al.The rpf gene of Micrococcus luteus encodes an essential secreted growth factor[J].Mol Mirobiol,2002,46(3):611-621.
[6]Downing K J,Betts J C,Young D I,et al.Global expression profiling of strains harbouring null mutations reveals that the five rpf-like genes of Mycobacterium tuberculosis show functional redundancy[J].Tuberculosis,2004,84(3-4):167-179.
[7]Downing K J,Mischenko V V,Shleeva M O,et al.Mutantsof Mycobacterium tuberculosis lacking three of the five rpflike genes are defective for growth in vivo and for resuscitation in vitro[J].Infect Immun,2005,73(5):3038-3043.
[8]Tufariello J M,Mi K,Xu J.et al.Deletion of the Mycobacterium tuberculosis resuscitation promoting factor Rv1009 gene results in delayed reactivation from chronic tuberculosis[J].Infect Immun,2006,74(5):2985-2995.
[9]樊爱琳,师长宏,苏明权,等.抗藤黄微球菌Rpf结构域单克隆抗体的制备与特性鉴定[J].细胞与分子免疫学杂志,2008,24(5):448-451.
[10]樊爱琳,苏明权,师长宏,等.结核分枝杆菌Rv1009 结构域基因的克隆、表达及亲和层析纯化[J].生物技术通讯,2007,18(4):579-582.
[11]Vladimir V,Yeremeev,Tatiana K,et al.Proteins of the Rpf family:immune cell reactivity and vaccination efficacy against tuberculosis in mice[J].Infect Immun,2003,71(8):4789-4794.
[12]Mukamolova G V,Murzin A G,et al.Muralytic activity of micococcus luteus Rpf and relationship to physiological activity in promoting bacterial growth and resuscitation[J].Mol Microbiol,2006,59(1):84-89.

