病原菌多糖基因簇在大肠杆菌中的克隆
王雯,孙鹏,徐敏锐,徐威,吴军
1.沈阳药科大学,辽宁 沈阳 110016;2.军事医学科学院 生物工程研究所,北京 100071;3.安徽大学,安徽 合肥 230601
许多病原菌的脂多糖(lipopolysaccharide,LPS)、荚膜多糖(capsule polysacharides,CPS)往往是其重要的保护性抗原[1],利用其多糖制备的多糖疫苗已上市多年。然而,多糖是T 细胞非依赖性抗原,在人体内不能引起免疫记忆效应[2-3],特别是在2 岁以下儿童和老年人体内无法产生具有保护水平的抗体[4]。如果将多糖和蛋白交联在一起,多糖-蛋白结合物便成为T 细胞依赖性抗原,在人体内能引起免疫记忆效应。因此,现在基于细菌多糖的疫苗其研发重点已转向多糖-蛋白结合疫苗[5-8]。现有多糖-蛋白结合疫苗均采用化学法制备,该过程存在以下一些问题:①大规模培养病原菌提取多糖有一定的安全风险;②通过化学方法提取的多糖纯度较低,质控困难;③产物均一性差,纯化困难;④得率低,成本高[9]。
近年来,在细菌中发现了N-糖基化和O-糖基化修饰系统,建立了基于N-糖基化修饰系统的生物交联技术[10],并在大肠杆菌中分别利用痢疾杆菌O-多聚糖(OPS)和金黄色葡萄球菌CPS 修饰了重组绿脓杆菌外毒素A(rEPA),制备了痢疾多糖结合疫苗和金黄色葡萄球菌多糖结合疫苗[11]。目前痢疾多糖结合疫苗已完成Ⅰ期临床试验,金黄色葡萄球菌多糖结合疫苗在准备进行Ⅰ期临床试验。
但是,N-糖基化修饰系统的寡糖转移酶PglB 对多糖底物有一定的要求:多糖还原末端第一位糖基的C2位必须有乙酰氨基,且第二位糖基不能以β(1-4)糖苷键与其连接[12-14]。而病原菌多糖多种多样,许多病原菌多糖的还原末端第一位糖基的C2 位并没有乙酰氨基[15-16],这将严重限制N-糖基化修饰系统在多糖结合疫苗研制领域的应用。相比之下,O-糖基化修饰系统的寡糖转移酶对多糖底物特异性较低,可将C2位无乙酰氨基的多糖转移至靶标蛋白的糖基化位点上。为此,本课题组前期选取大肠杆菌K12 系列菌株W3110 开展了基于脑膜炎奈瑟球菌O-糖基化修饰系统的生物交联技术[17]。W3110 因O-多糖合成途径中的鼠李糖转移酶基因wbbL插入失活而不能合成O-多糖。另外,利用Red 重组[18-19]技术敲除W3110 中O抗原连接酶基因waaL,构建了O-多糖及脂多糖连接酶缺陷的大肠杆菌CLM24 作为宿主菌,从而解决了LPS 合成途径与糖基化修饰途径竞争“异源多糖”的问题,在此基础上构建了糖基工程大肠杆菌CLM24/pMMB66EH-pilE-his/pETtac28-pglL。如果进一步将外源多糖基因簇功能整合到此系统中,即可获得多糖-蛋白结合物。但是,病原菌LPS 的O-多糖基因簇一般包含数十个基因,长度达20~30 kb。本研究的目的就是以大肠杆菌O157、甲型副伤寒沙门菌CMCC50973及铜绿假单胞杆菌CMCC10110 为研究对象,将具有功能的外源O-多糖合成基因簇大片段功能整合到糖基工程大肠杆菌中,从而为在大肠杆菌中建立基于O-糖基化的生物交联多糖-蛋白结合疫苗构建技术提供基础。1992 年,Shizuya 等[20]描述了一种可以克隆长片段DNA 的细菌人工染色体(bacterial artificial chromosome,BAC),此系统以大肠杆菌F 因子为基础载体。F 因子具有稳定遗传的特点,复制严谨且维持在低拷贝(每个细胞中有1~2 个拷贝)的环境下,从而减少了质粒中潜在的DNA 片段之间重组的几率。此外,F 因子可携带长达1 Mb 的外源DNA,这也同时表明F因子适合DNA大片段克隆。而建立基于细菌糖基化修饰系统的生物交联技术制备多糖-蛋白结合疫苗,依赖于外源多糖基因簇的稳定遗传和表达。我们以基于F 质粒的细菌人工染色体pCC1BAC 为载体,以大肠杆菌O157、甲型副伤寒沙门菌CMCC50973 及铜绿假单胞杆菌CMCC10110 为研究对象,构建了外源病原菌多糖合成基因簇的克隆载体,并研究了其在大肠杆菌中参与LPS 合成和修饰底物蛋白的能力。
1 材料与方法
1.1 材料
清洁级BALB/c 雌性小鼠由军事医学科学院动物中心提供;菌株和质粒来源见表1。PrimerSTAR GXL DNA聚合酶、限制性内切酶及长片段连接酶试剂盒购自TaKaRa 公司;Q5 High-Fidelity DNA 聚合酶购自NEB 公司;HRP-羊抗兔IgG、HRP-羊抗鼠IgG 购自TransGen 公司;重蒸酚、RNase、DNaseⅠ、蛋白酶K 购自北京欣经科生物技术有限公司;大肠杆菌O157 型、弗氏志贺菌α2a 型抗血清购自日本生研株式会社;引物(表2)由生工生物工程(上海)股份有限公司合成;DNA 序列服务由北京华大基因有限公司提供;DNA胶回收试剂盒购自TIANGEN公司。
1.2 PCR扩增外源多糖基因簇及BAC载体片段
根据 GenBank 公布的大肠杆菌 O157(AF061251.1)、甲型副伤寒沙门菌ATCC 9150 株(CP000026.1)、铜绿假 单胞杆 菌 PAO1 株(AE004091.2)基因序列,分别以大肠杆菌O157、甲型副伤寒沙门菌CMCC50973 及铜绿假单胞杆菌CMCC10110 基因组为模板,分别以O157-5'与O157-3'、50973 OPS-5'与50973 OPS-3'、10110 OPS-5'与10110 OPS-3'为引物,用PrimerSTAR GXL DNA 聚合酶分别扩增带有SfiⅠ酶切位点的大肠杆菌O157、甲型副伤寒沙门菌CMCC50973、铜绿假单胞杆菌CMCC10110 的O-多糖合成基因簇;另以载体pCC1BACTM 质粒为模板、BAC-5'与BAC-3'为引物,用Q5 High-Fidelity DNA 聚合酶扩增带有SfiⅠ酶切位点的线性片段。
1.3 多糖基因簇重组质粒的构建及鉴定
将大肠杆菌O157、甲型副伤寒沙门菌CMCC50973、铜绿假单胞杆菌CMCC10110多糖合成基因簇片段及BAC 载体片段用SfiⅠ酶切后,用DNA ligation kit LONG 长片段连接试剂盒于16℃连接3 h,转化大肠杆菌DH5α,分别用O-多糖合成基因簇中前中后3对引物进行PCR鉴定,从3对引物鉴定均为阳性的克隆中提取质粒,酶切进一步鉴定,将PCR鉴定和酶切鉴定均为阳性的重组质粒分别命名为BAC-O157、BAC-50973和BAC-10110。

表1 菌株与质粒

表2 引物设计
1.4 铜绿假单胞杆菌CMCC10110 LPS 的制备及测定
采用热酚水法制备、纯化铜绿假单胞杆菌CMCC10110 的LPS,具体操作参照文献[18];采用银染法对纯化的LPS 进行检测,具体操作参照文献[21];采用苯酚硫酸法测定葡萄糖浓度,绘制标准曲线,根据所得方程,计算出铜绿假单胞杆菌CMCC10110 的LPS浓度,具体操作参照文献[21]。
1.5 铜绿假单胞杆菌抗血清的制备
用甲醛灭活铜绿假单胞杆菌CMCC10110 后制备抗血清,具体操作参照文献[22];将制备好的灭活菌配制成10、20 及40 mg/mL 浓度梯度,作为免疫原接种BALB/c小鼠,具体操作参照文献[21],用间接ELISA法测抗体效价。
1.6 多糖基因簇克隆载体的功能鉴定
将重组质粒BAC-O157、BAC-50973和BAC-10110电击转化大肠杆菌K12系列菌株W3110,构建相应的重组菌W3110/BAC-O157、W3110/BAC-50973及W3110/BAC-10110。K12 系列大肠杆菌因O-多糖合成途径中的鼠李糖转移酶基因wbbL插入失活,因此不能合成O-多糖,从而为W3110 利用外源O-多糖合成自身的“异源LPS”奠定了基础。挑取重组克隆至含终浓度为30μg/mL 氯霉素的LB 液体培养基中,对照菌株至无抗LB 液体培养基中,37℃培养12 h,4500 r/min 离心5 min,弃上清,沉淀用PBST 洗3 次,加入5%的奶粉,37℃孵育2 h,菌体于4500 r/min离心5 min,弃上清,沉淀用PBST洗3次,加入稀释的抗血清,37℃孵育1.5 h,菌体于4500 r/min离心5 min,弃上清,沉淀用PBST洗3次,加入稀释的酶标二抗,37℃孵育1 h,菌体于4500 r/min 离心5 min,弃上清,沉淀用PBST 洗3 次,用100μL PBST 重悬,于各反应孔中加入30μL 菌液后加入100μL 显色液,放置30 s,加入50μL 2 mol/L 硫酸终止反应。
1.7 靶标蛋白PilE O-糖基化修饰的鉴定
将重组质粒BAC-O157、BAC-50973及BAC-10110分别电击转化糖基工程大肠杆菌CLM24/pMMB66EH-pilE-his/pETtac28-pglL,构建重组菌CLM24/pMMB66EH-pilE-his/pETtac28-pglL/BACO157、CLM24/pMMB66EH-pilE-his/pETtac28-pglL/BAC-50973和CLM24/pMMB66EH-pilE-his/pETtac28-pglL/BAC-10110。挑取重组克隆于含30μg/mL 氯霉素、50μg/mL 卡那霉素和100μg/mL 氨苄西林的三抗Ⅰ号培养基(20 g/L 酵母抽提物、10 g/L胰蛋白胨、50 mmol/L pH7.0 磷酸盐缓冲液、10 g/L葡萄糖)中,37℃培养至D600nm约为0.6时,加入终浓度为1 mmol/L 的IPTG,16℃诱导培养20 h,离心弃上清收集沉淀,用A 液(20 mmol/L pH7.5 磷酸盐缓冲液)重悬,超声波破菌离心后弃沉淀,用阳离子柱纯化(A 液:20 mmol/L pH7.5 磷酸盐缓冲液;B 液:20 mmol/L pH8.0 磷酸盐 缓冲液;C 液:20 mmol/L pH8.0 磷酸盐缓冲液、1 mol/L NaCl),纯化后样品进行Western印迹鉴定。
2 结果
2.1 多糖基因簇的克隆及重组克隆质粒的构建
根据GenBank 公布的大肠杆菌O157、甲型副伤寒沙门菌ATCC 9150 株、铜绿假单胞杆菌PAO1 株基因序列合成引物。因为多糖合成基因簇片段较大而不易克隆,因此本实验对长片段PCR 方法进行了优化,用PrimerSTAR GXL DNA 聚合酶进行两步法PCR,获得大肠杆菌O157、甲型副伤寒沙门菌CMCC50973、铜绿假单胞杆菌CMCC10110O-多糖合成基因簇片段,片段大小分别为16、32、24 kb(图1)。根据GenBank 公布的基因序列对大肠杆菌O157、甲型副伤寒沙门菌CMCC50973、铜绿假单胞杆菌CMCC10110 设计小片段鉴定引物(表2),利用PCR 方法进行克隆筛选,选取三段皆为阳性的克隆菌株,构建了大肠杆菌O157、甲型副伤寒沙门菌CMCC50973、铜绿假单胞杆菌CMCC10110多糖基因簇重组质粒BAC-O157、BAC-50973及BAC-10110。用鉴定引物对重组质粒BAC-O157、BAC-50973及BAC-10110进行鉴定,分别获得了与公布的序列大小一致的大肠杆菌O157wbdN(800 bp)、gmd1(1 kb)、wbdR(700 bp)片段,甲型副伤寒沙门菌ATCC 9150galF(1 kb)、rfbV(1 kb)、ugd(1 kb)片段,铜绿假单胞杆菌PAO1wzz(1 kb)、wbpL(1 kb)、wbpM(2 kb)片段(图2)。将此3 种质粒用SfiⅠ酶切,进一步鉴定得到大肠杆菌O157、甲型副伤寒沙门菌CMCC50973、铜绿假单胞杆菌CMCC10110多糖基因簇片段及BAC 载体片段(8 kb)(图3)。用BAC 载体上的引物对重组质粒O-多糖合成基因簇片段进行5'及3'端测序,结果与GenBank 公布结果一致。
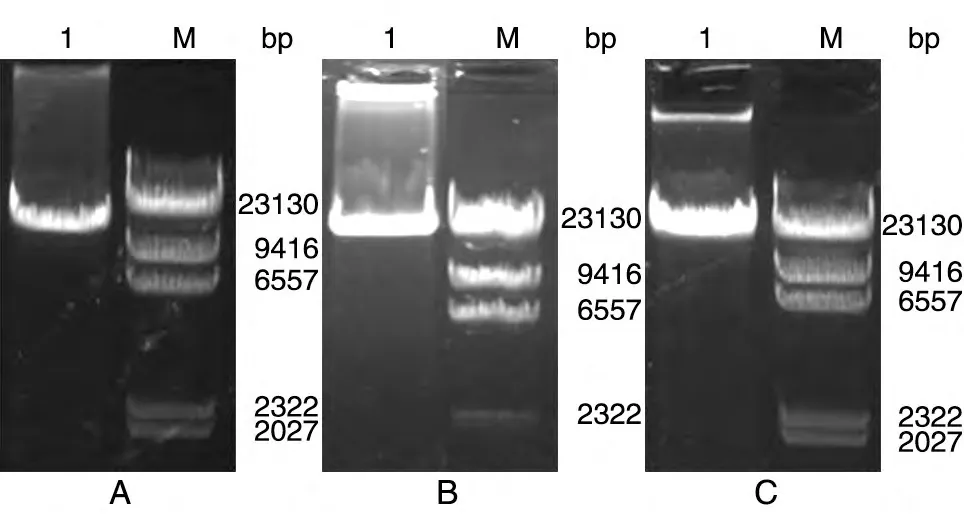
图1 外源O-多糖合成基因簇的PCR扩增
2.2 铜绿假单胞杆菌CMCC10110 LPS 抗血清的制备
由于铜绿假单胞杆菌CMCC10110 血清型未知,无法商业化得到相应的O-多糖抗体,因此我们采用热酚水法提取了铜绿假单胞杆菌CMCC10110 的LPS,利用银染法对纯化的LPS 进行检测。15%SDS-PAGE 银染结果显示,铜绿假单胞杆菌CMCC10110 的LPS 电泳图谱呈现特异性的梯状条带,且条带深浅与LPS含量成正比(图4)。用苯酚硫酸法检测样品中的多糖含量,制得标准曲线(图5)。待测样品的D490nm值为1.185±0.007,代入标准曲线,计算得样品中LPS 含量为(1072.82±1.91)μg/mL。将此浓度的LPS 稀释至1/100 后包板,用间接ELISA 法测定小鼠血清中LPS 的抗体滴度(图6),血清GMT 最低值为350,表明间接ELISA 结果良好,可以将此血清用于后续ELISA及Western印迹检测。
2.3 外源多糖基因簇克隆载体在大肠杆菌中用于合成LPS的鉴定
为了验证构建的3 种克隆载体是否具有合成O-多糖的功能,将重组菌W3110/BAC-O157、W3110/BAC-50973、W3110/BAC-10110及其对照菌株用相应的多糖抗血清进行检测,结果如图7。与阴性对照菌W3110 相比,重组菌W3110/BAC-O157和W3110/BAC-50973有明显的颜色反应,表明重组菌利用大肠杆菌O157 型O-多糖和甲型副伤寒沙门菌O-多糖生成了LPS,而带有铜绿假单胞杆菌O-多糖合成基因簇克隆载体的重组菌W3110/BAC-10110呈阴性。
2.4 多糖基因簇对菌毛蛋白PilE的修饰
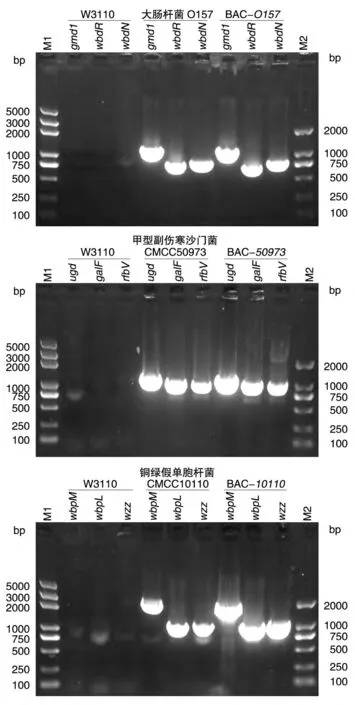
图2 外源多糖合成基因簇重组质粒的PCR鉴定
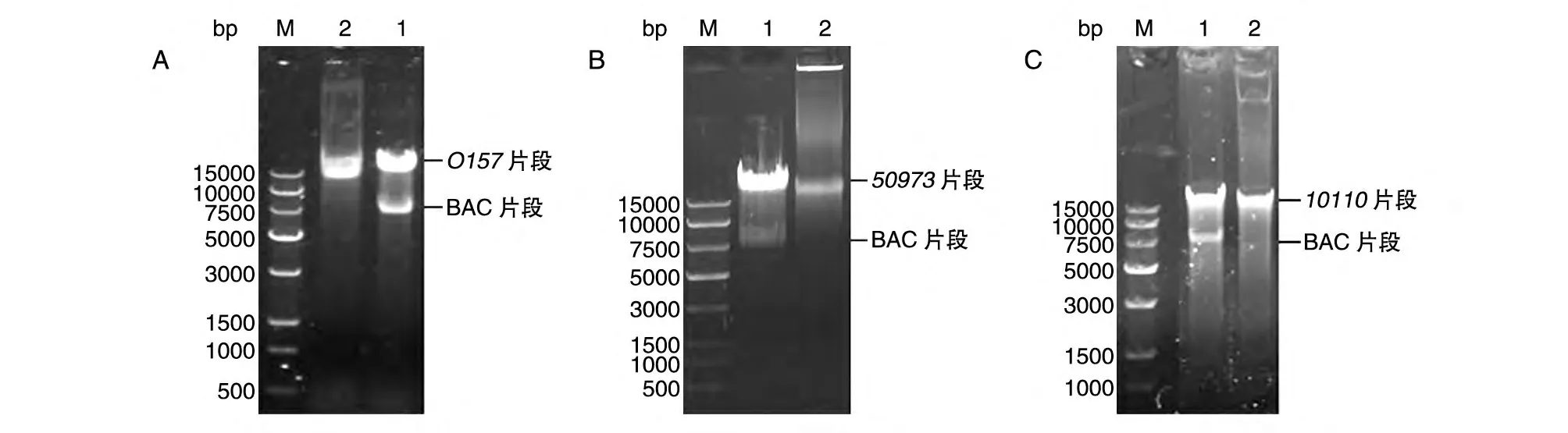
图3 多糖合成基因簇的SfiⅠ酶切鉴定
为了验证外源大肠杆菌O157、甲型副伤寒沙门菌CMCC50973、铜绿假单胞杆菌CMCC10110O-多糖是否可在糖基工程大肠杆菌中被寡糖转移酶利用来修饰菌毛蛋白PilE,挑取重组菌CLM24/pMMB66EH-pilE-his/pETtac28-pglL、CLM24/pMMB66EH-pilE-his/pETtac28-pglL/BAC-O157、CLM24/pMMB66EH-pilE-his/pETtac28-pglL/BAC-50973、CLM24/pMMB66EH-pilE-his/pETtac28-pglL/BAC-10110至相应培养基中培养,16℃诱导表达,超声波破菌取上清,用阳离子柱初步纯化,利用相应的抗血清进行Western 印迹检测,结果如图8。用抗O157 多抗进行Western 印 迹,CLM24/pMMB66EHpilE-his/pETtac28-pglL/BAC-O157菌株在相对分子质量40×103~58×103处出现特异条带,而阴性对照菌株则未见其条带。可见,外源大肠杆菌O157型多糖在此系统中可被寡糖转移酶PglL利用来修饰菌毛蛋白PilE。带有甲型副伤寒沙门菌O-多糖合成基因簇克隆载体的糖基工程大肠杆菌CLM24/pMMB66EH-pilE-his/pETtac28-pglL/BAC-50973和带有铜绿假单胞杆菌O-多糖合成基因簇克隆载体的糖基工程大肠杆菌CLM24/pMMB66EH-pilE-his/pETtac28-pglL/BAC-10110无特异性条带,说明菌毛蛋白PilE未被相应的O-多糖修饰。

图4 铜绿假单胞菌CMCC10110 LPS的15% SDS-PAGE银染检测
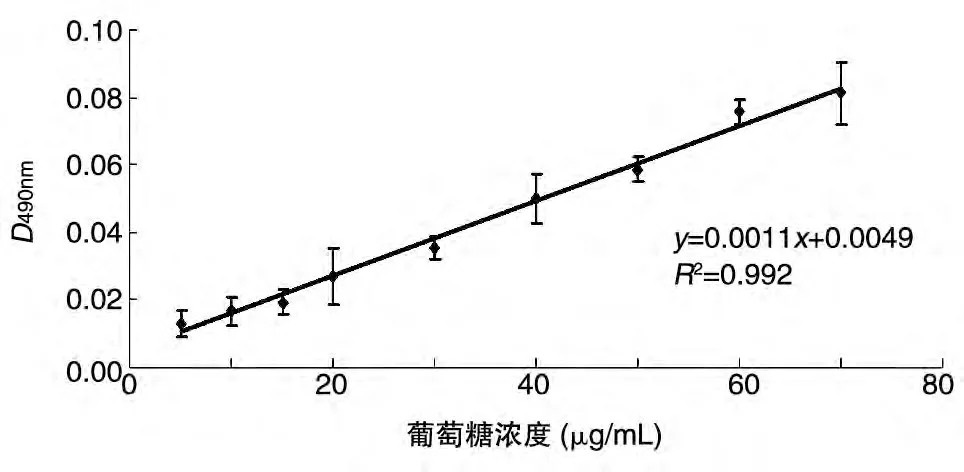
图5 苯酚硫酸法测定葡萄糖浓度标准曲线

图6 小鼠免疫血清抗LPS的IgG几何平均滴度
3 讨论
相比于一些医疗预防措施,疫苗更能提高及改善人类的生存状况。减毒活疫苗具有毒力,存在毒力恢复的危险,因此不能应用于免疫抑制的个体;灭活疫苗廉价,但副反应大。因此,合格的疫苗应具有持久的保护性免疫能力及最小的副作用。多糖-蛋白结合疫苗恰恰具有上述优势。
传统的多糖结合疫苗利用化学交联法制备,耗时、产量低、产物不均一、难纯化,且疫苗批次间存在差异。本课题组前期开展了大肠杆菌O-糖基化修饰系统研究,利用一步生物交联法克服化学交联法的不足。该技术相对于化学交联法的优势在于,外源多糖和被糖基化的蛋白质可以方便地被“替换”。
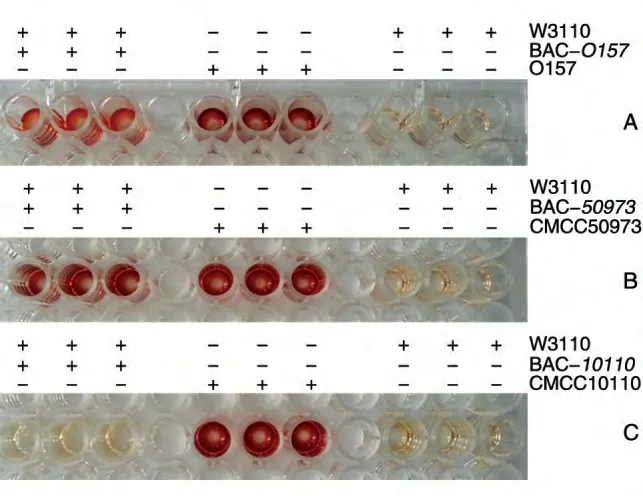
图7 ELISA检测转入多糖合成基因簇的W3110菌外源多糖的表达
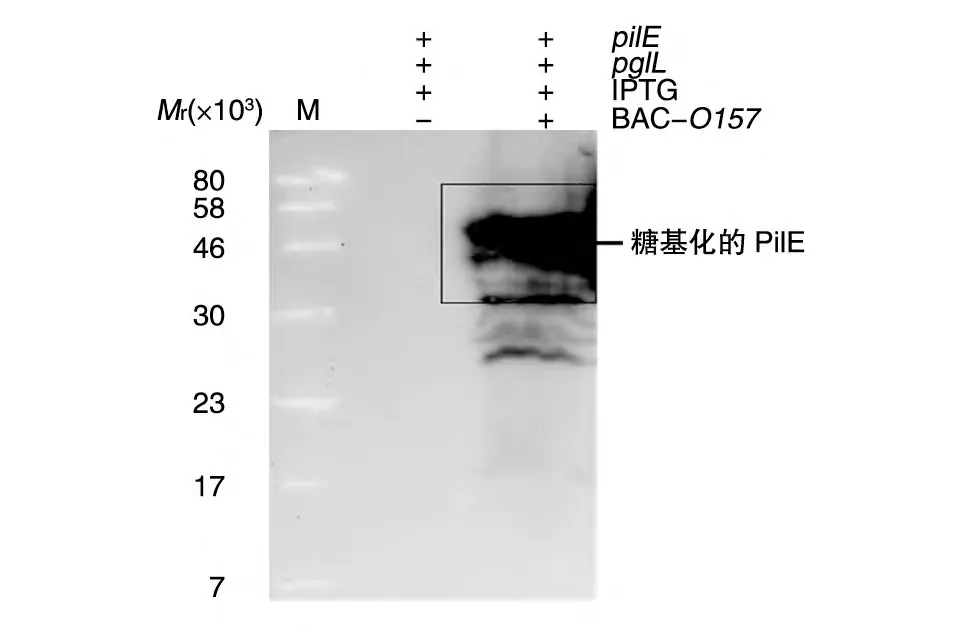
图8 O157多糖对目的蛋白修饰鉴定
以F因子为基础的BAC 作为载体在许多方面有一定的优势[20,23]。BAC 可以容纳片段较大的外源DNA,且以BAC 为载体的克隆连续传代培养至100代时,其插入片段在大肠杆菌中依然具有遗传稳定性[24-25]。在本研究中,我们以BAC 作为表达载体骨架,克隆了大肠杆菌O157、甲型副伤寒沙门菌CMCC50973 的O-多糖合成基因簇克隆载体。将上述载体转移至大肠杆菌K12 系列W3110 宿主菌中,可以检测到多糖合成基因簇在W3110 中发挥了作用,并获得了被O157 型O-多糖修饰的菌毛蛋白PilE。然而,将BAC-50973转至糖基工程大肠杆菌中后却无特异性条带,表明菌毛蛋白PilE 未被相应的O-多糖修饰,初步推断宿主菌导致靶标蛋白糖基化效率低或多糖基因簇克隆载体转化效率低,具体原因须进一步探究。ELISA 结果显示,铜绿假单胞杆菌O-多糖合成基因簇克隆载体的重组菌W3110/BAC-10110呈阴性,初步推断,原因可能为:①因未知其血清型而自制血清,虽然利用间接ELISA 法测定了其血清的几何平均滴度,但未经纯化,有可能利用度不高;②用PCR 方法克隆铜绿假单胞杆菌CMCC10110O-多糖合成基因簇,虽后期对该基因簇5'及3'两端进行了测序,但并未对基因簇整体进行测序,因此PCR 过程中该O-多糖合成基因簇内部可能发生了基因突变,从而导致阴性结果。具体原因有待进一步验证。
[1]Madsen C B,Pedersen A E,Wandall H H.Glycan-mediated modification of the immune response[J].Oncoimmunology,2013,2(4):e23659.
[2]World Health Organization.Cholera,2003[J].Wkly Epidemiol Rec,2004,79(31):281-288.
[3]Weintraub A.Immunology of bacterial polysaccharide antigens[J].Carbohydr Res,2003,338(23):2539-2547.
[4]Levine M M,Kaper J B.Live oral vaccines against cholera:an update[J].Vaccine,1993,11(2):207-212.
[5]Micoli F,Rondini S,Gavini M,et al.O:2-CRM(197) conjugates against Salmonella paratyphi A[J].PLoS One,2012,7(11):e47039.
[6]Finn A.Bacterial polysaccharide-protein conjugate vaccines[J].Br Med Bull,2004,70:1-14.
[7]Fattom A,Schneerson R,Watson D C,et al.Laboratory and clinical evaluation of conjugate vaccines composed of Staphylococcus aureus type 5 and type 8 capsular polysaccharides bound to Pseudomonas aeruginosa recombinant exoprotein A[J].Infect Immun,1993,61(3):1023-1032.
[8]Nothaft H,Szymanski C M.Bacterial protein N-glycosylation:new perspectives and applications[J].J Biol Chem,2013,288(10):6912-6920.
[9]Frasch C E.Preparation of bacterial polysaccharide-protein conjugates:analytical and manufacturing challenges[J].Vaccine,2009,27(46):6468-6470.
[10]Wacker M,Linton D,Hitchen P G,et al.N-linked glycosylation in Campylobacter jejuni and its functional transfer intoE.coli[J].Science,2002,298(5599):1790-1793.
[11]Ihssen J,Kowarik M,Dilettoso S,et al.Production of glycoprotein vaccines in Escherichia coli[J].Microb Cell Fact,2010,9:61.
[12]Wacker M.Feldman M F,Callewaert N,et al.Substrate specificity of bacterial oligosaccharyltransferase suggests a common transfer mechanism for the bacterial and eukaryotic systems[J].Proc Natl Acad Sci USA,2006,103(18):7088-7093.
[13]Faridmoayer A,Fentabil M A,Haurat M F,et al.Extreme substrate promiscuity of the Neisseria oligosaccharyl transferase involved in protein O-glycosylation[J].J Biol Chem,2008,283(50):34596-34604.
[14]Chen M M,Glover K J,Imperiali B.From peptide to protein:comparative analysis of the substrate specificity of Nlinked glycosylation in C.jejuni[J].Biochemistry,2007,46(18):5579-5585.
[15]Bentley S D,Aanensen D M,Mavroidi A,et al.Genetic analysis of the capsular biosynthetic locus from all 90 pneumococcal serotypes[J].PLoS Genetics,2006,2(3):e31.
[16]McEllistrem M C.Genetic diversity of the pneumococcal capsule:implications for molecular-based serotyping[J].Future Microbiol,2009,4(7):857-865.
[17]徐敏锐,孙鹏,张部昌,等.用大肠杆菌制备O157 多糖-菌毛蛋白结合物的研究[J].军事医学,2013,37(8):598-603.
[18]Chu C Y,Liu B K,Watson D,et al.Preparation,characterization,and immunogenicity of conjugates composed of the Ospecific polysaccharide of Shigella dysenteriae type 1(Shiga's bacillus) bound to tetanus toxoid[J].Infect Immun,1991,59(12):4450-4458.
[19]Datsenko K A,Wanner B L.One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J].Proc Natl Acad Sci USA,2000,97(12):6640-6645.
[20]Shizuya H,Birren B,Kim U J,et al.Cloning and stable maintenance of 300-kilobase-pair fragments of human DNA in construction of a rice bacterial artificial chromosome library and identification of clones linked to the Xa-21 disease resistance locus Escherichia coli using an F-factorbased vector[J].Proc Natl Acad Sci USA,1992,89(18):8794-8797.
[21]王远.霍乱弧菌O139 的LPS-CTB 结合疫苗的研究[D].北京:军事医学科学院,2010.
[22]陈煜,杨燕凌,谢小芳,等.铜绿假单胞菌抗体制备及抑菌作用[J].动物医学进展,2010,31(8):38-41.
[23]Cuccui J,Thomas R M,Moule M G,et al,Exploitation of bacterial N-linked glycosylation to develop a novel recombinant glycoconjugate vaccine against Francisella tularensis[J].Open Biol,2013,3(5):130002.
[24]Wang G L,Holsten T E,Song W Y,et al.Construction of a rice bacterial artificial chromosome library and identification of clones linked to the Xa-21 disease resistance locus[J].Plant J,1995,7(3):525-533.
[25]Chen Y,Wei W H,Ren X P,et al.Construction of a highquality genomic BAC library for Chinese peanut cultivar Zhonghua 8 with high oil content[J].Botanical Studies,2014,55(1):8.

