甲壳胺对HepG2细胞蛋白酪氨酸激酶和磷酸酶活性的影响
赵丽艳,赵忠鹏,马守栋,刘金凤,李明春
1.解放军第401医院,山东 青岛 266071;2.解放军第305医院,北京 100017
甲壳胺又称壳聚糖、几丁聚糖,主要是虾、蟹等海洋甲壳纲类动物外壳的甲壳质脱乙酰基后的产物,它由氨基葡萄糖经β-1,4-糖苷键连接而成,是自然界天然多糖中惟一的碱性多糖,具有抗肿瘤、抗炎、抗菌、增强免疫力等多种药理作用[1-4]。本实验室的前期研究表明,甲壳胺能够诱导人肝癌HepG2 细胞的凋亡[5]。为进一步探讨其作用机制,我们从蛋白质的磷酸化和去磷酸化调节角度,动态监测与细胞生长密切相关的膜相与胞浆蛋白酪氨酸激酶(protein tyrosine kinase,PTK)活性,并检测相应的蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTP)的活性变化,探讨甲壳胺在癌细胞内的作用机制。
1 材料和方法
1.1 材料
人肝癌HepG2 细胞(军事医学科学院微生物流行病研究所提供);水溶性甲壳胺(纯度≥95%,脱乙酰化率≥95%,黏度<200 mPa/s,潍坊海之源生物制品有限公司),用生理盐水配制成储备液,使用时用培养基配成所需浓度;RPMI 1640 培养基(Gibco 公司);PBS 缓冲溶液(武汉博士德生物工程有限公司);蛋白酶抑制剂(PMSF、aprotinin、leupeptin,Sigma-Aldrich 公司);CB(E3)型培养箱(Binder 公司);TGL16 型低温高速离心机(长沙英泰仪器有限公司);Elx-800/808型酶标仪(BIO-TEK 公司)。
1.2 细胞培养与分组
传代HepG2 细胞用含10%小牛血清的RPMI 1640培养液在37℃、5% CO2培养箱内培养。取对数生长期的细胞,调整浓度为1×107/mL,加入甲壳胺储备液,使终浓度为1.0 mg/mL,继续于温箱中培养,分别在不同时间准确收集上述浓度的细胞液1 mL,做时间依赖曲线。对照组细胞在加药前收集。
1.3 蛋白质提取
细胞经PBS 洗涤后,加入预冷的含蛋白酶抑制剂的裂解液,匀浆后于4℃、1200 r/min 离心10 min,收集上清液为总蛋白质。细胞经PBS 洗涤后,加入预冷的低渗裂解液,离心去沉淀,收集上清液为胞浆蛋白质。收集低渗裂解液裂解细胞后经离心得到的沉淀,再次加入裂解液作用30 min,再次匀浆离心后,收集上清液为膜相蛋白质。
1.4 活性测定
采用生物素标记的ELISA 法。蛋白样本作用于激酶底物,使其酪氨酸残基发生磷酸化,借助底物上标记的生物素,与链亲和素包被的酶标板微孔结合;洗去未结合的底物,加入过氧化物酶标记的特异性抗磷酸化酪氨酸残基抗体,与磷酸化的酪氨酸残基结合;再洗去未结合的抗体,加入过氧化物酶的催化底物ABTS 进行比色。测定波长405 nm,参考波长490 nm,通过PTK 活性-吸光度(D405nm-D490nm)的标准曲线进行定量,PTK 活性以酪氨酸磷酸肽的生成量表示。PTP 活性测定与PTK 相似,只是生物素标记的磷酸酶底物中相应的酪氨酸残基是已磷酸化的,以(D对照-D测定)/D对照×100%来定量PTP的相对活性。
1.5 统计学处理
2 结果
2.1 不同浓度甲壳胺对总蛋白质PTK活性的影响
如图1,不同浓度的甲壳胺作用HepG2 细胞10 min 后,总蛋白质的PTK 活性均受到抑制,且抑制效应有一定的浓度依赖性,浓度越高,对总蛋白质PTK的活性影响越大,浓度>1.0 mg/mL 后,抑制率超过20%。经t检验,各组浓度的甲壳胺对HepG2细胞总PTK活性均有不同程度的抑制作用(P<0.05)。
2.2 甲壳胺作用于HepG2细胞后PTK活性的变化
选用浓度为1.0 mg/mL 的甲壳胺作用于HepG2细胞不同时间后测定PTK 活性,结果见图2。随作用时间的不同,不同蛋白质样品的PTK 活性发生了先降后升的动态变化。
2.3 不同浓度甲壳胺对总蛋白质PTP活性的影响
不同浓度的甲壳胺作用于HepG2 细胞后,总蛋白质的PTP活性测定结果如图3。分析显示,不同浓度的甲壳胺对HepG2细胞总蛋白质PTP活性的影响无显著性差异。
2.4 甲壳胺作用于HepG2 细胞后蛋白质PTP 活性的变化
用1.0 mg/mL 的甲壳胺作用于HepG2 细胞不同时间,PTP活性呈先降后升的趋势,如图4,同时伴有PTP 的活性变化,可能反映了胞内蛋白酪氨酸残基的磷酸化与去磷酸化即时调节。
3 讨论
HepG2 细胞的凋亡涉及多个信号转导途径[6-8],为深入研究甲壳胺诱导凋亡的机理,我们在多时间点检测PTK 的活性,以反映其动态变化;同时检测PTP 的活性变化,反映其体内的调节。结果显示,不同浓度的甲壳胺对PTK 的活性均有抑制作用,且呈现一定的浓度依赖性,表明甲壳胺可特异性地抑制PTK的活性。
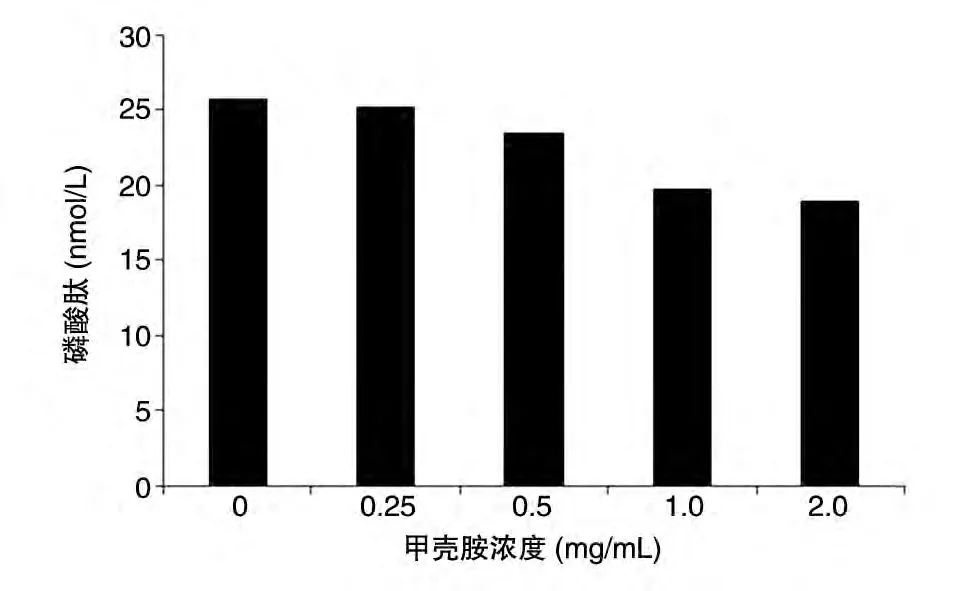
图1 不同浓度甲壳胺作用HepG2细胞30 min的磷酸肽-甲壳胺浓度曲线
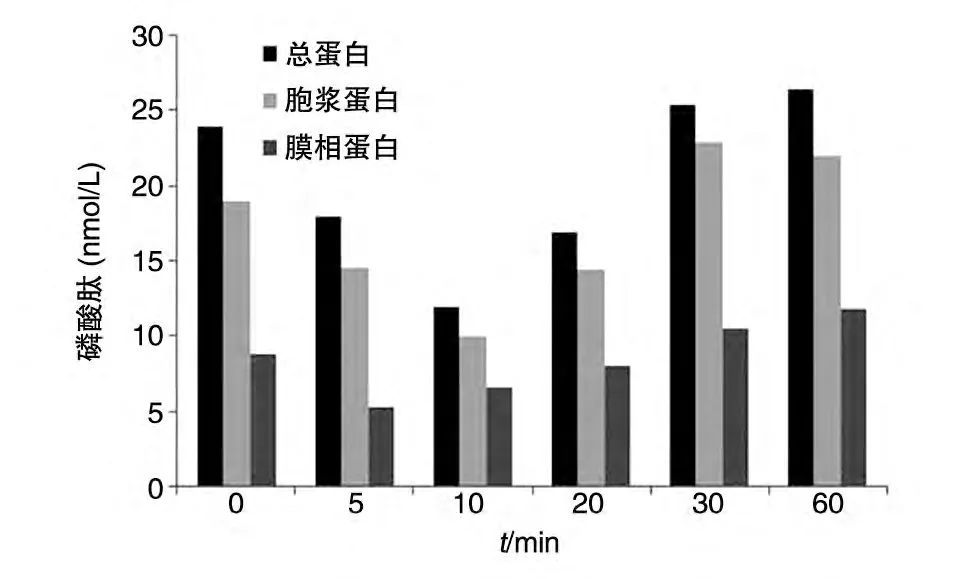
图2 1.0 mg/mL甲壳胺作用于HepG2细胞的磷酸肽-时间曲线
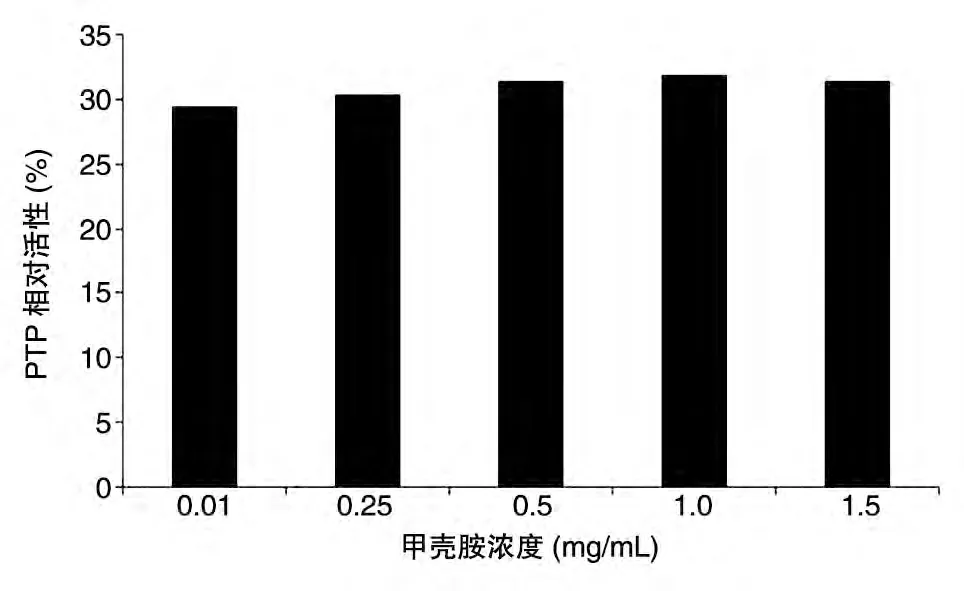
图3 不同浓度甲壳胺作用于HepG2细胞后总蛋白质PTP活性曲线
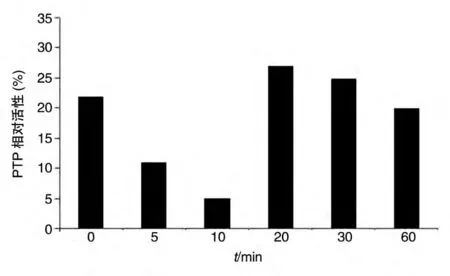
图4 甲壳胺作用于HepG2细胞不同时间的PTP活性曲线
蛋白质酪氨酸的可逆磷酸化是真核生物调控各种生理活动的重要机制,受作用相反的2 个酶即PTK(催化酪氨酸磷酸化)和PTP(催化酪氨酸脱磷酸化)的调节[9]。真核生物细胞通过这种可逆的平衡来调节细胞间与细胞内的通信,参与细胞的生长发育、调控基因转录与免疫等。实验发现,HepG2 细胞经一定浓度的甲壳胺处理后,总蛋白质、胞浆蛋白质、膜相蛋白质中的PTK 活性均有短暂下降,随后恢复正常。从下降的时相看,膜相蛋白质中的PTK 活性变化先于胞浆蛋白质中的PTK 活性变化,提示可能存在一个由外而内的跨膜信号转导过程。甲壳胺对分布不同的PTK 均有抑制作用,推测与细胞的信号转导有关,但因为膜蛋白的提取过程变性作用更强,可能导致酶活性的下降。而且,由于PTP类型众多,其确认的家族成员已超过100 个,究竟具体哪些酶在甲壳胺诱导癌细胞凋亡中发挥作用、是否存在特异性受体型蛋白酶等,还有待深入研究。
[1]徐文华,韩宝芹,孔晓颖,等.壳寡糖的抑瘤作用及其作用机制研究[J].中国海洋大学学报,2013,43(9):54-59.
[2]罗晓梅,郝妍,吴昊,等.壳聚糖及其衍生物在基因治疗应用中的研究进展[J].中国新药杂志,2013,22(14):1652-1666.
[3]Xia W S,Liu P,Zhang J L,et al.Biological activities of chitosan and chitooligosaccharides[J].Food Hydrocolloids,2011,25(2):170-179.
[4]Qia L F,Xua Z R.In vivo antitumor activity of chitosan nanoparticles[J].Bioorganic Med Chem Lett,2006,16(15):4243-4245.
[5]赵丽艳,孙宇,李明春,等.甲壳胺诱导人肝癌HepG2 细胞凋亡的实验研究[J].生物技术通讯,2011,22(2):252-254.
[6]Xie Y,Zhou N J,Gong Y F,et al.The immune response induced by Hpylori vaccine with chitosan as adjuvant and its relation to immune protection[J].World J Gastroenterol,2007,13(10):1547-1553.
[7]薛义炯,曾斌.PI3K/Akt 信号通路与HepG2 细胞的关系研究进展[J].社区医学杂志,2012,10,(24)46-47.
[8]Xu C M,Liu C J,Huang W,et al.Effect of Mst1 overexpression on the growth of human hepatocellular carcinoma HepG2 cells and the sensitivity to cisplatin in vitro[J].Acta Biochim Biophys Sinica,2013,45(4):268-279.
[9]Tiganis T,Bennett A M.Protein tyrosine phosphatase function:the substrate perspective[J].Biochemistry,2007,402(1):1-15.

