用于未纯化蛋白样品核酸适配体筛选的Western 印迹-SELEX筛选技术的建立
李慧 ,赵强,梁超,丁红梅,李洁,黄皑雪,苏雪婷,张令强,李少华,邵宁生
军事医学科学院a.基础医学研究所;b.放射与辐射医学研究所;北京 100850
指数富集的配体系统进化(systematic evolution of ligands by exponential enrichment,SELEX)技术是一种新型的高通量生物文库筛选技术[1-2]。经SELEX技术获得基于空间结构,与靶分子高特异性、高亲和力结合的寡核苷酸配基被称为适配体(aptamer)。由于随机文库中的寡核苷酸序列能形成多样的空间结构,因此SELEX 技术可筛选的靶分子范围十分广泛,包括金属离子、蛋白多肽、有机染料等,其中蛋白多肽类靶分子最多,包括酶、生长因子、抗体、转录因子、细胞黏附分子和选择素等[3-7]。完整的病毒颗粒、细菌病原体,甚至完整的哺乳动物细胞也可以通过完整细胞消减SELEX 技术筛选出其高亲和力的寡核苷酸配基[8-11]。SELEX 技术作为一种极其有用的分子生物学工具日益受到重视,并在基础医学、临床诊断和疾病治疗中都显示了广阔的应用前景。
传统SELEX 技术中以蛋白多肽类物质为靶标进行筛选时,首先需要获得单一的纯化蛋白,而很多蛋白、多肽类物质并不是单一的纯蛋白,从而使其无法作为靶标进行筛选。因此,我们尝试将Western印迹和SELEX 技术交叉结合,建立基于免疫印迹的蛋白筛选技术,即Western 印迹-SELEX 技术。利用该方法对蛋白、多肽类靶物质进行筛选时,不要求靶蛋白是纯化的、单一的,大大降低了筛选靶标的标准,提高了筛选效率。
1 材料与方法
1.1 随机单链DNA文库和引物
文库两端为固定的引物退火序列,中间为含45个碱基的随机序列,Gp45 文库序列为5'-GCAATG GTACGGTACTTCC(45N)CAAAAGTGCACGCTACT TTGCTAA-3'。正向引物Plong-1[5'-GCAATGGTA CGGTACTTCC-3',5'端进行生物素(Bio)修饰],反向引物Pstem-loop(5'-GCTAAGCGGGTGGGACTTCC TAGTCCCACCCGCTTAGCAAAGTAGCGTGCACTTT TG-3'),反向引物Pll(5'-TTAGCAAAGTAGCGTGC ACTTTTG-3')。Pll 用于扩增双链产物;Pstem-loop除含有与模板互补的序列外,5'端还含有33 个富含GC碱基的反向重复序列(下划线部分),用于阻断正链的延伸,PCR产生不同长度的单链DNA(ssDNA)。
1.2 Western印迹-SELEX筛选流程
取约1200 pmol 的Bio-Gp45 文库,100℃加热5 min 后迅速置于冰上冷却10 min,加入结合缓冲液(1×PBS,1 mmol/L MgCl2,1 μg/μL ytRNA,1 μg/μL wDNA,0.1% BSA)中,孵育体系为100 μL。文库先与转有消减蛋白的PVDF 膜于37℃孵育60 min,回收未结合的ssDNA,即消减文库,再与转有靶蛋白的PVDF膜于37℃孵育60 min,将PVDF膜放入含5 mL 洗涤缓冲液(1×PBS,1 mmol/L MgCl2)的平皿中洗涤3 次,每次5 min,再将PVDF 膜剪碎放入EP 管中,加入200 μL ddH2O,95℃煮10 min,离心收集液体,取5 μL做模板进行PCR扩增。重复上述步骤,共进行4 轮筛选。随着筛选轮次的增加,逐渐增加洗涤次数,缩短文库与靶蛋白孵育的时间,增加SELEX筛选的特异性。
1.3 次级文库的生成和回收
采用不对称引物PCR 方法获得次级ssDNA 文库,以Bio-Plong-1 和Pstem-loop 为引物,按100 μL体系进行PCR 反应(95℃预变性5 min;94℃变性1 min,37℃退火80 s,58℃延伸1 min;最后58℃终延伸5 min)。为减少非特异性扩增,提高文库质量,须优化PCR 扩增的循环数,9 个循环开始,每隔3 个循环取一次样,共扩增30 个循环,上样7 mol/L 尿素8%变性PAGE 胶分析,选择目的条带清晰的扩增循环数进行大量PCR 扩增,经7 mol/L 尿素8%变性凝胶分离,切胶回收目的单链,经洗脱、乙醇沉淀和离心,最终获得Bio标记的次级筛选文库。
1.4 富集文库的克隆、测序与分析
将富集文库用对称PCR 方法扩增成双链DNA(dsDNA),切胶纯化后连接到pUC18T 载体中,转化大肠杆菌DH5α,随机挑选50 个阳性克隆进行序列测定,采用RNAstructure 4.6软件和MEME在线软件(httt://meme.sdsc.edu/meme/cgi-bin/meme.cgi)分析适配体的一、二级结构。
1.5 适配体的特异性检测
将一定浓度的Bio 标记的适配体溶解于合适体积的缓冲液(1×PBS,1 mmol/L MgCl2)中,100℃变性5 min 后立即置于冰上充分冷却10 min,与转有靶蛋白(或其他无关蛋白,作为阴性对照)的PVDF 膜于37℃共孵育60 min,用洗涤缓冲液(1×PBS,1 mmol/L MgCl2)洗膜3 次,每次3 min,再将膜放到按1∶300 稀释的辣根过氧化物酶(HRP)反应液中室温孵育40 min,用同上洗涤缓冲液洗膜3 次,每次3 min,室温避光加显色液显色3 min,暗室压片显影。
在96 孔ELISA 板中每孔加入含2 μg 靶蛋白的蛋白包被液100 μL,4℃包被过夜,次日弃包被液,每孔加入100 μL 含1%酪蛋白(casein)的马来酸封闭液,室温封闭60 min,将不同浓度Bio 标记的适配体溶解于100 μL 孵育缓冲液(1×PBS,1 mmol/L MgCl2)中,100℃变性5 min 后立即置于冰上充分冷却10 min,再加到包被有靶蛋白的酶联条中,37℃孵育3 h,弃去孔内液体,每孔用350 μL 洗涤液洗涤3次,最后一次洗涤后把孔内液体完全甩干,每孔加入100 μL 按1∶100 稀释的HRP,室温孵育40 min,弃去孔内液体,洗板5 次,每孔加入100 μL TMB 显色底物37℃避光显色,当有明显颜色变化时,加10 μL终止液,酶联仪读取D450nm值。
2 结果
2.1 Western印迹-SELEX技术的建立
利用Western 印迹将相对分子质量不同的蛋白质通过电泳区分开,并转移至PVDF 膜上,通过BiossDNA 文库先与消减靶标孵育后,回收未结合的Bio-ssDNA 文库,将其与筛选靶标共同孵育,进一步通过洗涤、PCR 扩增、切胶回收获得次级文库,其流程如图1。
2.2 特异识别靶蛋白的ssDNA适配体的富集
采用Western 印迹-SELEX 技术进行循环筛选,利用生物素-链霉亲和素-辣根过氧化物酶系统检测每轮次级文库的富集情况。显影结果显示,随着筛选轮次的增加,与靶蛋白特异结合的适配体逐渐得到富集,与前3 轮富集文库相比,第4 轮文库中适配体的富集量得到大幅提升,暗室压片结果可见明显条带(图2),提示经过4轮筛选得到的寡核苷酸配基特异识别靶蛋白。
2.3 适配体一级结构同源性及二级结构分析
将第4 轮富集文库进行克隆测序,得到50 个适配体的序列,经MEME 在线软件对序列的同源性进行比较,共分为6 个家族(图3);进一步利用RNA structure 软件对每个家族中所包含序列的二级结构进行分析,初步挑选出6条适配体。
2.4 适配体与靶蛋白结合的特异性分析
Western 印迹分析表明,同原始文库Gp45 相比,挑选出的6 条适配体均与靶蛋白有一定的结合,其中6#适配体与靶蛋白的结合最强,只特异结合靶蛋白而不结合无关对照蛋白,而原始文库Gp45则与上述蛋白均无结合(图4)。
ELISA 分析表明,经生物素-链霉亲和素-辣根过氧化物酶系统检测后,6#适配体与靶蛋白孵育后的D450nm值最大,远高于原库Gp45,这一结果与Western 印迹检测结果一致。提示6#适配体不仅能特异识别经SDS 变性处理的靶蛋白,还能特异识别天然结构的靶蛋白(图4)。
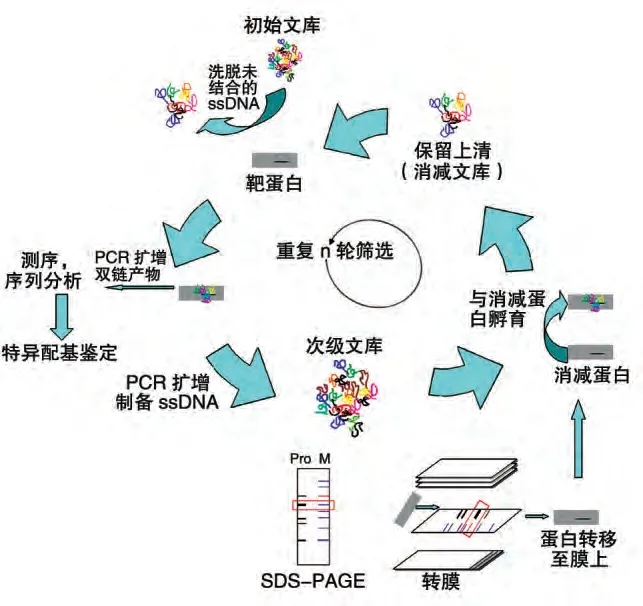
图1 Western印迹-SELEX筛选技术路线
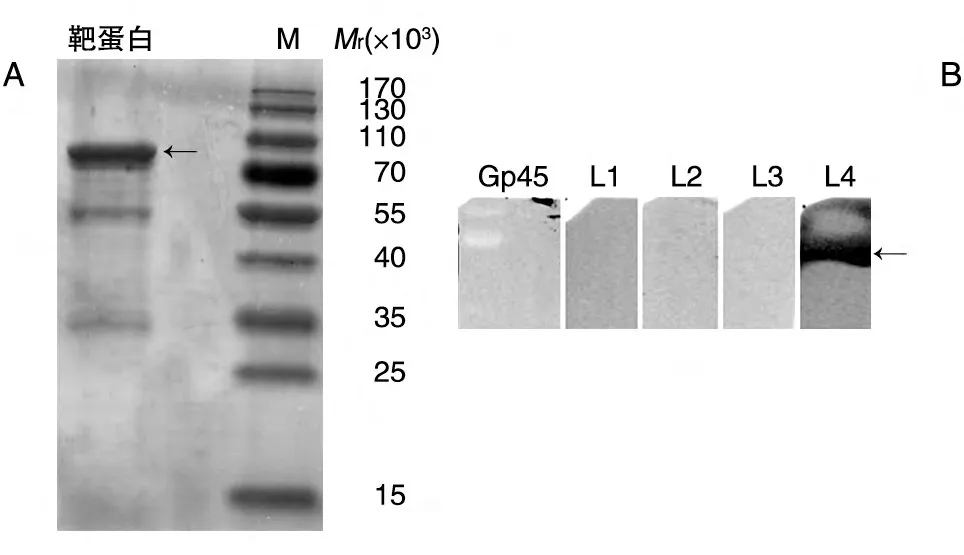
图2 富集文库与靶蛋白结合的鉴定
3 讨论
SELEX技术作为一种极其有用的分子生物学工具而日益受到重视,并在基础医学、临床诊断和疾病治疗中显示了广阔的应用前景。SELEX技术具有很多优点:①经SELEX 技术筛选出的寡核苷酸配基具有很强的特异性。茶碱与其他黄嘌呤类似物如咖啡因、可可碱的结构非常相似,而通过SELEX 方法筛选到的寡核苷酸配基只特异性地结合茶碱,与其他类似物无反应,与茶碱的亲和力比与咖啡因的亲和力高10 000倍[12]。由于寡核苷酸配基与蛋白质的结合力高于抗原与抗体之间的结合,因此,将生物素、荧光素、活性基团偶联到寡核苷酸配基上,可对新蛋白质进行细胞定位,也可用于分离纯化蛋白质。②由于寡核苷酸配基的高特异性和高亲和力,将其作为诊断试剂比抗体具有更高的灵敏度和准确性,而且这种特异性和亲和力还不受组织或样品中非靶蛋白的干扰。单独或与抗体组合应用于多种诊断模式已显示出其独特的优越性,特别是可以弥补抗体在诊断领域中应用的不足。③SELEX技术筛选还具有周期短的优点,并有望实现高通量筛选[13]。经SELEX技术筛选出的适配体不受免疫条件和免疫原性限制,可体外人工合成,变性与复性可逆,可修饰,并有利于长期保存和室温运输。经过近20 年的数据累积不难发现,人们在寡核苷酸配基和抗体方面所做的努力是朝着一个相同的方向迈进的。鉴于SELEX技术的优越性,也许在不久的将来,寡核苷酸配基很可能成为被动免疫中抗体的替代物,实验室里的单克隆抗体制备技术将会被一种费用不高、较为方便的SELEX技术所替代。
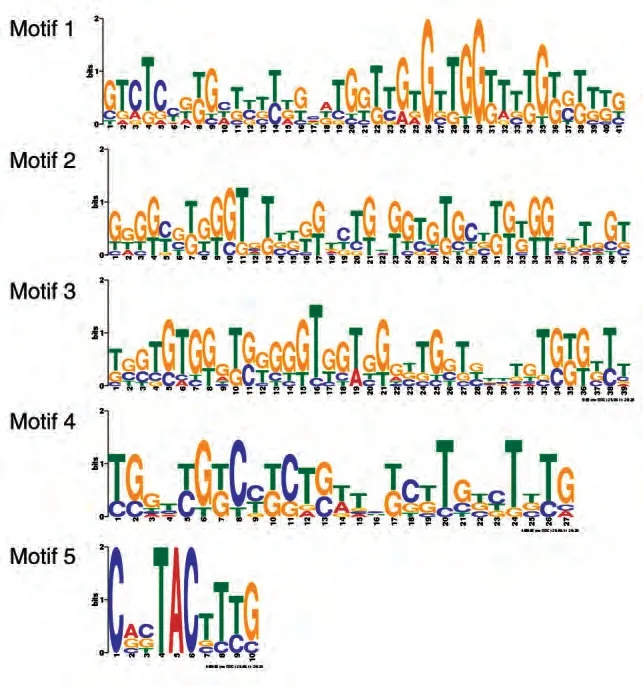
图3 MEME在线软件分析序列的同源性
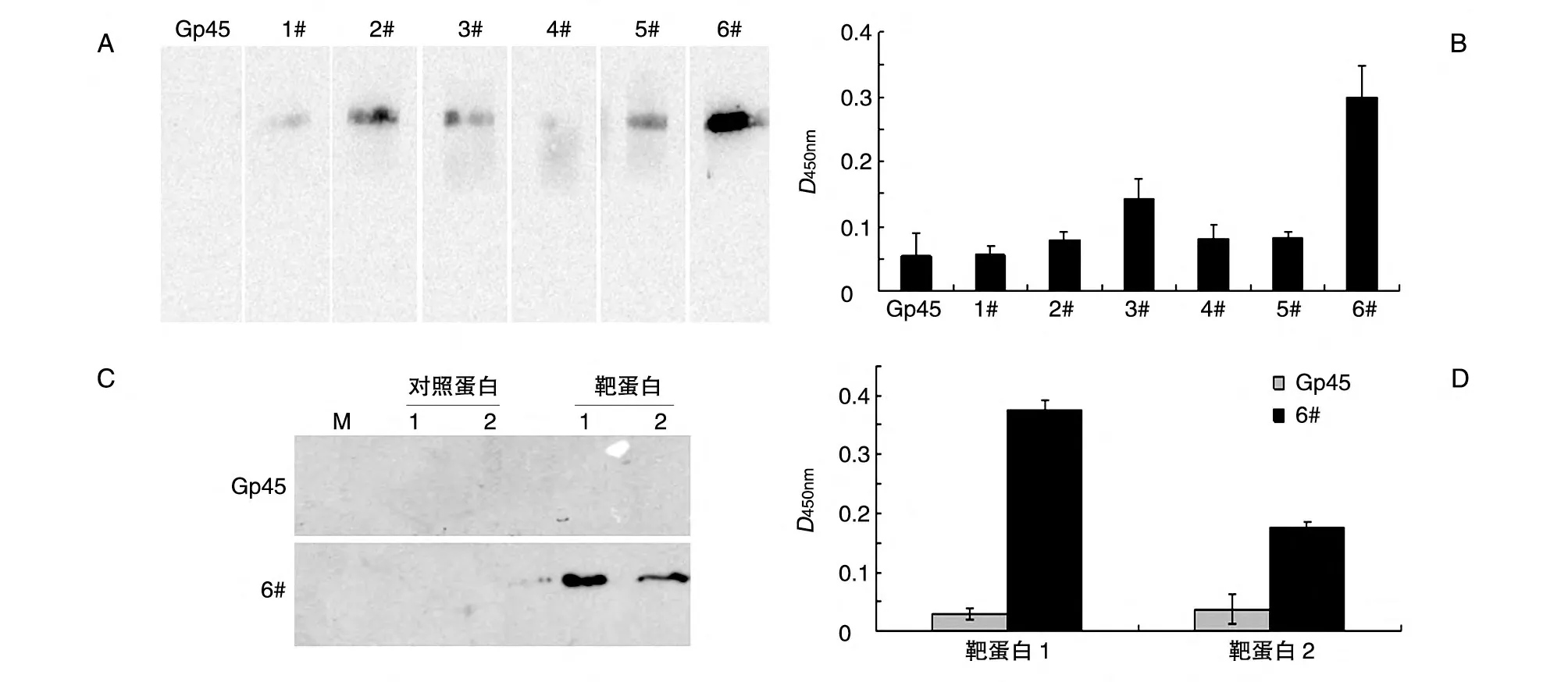
图4 挑选出的6条适配体与靶蛋白特异结合的鉴定
文库是否富集是SELEX 筛选成败的重要指标。经过4 轮筛选,我们获得了能够与靶蛋白特异结合的富集文库,分析、纯化这些差异适配体并对其进行DNA 序列测定,根据序列同源性及二级结构得到6 条有代表性、结构稳定的适配体,检测发现2#、3#、5#和6#适配体均能与靶蛋白特异结合,其中6#适配体与靶蛋白的结合最明显,只特异结合靶蛋白而不结合无关对照蛋白。这一结果一方面说明我们建立的Western 印迹-SELEX 技术是可信稳定的,另一方面也表明适配体可以像抗体一样作为诊断试剂,或经过改造用于预防与治疗疾病。
综上,我们建立了一种新的SELEX 筛选方法,即Western 印迹-SELEX。蛋白质的Western 印迹技术结合了凝胶电泳的高分辨率和固相免疫测定的特异敏感等多种特点,可检测到低至1~5 ng 的靶蛋白。将Western 印迹和SELEX 技术结合起来,可以实现非纯化蛋白的筛选,大大提高了筛选速度和效率,为SELEX 技术在基础医学、临床诊断和疾病治疗等方面开辟了一条新的途径,有良好的应用前景。
[1]Ellingtion A D,Szostak J W.In vitro selection of RNA molecules that bind specifical[J].Nature,1990,346(6287):818-822.
[2]Tuerk C,Gold L.Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase[J].Science,1990,249(4968):505-510.
[3]Tang Jijun,Xie Jianwei,Shao Ningsheng,et al.The DNA aptamers that specifically recognize ricin toxin are selected by two in vitro selection methods[J].Electrophoresis,2006,27(7):1303-1311.
[4]Williams B A R,Lin L,Lindsay S M,et al.Evolution of a histone H4-K16 acetyl-specific DNA aptamer[J].J Am Chem Soc,2009,131(18):6330-6331.
[5]Cella L N,Sanchez P,Zhong W,et al.Nano aptasensor for protective antigen toxin of anthrax[J].Anal Chem,2010,82(5):2042-2047.
[6]Tran D T,Janssen K P F,Pollet J,et al.Selection and characterization of DNA aptamers for egg white lysozyme[J].Molecules,2010,15(3):1127-1140.
[7]Tok J,Lai J,Leung T,et al.Selection of aptamers for signal transduction proteins by capillary electrophoresis[J].Electrophoresis,2010,31(12):2055-2062.
[8]Mosing R K,Mendonsa S D B,Bowser M T,et al.Capillary electrophoresis-SELEX selection of aptamers with affinity for HIV-1 reverse transcriptase[J].Anal Chem,2005,77(19):6107-6112.
[9]Chen Fan,Zhou Jing,Luo Fengling,et al.Aptamer from whole-bacterium SELEX as new therapeutic reagent against virulent Mycobacterium tuberculosis[J].Biochem Biophys Res Commum,2007,357:743-748.
[10]Wang Chenglong,Zhang Ming,Yang Guang,et al.Singlestranded DNA aptamers that bind differentiated but not parental cells:subtractive systematic evolution of ligands by exponential enrichment[J].J Biotechnol,2003,102:15-22.
[11]Shangguan D,Cao Z C,Li Y,et al.Aptamers evolved from cultured cancer cells reveal molecular differences of cancer cells in patient samples[J].Clin Chem,2007,53:1153-1155.
[12]Jenison R D,Gill S C,Pardi A,et al.High-resolution molecular discrimination by RNA[J].Science,1994,263(5152):1425-1429.
[13]邵宁生,杨光,房涛,等.生物文库技术-噬菌体展示与SELEX技术[M].北京:军事医学科学院出版社,2011.

