4株沙漠小球藻对几种常用抗生素的敏感性研究
朱军保,王丹,汪文伦,许万云,高剑峰
石河子大学 生命科学学院,新疆 石河子 832000
微藻是地球上最早出现的生命类群,是一类可利用光合作用的低等植物,一般为单细胞结构,呈群体或丝状,种类繁多,分布极其广泛,在海洋、淡水湖泊、树干、潮湿的土壤、干燥的沙漠,只要有光和潮湿的地方都有藻类的身影[1-3]。沙漠中藻类的分布也极其广泛,其中大多数为绿藻和蓝藻。沙漠小球藻就是生长在沙漠中的绿藻。这些藻类生长在干旱半干旱区,地面完全被沙所覆盖,植物稀少,雨水缺乏,空气干燥,环境极其恶劣[4]。可以说,沙漠小球藻是绿藻门中具有极强生命力的一类微藻。
小球藻是比较经济型的绿色单细胞植物,细胞形态为椭圆形或圆形,直径为2~12 μm,细胞壁一般较薄,少数坚固,有时会分泌黏质使其多个细胞黏在一起,人们用肉眼很难看到,需要借助显微镜进行辨别[5]。小球藻由于其生态分布广,繁殖速度快,培养简便,廉价等特点,是用于生物技术及生物质能源研究的理想材料,而利用基因工程技术研究小球藻是微藻生物技术的一个重要分支。在小球藻基因工程中,最为重要的环节是选择合适的选择标记基因。迄今在小球藻基因工程中确定选择标记基因的最常用方法有2 种,一种方法是抗生素筛选法,另一种是代谢突变补偿方法[6]。将抗性基因和目的基因同时转入被转化的藻细胞中,并且在含有抗性的培养基中筛选出阳性克隆,即为抗生素法选择标记基因。
我们运用微藻在液体培养过程中藻液颜色变化、血球板细胞计数和藻细胞固体平板培养的方法,系统性研究了4 株沙漠小球藻对几种基因工程中常用抗生素的敏感性,以期为今后的沙漠小球藻基因工程研究提供实验基础资料。
1 材料与方法
1.1 材料
4 株沙漠小球藻均由本实验室从新疆沙漠沙样中分离鉴定,其中GTD8A1、GTD4A-1 和GTD7C-2分离自古尔班通古特沙漠,TLD6B 分离自塔克拉玛干沙漠[7-8]。
5 种抗生素均购自北京索莱宝科技有限公司,抗生素母液的配制参照《分子克隆实验指南》[9]。各抗生素储存液质量浓度为:氨苄西林(Ap)100 mg/mL,头孢霉素(Cef)50 mg/mL,卡那霉素(Km)50 mg/mL,氯霉素(Cm)50 mg/mL,链霉素(St)50 mg/mL。其中氯霉素用无水乙醇配制成母液,其他抗生素溶液均用无菌蒸馏水配制;采用0.22 μm 滤膜过滤除菌,贮存于-20℃冰箱中。
藻种所用的BBM 培养基[10]:NaNO3250 mg/L,KH2PO4175 mg/L,K2HPO475 mg/L,MgSO4·7H2O 75 mg/L,CaCl2·2H2O 25 mg/L,NaCl 25 mg/L,EDTA 50 mg/L,KOH 31 mg/L,FeSO4·7H2O 4.98 mg/L,H3PO411.42 mg/L,ZnSO4·7H2O 8.82 mg/L,MnCl21.44 mg/L,MnO30.71 mg/L,CaSO4·5H2O 1.57 mg/L,Co(NO3)2·6H2O 0.49 mg/L,98% H2SO42 μL/L(可在以上组分中加入15~20 g 琼脂,加入蒸馏水补至1 L 制成固体培养基,121℃灭菌20 min,4℃保存)。
LB 培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L(加去离子水溶解至终体积1 L,用1 mol/L NaOH 调pH 值为7.0~7.4,同时加入15~20 g琼脂粉,制成固体培养基,121℃灭菌20 min)。
1.2 藻细胞的预培养
将分离纯化的4 株沙漠小球藻按相同浓度接种于含有BBM 培养基的三角瓶中,在光照度为2500 lx、光暗周期12 h/12 h、温度为23℃的条件下在光照培养箱中培养,15~20 d为1个周期。
1.3 4株沙漠小球藻对5种抗生素的敏感性测定
分别取经活化后培养至对数生长期的藻种GTD8A1、GTD4A-1、GTD7C-2 和TLD6B(相同浓度)0.5 mL 加入六孔板中,再加入相应的不同浓度的抗生素(表1)及5 mL BBM 液体培养基,抗生素浓度由多次预试验确定,每个浓度设立2 个平行观察培养,并设置对照组(不添加任何抗生素)同时比对各藻液颜色变化,每24 h用血球计数板计数1次,连续计数7 d。
血球计数板测定方法:每次取50 μL藻液,用碘液(称取13 g 碘及35 g 碘化钾,溶于100 mL 水中,稀释定容至1000 mL,摇匀,贮存于棕色瓶中)固定,用血球计数板在光学显微镜下测定藻细胞密度[11]。
2 结果
2.1 不同抗生素对沙漠小球藻生长状况的影响
2.1.1 对GTD8A1 生长状况的影响 图1 是GTD8A1 经不同抗生素不同浓度梯度处理后培养至第7 d 时与未加抗生素的藻液培养至第7 d 时的藻细胞数差值,柱图在横轴上方表明抗生素促进了藻细胞的生长,反之则抑制了藻细胞的生长。由图可知,氨苄西林在一定的浓度梯度内具有促进GTD8A1 生长的作用,且在100~800 μg/mL 浓度内,随着氨苄西林浓度的升高,其促进生长的作用越来越明显。头孢霉素相对于氨苄西林促进GTD8A1 生长的作用更为强烈,浓度为400 μg/mL 时对GTD8A1 生长的促进作用最为明显,7 d 时的细胞密度为空白对照组的2 倍。镜检氨苄西林和头孢霉素在以上浓度范围内的藻液,发现二细胞较多,可见在一定浓度范围内氨苄西林和头孢霉素促进了GTD8A1 的分裂繁殖,而当氨苄西林浓度达到1000 μg/mL、头孢霉素浓度达到800 μg/mL 时,二者对藻细胞的生长才有明显的抑制作用。而卡那霉素、氯霉素和链霉素在所设浓度梯度范围内对GTD8A1 的生长都有较为明显的抑制作用,在所设最低浓度25 μg/mL 时就已经表现出了对藻细胞生长的抑制作用,且随着抗生素浓度的增加,对GTD8A1 生长的抑制作用越来越明显,没有促进藻细胞的生长。比较这3种抗生素对GTD8A1生长的抑制作用,可发现氯霉素的抑制作用远远低于链霉素,卡那霉素的抑制作用则介于氯霉素与链霉素之间。因此,高浓度的头孢霉素适用于实验室大规模化培养GTD8A1;做基础无菌培养时,可选择对GTD8A1 生长影响最小的低浓度氨苄西林作为抑菌剂;而链霉素和卡那霉素可作为GTD8A1 藻细胞基因工程遗传转化的选择标记。
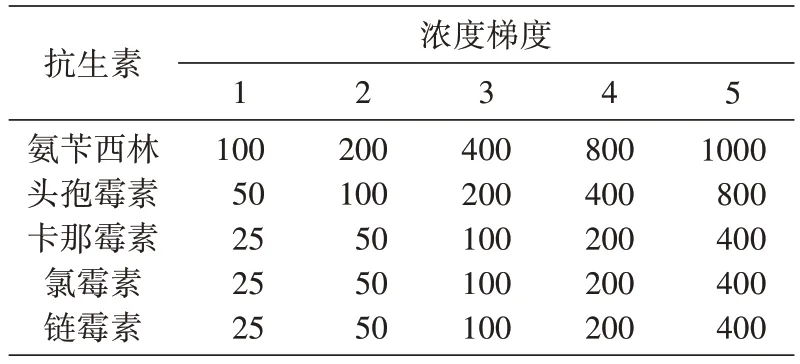
表1 5种抗生素的浓度梯度(μg/mL)

图1 5种抗生素不同浓度梯度与未加抗生素作用下培养至第7 d时GTD8A1的细胞计数差值
2.1.2 对GTD4A-1 生长状况的影响 图2 是GTD4A-1 经不同抗生素不同浓度梯度处理后培养至第7 d 时与未加抗生素的藻液培养至第7 d 时的藻细胞数差值。由图可知,氨苄西林在一定的浓度梯度内具有促进GTD4A-1 生长的作用,且在100~800 μg/mL 浓度梯度内,随着氨苄西林浓度的升高,其促进生长的作用越来越明显,在7 d 时,氨苄西林浓度为800 μg/mL 的藻细胞密度约为未加氨苄西林细胞密度的1.5 倍,而低浓度的氨苄西林(如浓度为100 μg/mL)对GTD4A-1 的生长影响不大,高浓度(1000 μg/mL)的氨苄西林抑制GTD4A-1 的生长。低浓度的头孢霉素对GTD4A-1 具有较强的生长促进作用,在一定浓度范围内,随着头孢霉素浓度的升高,这种促进作用逐渐降低,浓度为800 μg/mL 时抑制GTD4A-1 生长的作用最为明显;浓度为50 μg/mL 时促进GTD4A-1生长的作用最为明显,7 d时细胞密度为空白对照的3 倍多。低浓度的氯霉素对GTD4A-1 的影响不大,具有一定的抑菌性,高浓度的氯霉素对GTD4A-1 的生长具有较强的抑制作用。链霉素、卡那霉素对GTD4A-1的生长具有明显的抑制作用,在所设最低浓度25 μg/mL 时对GTD4A-1 的生长就表现出抑制作用,且随着浓度的增加,对GTD4A-1 的抑制作用越来越明显。因此,在制备无菌藻液时可选用适当浓度的氨苄西林、头孢霉素或氯霉素作为抑菌剂,而卡那霉素和链霉素可作为GTD4A-1 藻细胞基因工程遗传转化的选择标记。
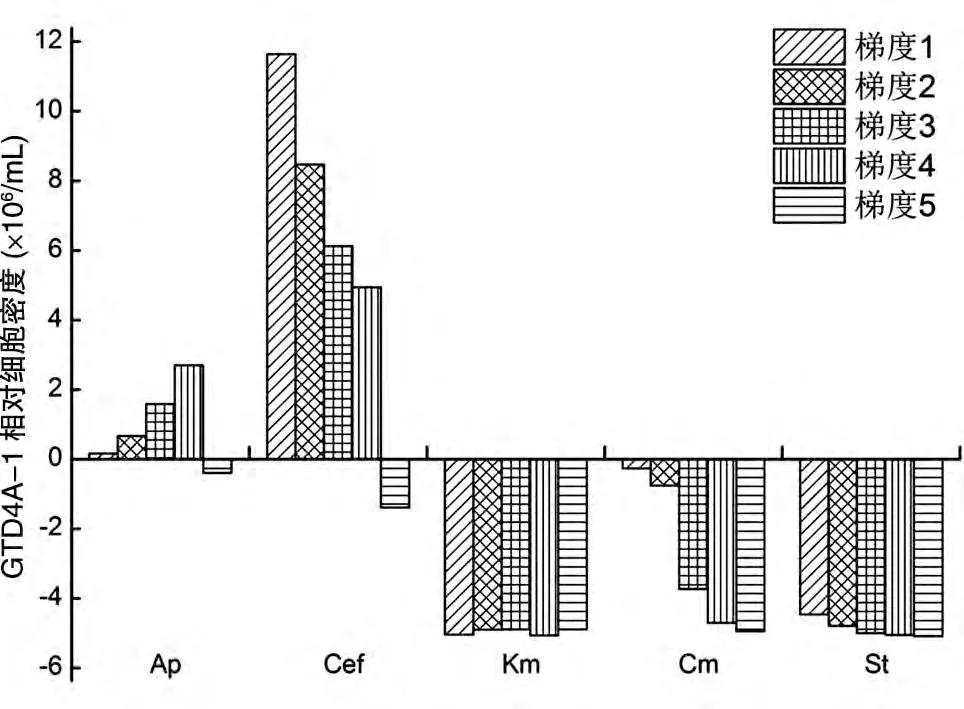
图2 5种抗生素不同浓度梯度与未加抗生素作用下培养至第7 d时GTD4A-1的细胞计数差值
2.1.3 对GTD7C-2 生长状况的影响 图3 是GTD7C-2 经不同抗生素不同浓度梯度处理后培养至第7 d 时与未加抗生素的藻液培养至第7 d 时的藻细胞数差值。由图可知,5 种抗生素在所设的梯度范围内对GTD7C-2 的生长均具有不同程度的抑制作用。低浓度的氨苄西林对GTD7C-2 生长的抑制作用不太显著,高浓度则抑制GTD7C-2 的生长,总体来讲,随着氨苄西林浓度的增加,其对藻细胞生长的抑制作用越来越强,当浓度达到最大1000 μg/mL 时,对GTD7C-2 生长的抑制作用最强。低浓度的头孢霉素对GTD7C-2 的生长影响不大,在所设的最高浓度800 μg/mL 时对GTD7C-2 的生长才有强烈的抑制作用。卡那霉素、氯霉素和链霉素对GTD7C-2 的生长抑制作用较为明显,在所设最低浓度25 μg/mL 时就表现出很强的敏感性,不过在所设浓度梯度内对GTD7C-2 生长的这种抑制作用没有太大变化。因此,在制备无菌藻液时可选用适当浓度的氨苄西林和头孢霉素作为抑菌剂,而卡那霉素、氯霉素和链霉素可作为GTD7C-2 藻细胞基因工程遗传转化中的选择标记。

图3 5种抗生素不同浓度梯度与未加抗生素作用下培养至第7 d时GTD7C-2的细胞计数差值
2.1.4 对TLD6B生长状况的影响 图4是TLD6B经不同抗生素不同浓度梯度处理后培养至第7 d 时与未加抗生素的藻液培养至第7 d 时的藻细胞数差值。由图可知,TLD6B 对低浓度的氨苄西林与头孢霉素的敏感性不大,氨苄西林浓度为200 μg/mL、头孢霉素浓度为50 μg/mL时,对TLD6B的生长基本没有表现出抑制作用;当氨苄西林浓度为400 μg/mL、头孢霉素浓度为100 μg/mL 以上时,对TLD6B 的生长才表现出较为明显的抑制作用,且随着抗生素浓度的增加,其抑制作用越来越强。TLD6B对链霉素、卡那霉素、氯霉素都较为敏感,这3 种抗生素在所设最低浓度25 μg/mL 时对TLD6B 的生长就有非常明显的抑制作用,且随着抗生素浓度的增加,抑制作用越来越明显,其抑制作用强度依次为链霉素>卡那霉素>氯霉素。因此,可在TLD6B 的培养液中加入低浓度的氨苄西林或头孢霉素作为抑菌剂,这样不仅可以避免污染,还对TLD6B 细胞的生长具有促进作用,适于实验室的规模化培养和无菌藻液的制备;而链霉素、卡那霉素则可作为TLD6B 藻细胞基因工程遗传转化中的选择标记。
2.2 不同抗生素作用下沙漠小球藻培养液颜色的变化
依据前述方法,用抗生素处理各藻种,定期观察六孔板中各藻液颜色的变化,培养7 d 时的各藻液颜色结果见表2。
2.3 沙漠小球藻对不同抗生素的敏感性测定结果
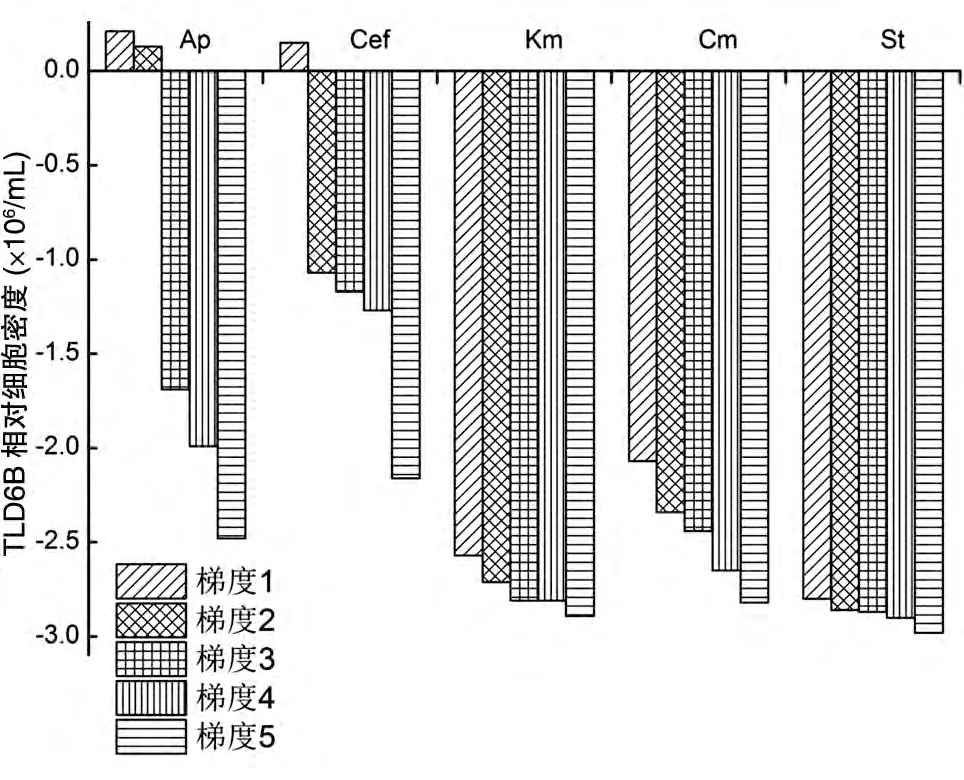
图4 5种抗生素不同浓度梯度与未加抗生素作用下培养至第7 d时TLD6B的细胞计数差值
综合各抗生素对4 株沙漠小球藻生长状况的影响及其培养到7 d时培养液颜色的变化,将4株沙漠小球藻对各抗生素的敏感性总结于表3,当各抗生素的浓度达到表中数值时,都对各藻株的生长具有明显的抑制作用,表现为非常敏感。
3 讨论
从国外研究进展来看,迄今选择标记小球藻基因工程中常用的是G418(氨基糖苷类抗生素)[12-13]和潮霉素[14-16],但不同种类的小球藻对抗生素的敏感性不一,以上研究结果也有差别。从国内进展看,王逸云等[17]对从海水里分离纯化得到的一株小球藻做了10 种常用抗生素的敏感性实验,结果表明这株小球藻对新霉素、庆大霉素、卡那霉素、头孢霉素、链霉素和氨苄西林不敏感,对G418 和潮霉素敏感,对博来霉素和氯霉素非常敏感。陈颖等[18]对椭圆小球藻的抗生素敏感性做了研究,结果表明椭圆小球藻对链霉素、氯霉素和卡那霉素不敏感,对潮霉素敏感,对G418非常敏感。淦志兵等[19]进行了原壳小球藻的抗生素敏感性实验,结果表明原壳小球藻对氯霉素不敏感,对卡那霉素、链霉素、壮观霉素敏感,对潮霉素极其敏感,对G418 非常敏感。屈建航[20]对普通小球藻抗生素敏感性的实验研究表明,该小球藻对四环素、氯霉素、卡那霉素和氨苄西林的敏感性不明显。
目前有关沙漠环境中的小球藻基因工程选择标记筛选研究还未见报道。在本实验中,我们探讨了4株沙漠小球藻的抗生素敏感性,发现4株沙漠小球藻对氨苄西林和头孢霉素都不是很敏感,而对卡那霉素、氯霉素和链霉素都很敏感,这与淦志兵[19]的结果相符,但却与王逸云[17]、陈颖[18]、屈建航[20]的研究结果不尽一致。造成这种差异的可能原因有:①藻种不同,对抗生素的敏感性也不同;②生长环境和所用培养基的营养成分不同,对抗生素的敏感性程度可能也不同。提示我们,在做某一类藻种的基因工程遗传转化选择标记研究时,均须进行大量抗生素浓度梯度敏感性实验,以确定最佳遗传转化选择标记。
综上,我们就4株沙漠小球藻对5种常用抗生素的敏感性做了初步研究,最终确定卡那霉素和链霉素可作为这4 株沙漠小球藻基因工程遗传转化的选择标记,为今后沙漠小球藻基因工程遗传转化选择标记提供了资料。
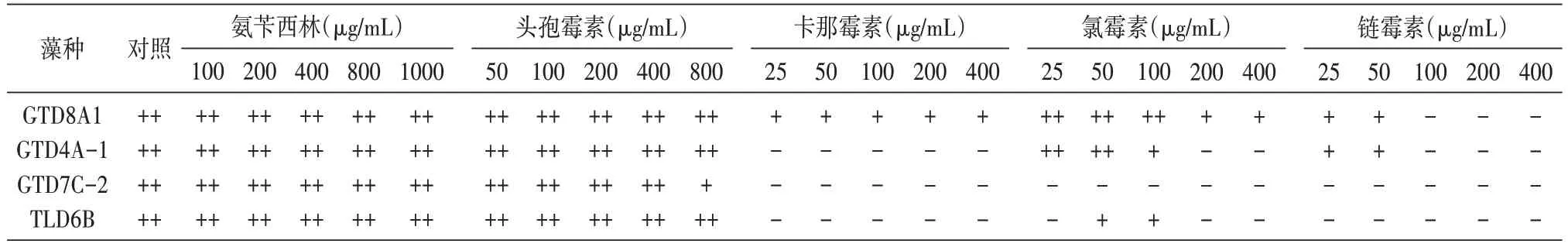
表2 不同抗生素作用下沙漠小球藻培养液颜色的变化
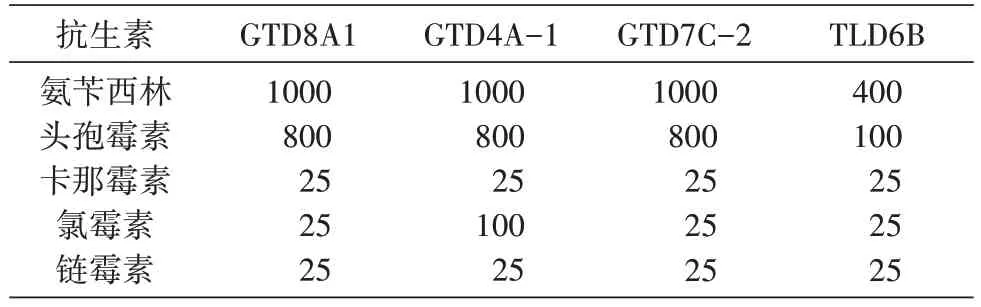
表3 4株沙漠小球藻对各抗生素的敏感性测定结果(μg/mL)
[1]Apt K E,Behrens P W.Commercial developments in microalgal biotechnology[J].Phyeology,1999,35:215-226.
[2]蓼晓玲,吴庆余.微藻生物质可再生能源的开发利用[J].可再生能源,2003,3(109):13-16.
[3]赵建成,张丙昌,张元明.新疆古尔班通古特沙漠生物结皮绿藻研究[J].干旱区研究,2006,23(2):189-194.
[4]孟春晓,高政权.微藻生物反应器的研究进展[J].水利渔业,2007,27(5):6-8.
[5]丁希民.小球藻的作用及优劣鉴别[J].科学养鱼,2012,(5):24-25.
[6]Potvin G,Zhang Z.Strategies for high-level recombinant protein expression in transgenic microalgae:a review[J].Biotechnol Adv,2010,28(6):910-918.
[7]李芳芳,隋正红,高剑峰,等.6 株沙漠绿藻的分离鉴定及其18SrDNA 保守区片段差异分析[J].石河子大学学报(自然科学版),2012,30(3):265-270.
[8]李芳芳,隋正红,高剑峰,等.两种沙漠微藻的形态学和分子生物学鉴定[J].干旱区资源与环境,2013,27(3):167-172.
[9]萨姆布鲁克,拉塞尔.分子克隆实验指南[M]∥黄培堂,等译.北京:科学出版社,2002:1599-1599.
[10]土壤微生物研究会[日].土壤微生物实验法[M]∥叶维青,张维谦,周鹏里,等译.北京:科学出版社,1983:653-653.
[11]秦翠丽,李松彪.微生物学实验技术[M].北京:兵器工业出版社,2008:55-56.
[12]Bai L L,Yin W B,Chen Y H,et al.A new strategy to produce a defensin:stable production of mutated NP-1 in nitrate reductase-deficient Chlorella ellipsoidea[J].PLoS One,2013,8(1):e54966-e54966.
[13]Hawkins R L,Nakamura M.Expression of human growth hormone by the eukaryotic alga,Chlorella[J].Curr Microbiol,1999,38(6):335-341.
[14]Cha T S,Yee W,Aziz A.Assessment of factors affecting Agrobacterium-mediated genetic transformation of the unicellular green alga,Chlorella vulgaris[J].World J Microbiol Biotechnol,2012,28(4):1771-1779.
[15]Chow K C,Tung W L.Electrotransformation of Chlorella vulgaris[J].Plant Cell Rep,1999,18(9):778-780.
[16]Huang C C,Chen M W,Hsieh J L,et al.Expression of mercuric reductase from Bacillus megaterium MB1 in eukaryotic microalga Chlorella sp.DT:an approach for mercury phytoremediation[J].Appl Microbiol Biotechnol,2006,72(1):197-205.
[17]王逸云,王长海.小球藻基因工程选择标记研究[J].大连理工大学学报,2007,47(4):509-514.
[18]陈颖,李文彬,张利明,等.小球藻对5种常用基因工程抗生素的敏感性研究[J].海洋与湖沼,1999,30(5):500-505.
[19]淦志兵,李美芽,施春雷,等.原壳小球藻对6种常用抗生素的敏感性评价[J].中国食品学报,2012,12(7):171-177.
[20]屈建航.5 种绿藻对几种常用抗生素的敏感性[J].大连轻工业学院学报,2004,23(2):111-113.

