一个水稻β-肌动蛋白基因的克隆及其亚细胞定位
李培培 ,谢礼,薛进,3,羊健,李静,严成其,张恒木,陈剑平
1.浙江师范大学 生化学院,浙江 金华 321000;2.浙江省农业科学院 省部共建国家重点实验室培育基地,农业部植物保护与生物技术重点实验室,浙江省植物病毒重点实验室,浙江 杭州 310021;3.植物疾病控制与利用湖南省高校重点实验室,植物病虫害生物学与防控湖南省重点实验室,湖南农业大学,湖南 长沙 410128
肌动蛋白是真核生物中普遍存在的一种结构蛋白,具有高度的保守性[1]。植物肌动蛋白是一种单一的多肽链球状蛋白,由375~377 个氨基酸残基组成,其相对分子质量约为42×103[2]。根据肌动蛋白等电点的不同,可将其分为3类:α-肌动蛋白主要分布于各种肌肉细胞中,β-肌动蛋白与γ-肌动蛋白主要分布于肌细胞和非肌细胞中。β-肌动蛋白与γ-肌动蛋白是不同类型的细胞中最为丰富的蛋白质,一方面在维持和调节细胞基质的结构中起关键作用;另一方面,它们还是非肌肉细胞化学信号传导系统的重要组成部分,并与肌动蛋白结合蛋白共同参与细胞的各种生理活动,如易位及细胞形态的改变[3]。
β-肌动蛋白是主要的细胞骨架蛋白,在真核细胞中有至关重要的作用[4]。该蛋白高度保守,并常被用作“内参基因”[5]。β-肌动蛋白以螺旋的方式聚合成肌动蛋白丝(或微丝),构成真核细胞三维网络结构骨架,为细胞提供机械支持并决定细胞的形态。此外,β-肌动蛋白还参与许多细胞生理过程,包括细胞黏附、细胞迁移或移动、细胞分裂、胞质分裂、胞吞/胞吐作用、信号转导、mRNA 定位和转录等[6]。近期的研究表明,β-肌动蛋白可以通过与热激蛋白90相互作用来调节血小板一氧化氮合酶3 的活性[7]。有报道β-肌动蛋白与病毒的增殖和装配有关,当β-肌动蛋白受到细胞松弛素D(一种肌动蛋白聚合抑制剂)的干扰时,传染性支气管炎病毒粒子的装配和出芽会被阻断[8]。用肌动蛋白抑制剂处理细胞时,可以在渗透部位看到细胞的防御反应,如细胞质聚集、核运动、形成乳突及过敏性细胞死亡[9-12]。Song 等[13]的研究表明,肌动蛋白细胞骨架结构及肌动蛋白结合蛋白在由小麦条锈菌引起的小麦条锈病的防御反应中有重要作用。
以植物肌动蛋白为主形成的动态微丝骨架系统已成为植物细胞生物学研究领域的热点之一[9]。有关植物肌动蛋白基因家族的研究比较透彻的是拟南芥(Arabidopsis thaliana)。拟南芥的肌动蛋白家族包含10 个肌动蛋白基因(actin genes,ACT),其中8个编码的功能蛋白ACT1/3/4/11/12 与生殖生长相关,ACT2/7/8 与营养生长相关,另外2 个(ACT5与ACT9)有可能是假基因[14]。在水稻中已克隆出很多肌动蛋白基因,但有关其功能与定位的研究报道还很少。我们克隆了一个水稻β-肌动蛋白基因,并利用胶体金免疫电镜技术对β-肌动蛋白在水稻细胞内的分布情况进行了详细观察和描述,为进一步研究肌动蛋白的功能提供亚细胞定位的依据,同时也为维管束细胞学的研究提供基础。
1 材料与方法
1.1 材料
日本晴水稻(Oryza sativaL.ssp.japonicacv.Nipponbare)样品采自浙江省农业科学院试验大田内;大肠杆菌Trans1-T1 感受态细胞、克隆载体pEASY-T5 Zero Cloning Vector 均购自北京全式金生物技术有限公司(TransGen Biotech);TRIzol 试剂、SuperScriptⅢReverse Transcriptase 试剂盒均为Invitrogen 公司产品;RNase 抑制剂、dNTP Mix、ExTaqDNA 聚合酶、限制性内切酶等购自TaKaRa 公司;凝胶纯化试剂盒、质粒提取试剂盒均为Promega公司产品;肌动蛋白鼠单抗购自Agrisera 公司,该抗体针对拟南芥肌动蛋白制备,经公司验证其对水稻肌动蛋白呈阳性反应;胶体金二抗(10 nm 羊抗鼠的IgG 抗体)购自Sigma 公司;克隆肌动蛋白特异引物与oligo-dT 通用引物均由上海英骏生物技术有限公司合成;其他生化试剂均为国产分析纯以上产品。
1.2 cDNA的获得
用TRIzol 法提取水稻叶片组织的总RNA[15]。采用Invitrogen 公司的逆转录试剂盒合成cDNA。取总RNA 2 μg、oligo-dT 1 μL、10 mmol/L dNTP Mix 1 μL,用DEPC 水补足13 μL,65℃变性5 min 后,置冰上至少1 min,随后加入5×第一链缓冲液4.0 μL、0.1 mol/L DTT 1 μL、40 U/μL RNA 酶抑制剂1 μL、SuperscriptⅢ逆转录酶1 μL,组成20 μL 体系,42℃反应10 min,55℃反应1 h,70℃处理15 min,将制备好的cDNA置于-20℃保存备用。
1.3 基因的扩增与鉴定
取cDNA 2 μL、20 μmol/L 上游引物Actin-F(5'-ATGGCTGATTCTGAGGATATTCA-3')与下游引物Actin-R(5'-TTAGAAGCATTTTCTATGTACAAT G-3')各0.6 μL、10×EXTaq缓冲液5 μL、2.5 mmol/L dNTP Mix 4 μL、5 U/μL ExTaqDNA 聚合酶0.5 μL,加ddH2O 补足50 μL 体系,然后运行以下PCR 程序:94℃5 min,94℃30 s,60℃40 s,72℃90 s,35 个循环,循环结束后继续反应10 min。用1%琼脂糖凝胶电泳(1×TAE 电泳缓冲液、180 V 电压)检测PCR扩增产物,并对目的基因片段进行切胶回收并纯化。将纯化的目的基因片段通过T-A克隆的方法连接到pEASY-T5 Zero 克隆载体上,然后转化大肠杆菌Tran1-T1 感受态细胞,PCR 筛选阳性克隆,提取质粒后进行测序分析。
1.4 样品固定聚合和切片
取新鲜水稻叶片,避开叶脉将其切成1 mm×3 mm 的小片,用0.1 mol/L 哌 嗪-1,4-二乙磺 酸(PIPES,pH7.0)配制的4%多聚甲醛于4℃抽真空固定2 h,经0.1 mol/L PIPES(pH7.0)缓冲液洗涤3 次后,在4℃条件下依次用30%、50%乙醇脱水,-20℃条件下依次用50%、70%、90%、100%、100%、100%乙醇脱水,-20℃条件下依次用30%、70%的用乙醇配置的K4M 包埋剂各渗透3 h,100%纯K4M 包埋剂充分渗透6 h后将样品浸入K4M 包埋剂,置-20℃冰箱中紫外照射聚合72 h,常温紫外聚合48 h,得到聚合完毕的包埋块。将样品包埋块在Leica UC6 型切片机上切片,厚度70~90 nm,收集于镍网上进行免疫胶体金标记。
1.5 免疫胶体金标记
将带有切片的镍网用BL 封闭液(PBS 缓冲液配置,含1%的BSA、0.02%的PEG20000)于28℃封闭30 min,去离子水漂洗3 次;一抗孵育采用BL 封闭液1∶50 稀释的肌动蛋白抗体,28℃孵育3 h;去离子水漂洗3 次;二抗孵育采用BL 封闭液1∶100 稀释的羊抗鼠胶体金(直径10 nm),28℃孵育2 h;去离子水洗涤3 次,晾干。采用未免疫的血清作为一抗孵育的阴性对照。带有样品切片的镍网经醋酸双氧铀(C4H6O6U·2H2O)和柠檬酸铅(C6H5O7Pb)染液双染色各15 min 后,用H7650 型透射电镜(日立公司)观察,加速电压为80 kV,采用Gatan830 型CCD 相机(美国Gatan公司)照相。
2 结果
2.1 OsActin的克隆与鉴定
以cDNA 为模板,用特异引物Actin-F/Actin-R进行PCR 扩增,琼脂糖凝胶电泳显示扩增片段与预期1134 bp 大小一致(图1)。将所得片段回收纯化后,连接至pEASY-T5 Zero 载体,转化大肠杆菌Trans1-T1,挑取若干单克隆进行PCR 扩增鉴定,电泳检测发现1~3 号与预期大小一致为阳性克隆(图2),对阳性克隆提取质粒,测序获得水稻肌动蛋白基因序列,命名为OsActin。
2.2 OsActin的分子进化分析
为了进一步研究克隆得到的OsActin与水稻、拟南芥肌动蛋白基因家族的进化关系,在GenBank 数据库中下载了部分拟南芥与水稻肌动蛋白的氨基酸序列,利用BioEdit 与MEGA 软件对其进行比对分析并构建了系统进化树(图3)。氨基酸序列分析发现,OsActin 与OsRAc1(GenBank 登录号:X15865)、拟南芥ACT11(GenBank 登录号:U27981)的同源性分别高达98%与97%。从图3 可以看出,OsActin 和拟南芥与生殖生长相关的肌动蛋白ACT1、ACT3、ACT4、ACT11、ACT12 聚集成簇,推测该基因可能也参与调节水稻的生殖生长。
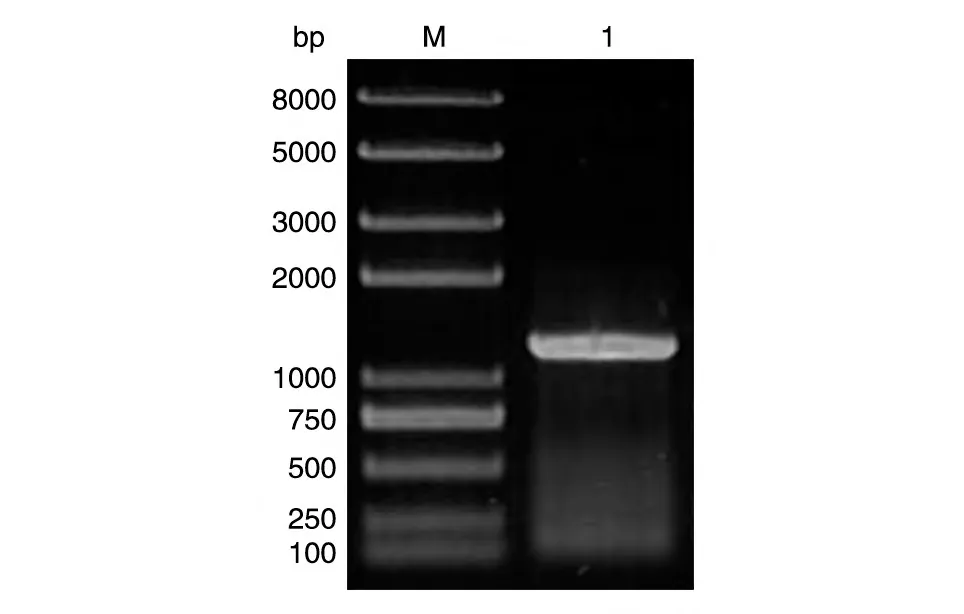
图1 OsActin目的基因的PCR扩增
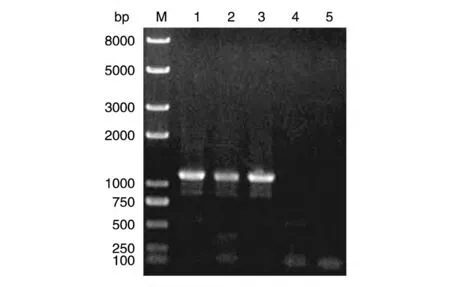
图2 pEASY-T5 Zero-OsActin克隆的PCR鉴定
2.3 水稻肌动蛋白基因的亚细胞定位分析
由于叶肉细胞等细胞的细胞质较多,也可能会干扰观察,因此我们选用液泡较多细胞质较少的维管束薄壁细胞作为研究对象。利用胶体金免疫电镜定位技术对水稻维管束薄壁细胞(parenchyma cells of vascular bundle)中的肌动蛋白进行定位研究,发现在细胞核与细胞质中均有大量特异性胶体金颗粒标记,而在液泡中及细胞壁上都没有观测到特异性胶体金颗粒标记(图4)。
3 讨论
高等植物细胞都含有一个复杂的细胞结构骨架,该结构是由具有高度动态性和严密调节作用的微丝组成的三维网络结构。细胞定位及一些生理生化研究表明肌动蛋白是植物细胞骨架的基本组成部分,在植物的生长、发育以及对逆境胁迫的响应中起重要作用[16-18]。例如由肌动蛋白与肌球蛋白相互作用组成的肌动球蛋白系统驱动着细胞质流动,还参与了细胞的有丝分裂、细胞器运动、顶端生长、对重力的感应、细胞形状的控制及叶绿体的流动等。因此,对于肌动蛋白的研究具有重要意义。
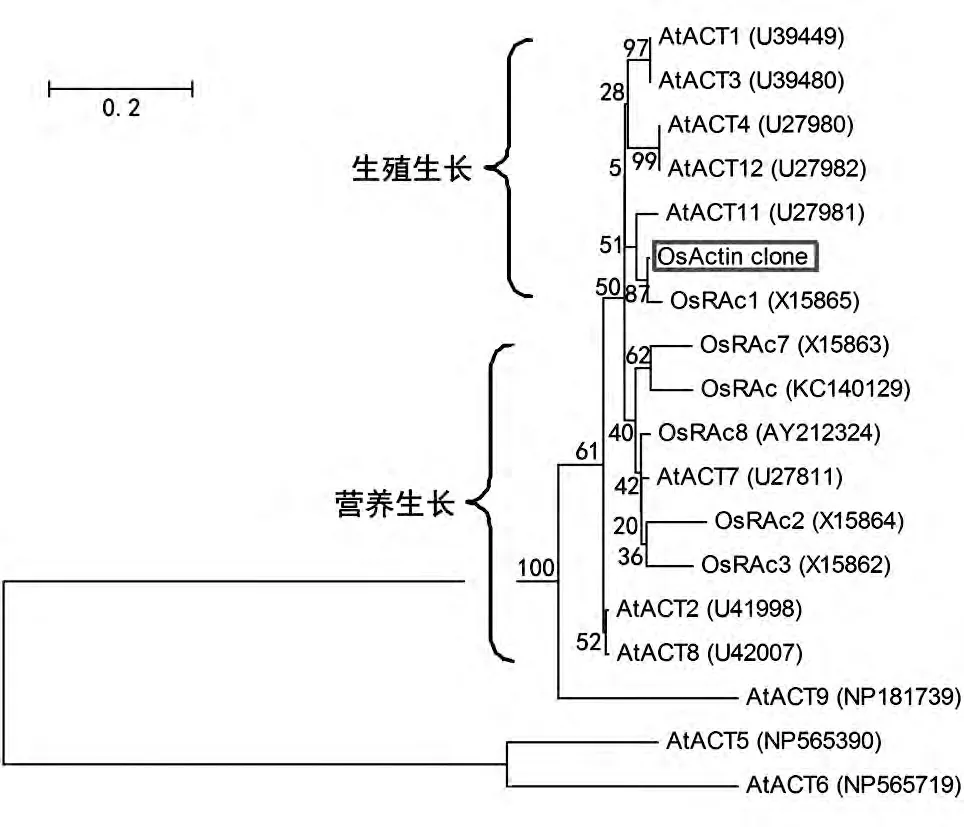
图3 基于水稻与拟南芥肌动蛋白氨基酸序列构建的系统进化树
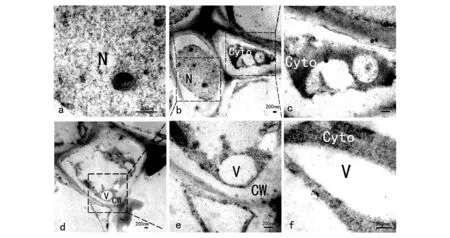
图4 肌动蛋白在水稻维管束薄壁细胞中的定位
在本研究中,我们克隆得到水稻的一个β-肌动蛋白基因,分子进化分析发现该基因编码的蛋白与水稻OsRAc1 及拟南芥ACT11 的氨基酸同源性分别为98%和97%。拟南芥ACT11 及与其同源的ACT1、ACT3、ACT4 和ACT12 在花粉中均有表达,因此将它们指定为生殖型肌动蛋白。不同的是,ACT11 在幼小组织、花器官原基、新生花蕾、胚珠及成熟的花粉中优先表达,并且是惟一在胚乳和胚发育过程中显著表达的肌动蛋白,它在生殖器官中独特的表达模式表明,ACT11 对于拟南芥的生殖发育是必不可少的[19]。OsActin 与拟南芥的ACT11 高度同源,暗示其对水稻的生殖发育也具有重要的作用。对OsActin的亚细胞定位研究发现,该蛋白在水稻薄壁细胞的细胞核、细胞质中均有分布,为进一步研究该基因在水稻生长发育过程中的作用及其超分子结构提供了依据。
[1]刘建新,葛亚英,田丹青,等.果子蔓凤梨Actin 基因的克隆与序列分析[J].分子植物育种,2011,9(001):41-45.
[2]Kost B,Mathur J,Chua N H.Cytoskeleton in plant development[J].Curr Opin Plant Biol,1999,2(6):462-470.
[3]Lassing I,Schmitzberger F,Björnstedt M,et al.Molecular and structural basis for redox regulation of β-actin[J].J Mol Biol,2007,370(2):331-348.
[4]Winder S J,Ayscough K R.Actin-binding proteins[J].J Cell Sci,2005,118(4):651-654.
[5]Pollard T D,Cooper J A.Actin,a central player in cell shape and movement[J].Science,2009,326(5957):1208-1212.
[6]Pantaloni D,Le Clainche C,Carlier M F.Mechanism of actin-based motility[J].Science,2001,292(5521):1502-1506.
[7]Ji Y,Ferracci G,Warley A,et al.Beta-actin regulates platelet nitric oxide synthase 3 activity through interaction with heat shock protein 90[J].Proc Natl Acad Sci USA,2007,104:8839-8844.
[8]Wang J,Fang S,Xiao H,et al.Interaction of the coronavirus infectious bronchitis virus membrane protein with beta-actin and its implication in virion assembly and budding[J].PLoSOne,2009,4:e4908.
[9]Hardham A R,Jones D A,Takemoto D.Cytoskeleton and cell wall function in penetration resistance[J].Curr Opin Plant Biol,2007,10(4):342-348.
[10]Schmelzer E.Cell polarization,a crucial process in fungal defence[J].Trends Plant Sci,2002,7(9):411-415.
[11]Skalamera D,Heath M C.Changes in the cytoskeleton accompanying infection-induced nuclear movements and the hypersensitive response in plant cells invaded by rust fungi[J].Plant J,1998,16(2):191-200.
[12]Kobayashi Y,Kobayashi I,Funaki Y,et al.Dynamic reorganization of microfilaments and micro-tubules is necessary for the expression of non-host resistance in barley coleoptile cells[J].Plant J,1997,11:525-537.
[13]Song X,Ma Q,Hao X,et al.Roles of the actin cytoskeleton and an actin-binding protein in wheat resistance against Puccinia striiformis f.sp.tritici[J].Protoplasma,2012,249(1):99-106.
[14]Šlajcherová K,Fišerová J,Fischer L,et al.Multiple actin isotypes in plants:diverse genes for diverse roles[J]? Front Plant Sci,2012,3:226.
[15]Rio D C,Ares M Jr,Hannon G J,et al.Purification of RNA using TRIzol(TRI reagent)[J].Cold Spring Harb Protoc,2010,2010(6):5439.
[16]Staiger C J,Lloyd C W.The plant cytoskeleton[J].Curr Opin Cell Biol,1991,3(1):33-42.
[17]Staiger C,Schliwa M.Actin localization and function in higher plants[J].Protoplasma,1987,141(1):1-12.
[18]Rb M,Re W.The plant cytoskeleton[M].Cold Spring Harbor Laboratory Press,1994:1049-1084.
[19]Huang S,An Y Q,Mcdowell J M,et al.The Arabidopsis ACT11 actin gene is strongly expressed in tissues of the emerging inflorescence,pollen,and developing ovules[J].Plant Mol Biol,1997,33(1):125-139.

