α-半乳糖苷酶清除猪细胞表面的α-Gal抗原
贠志敏,张雪,李素波,檀英霞,冷泠,季守平,高红伟,宫锋
军事医学科学院 野战输血研究所血液分子生物学研究室,北京 100850
人体移植器官严重短缺日益受到关注,而异种移植是解决人体移植器官短缺的有效方法之一,也是现代临床医学发展的重要热点问题。猪的器官在结构、大小和生理功能上与人体相近,并且猪易于繁殖,成熟周期短,一胎多子,所患疾病易于控制,在伦理学方面相对于灵长类动物更易接受,因此猪被认为是异种移植最理想的供体之一。
研究表明,α-Gal 抗原是异种移植的主要异种抗原之一,它表达于除人和旧大陆猴外的所有哺乳动物体内,只是在种类和个体间表达量上有差异[1]。人体内存在天然的抗α-Gal 抗体,将动物的细胞、组织和器官移植给人体,将出现超急性排斥反应(hyperacute rejection,HAR)。这些天然抗体在数分钟或数小时之后与移植物抗原结合,导致血管内皮被补体成分溶解/破坏,使血管完整性被破坏,进而导致水肿和出血进入下层组织。此外,凝血通路被激活,导致纤维蛋白单体沉淀,微血栓形成,最终致移植物肿胀、色泽暗红、流血量少、变软、无弹性、器官功能衰竭。因此,异种移植首先须清除异种抗原。国外的相关研究表明,使用α-半乳糖苷酶能有效清除异种细胞、组织表面抗原末端的α-Gal 残基,降低HAR强度,延长移植物的存活时间[2-4]。
本实验室从原核生物脆弱类杆菌(Bacteroides fragilis)中克隆并表达了一种新型α-半乳糖苷酶[5],属CAZy GH110 家族。研究表明,该酶不仅可切除支链多糖末端的α-Gal(Galα1-3Galβ1-4GlcNAcβ1-3Galβ1-4Glc-R),也可切除直链多糖末端的α-Gal(Galα1-3Galβ1-4GlcNAc-R)[5-6]。猪体细胞表面的α-Gal抗原是以α-Gal为末端的直链多糖结构[7]。我们检测率猪体细胞表面的α-Gal 抗原,并进行了新型α-半乳糖苷酶去除α-Gal抗原的初步研究。
1 材料与方法
1.1 材料
猪胚肾细胞系PK-15 和猪睾丸细胞系ST(培养条件均为高糖DMEM+5%胎牛血清)由野战输血研究所章金刚教授惠赠;猪成纤维细胞系11WP1(培养条件为高糖DMEM+15%胎牛血清)和五指山小型猪红细胞(pRBC)由中国农业科学院北京畜牧兽医研究所潘登科教授提供。FITC-IB4 凝集素为Sigma 公司产品;流式细胞仪为Cytomics FC 500 Beckman Coulter。
1.2 猪红细胞的酶解实验[6]
采集的五指山小型猪抗凝血于500 r/min 离心5 min,弃上层血浆,用酶解缓冲液(250 mmol/L 甘氨酸,3 mmol/L NaCl,pH6.8)分别按1∶1、1∶4 洗涤红细胞2 次;按红细胞压积为40%加入不同剂量的重组α-半乳糖苷酶,于26℃酶解反应箱内缓慢振荡孵育2 h,酶解清除红细胞α-Gal抗原;用PBS 按1∶4洗涤红细胞2 次,加入1/2 体积的MAP 液保存红细胞;取部分酶解前后的红细胞,分别用4%多聚甲醛固定备用。
1.3 猪体细胞的酶解实验
将培养的细胞用PBS 洗2 次,胰酶消化5 min,血清终止后500 r/min离心3 min,弃上清,将收集的细胞用酶解缓冲液(250 mmol/L 甘氨酸,3 mmol/L NaCl,pH6.8)洗涤2 次,分别加入不同剂量(表1)的重组α-半乳糖苷酶,酶解体系为300 μL,细胞数为1×106,于26℃酶解反应箱内缓慢振荡孵育2 h 后离心弃上清,用PBS 洗涤细胞2 次,用4%多聚甲醛固定备用。
1.4 FCAS 分析酶处理前后细胞表面α-Gal 抗原的含量
IB4是从植物中提取的一种凝集素,可特异地与以α-Gal 为末端的糖链结合,而异种抗原(Galα1-3Galβ1-4GlcNAc-R 和Galα1-3Galβ1-4GlcNAcβ1-3Galβ1-4Glc-R)是以α-Gal 为末端的糖链结构。用FITC-IB4 凝集素(25 μg/mL)标记固定的细胞,室温反应3 h,用PBS 洗涤2 次,用流式细胞仪检测红细胞的荧光强度,按下式计算α-Gal清除率:

2 结果
流式细胞术检测结果表明,pRBC、PK-15、ST、11WP1 细胞均表达α-Gal 抗原,但表达量明显不同,11WP1 的表达量最高,平均荧光强度为598,而pRBC 的最低,平均荧光强度只有33,因此各种细胞所需酶量不同(图1,表1)。用0.04 mg/mL 的α-半乳糖苷酶酶解2 h 后,pRBC 表面的α-Gal 抗原清除率可达99.84%;用0.5 mg/mL 的α-半乳糖苷酶酶解2 h 后,PK-15、ST、11WP1 细胞表面的α-Gal 抗原清除率可达90%以上,但仍没有被完全清除,可能是因为这几类细胞表面的α-Gal 抗原表达量较高,需要酶解更长的时间。
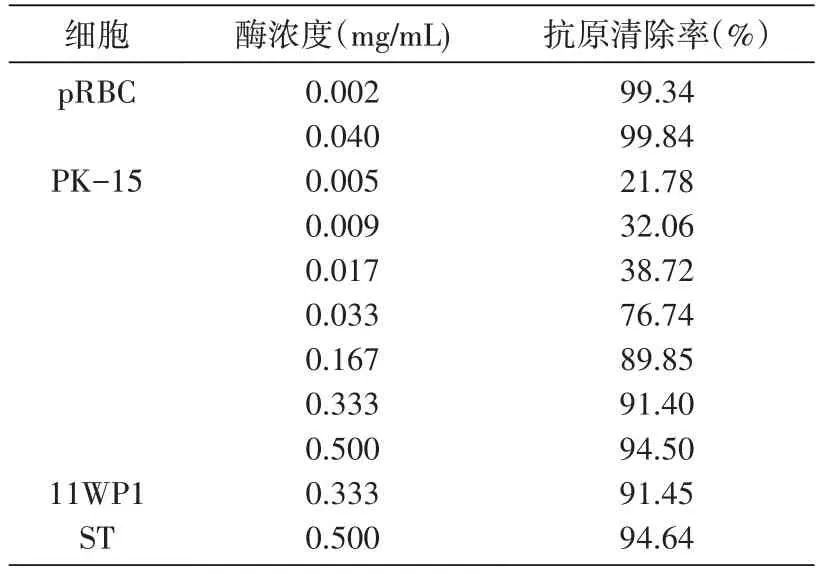
表1 α-半乳糖苷酶酶解细胞表面α-Gal抗原所需剂量
3 讨论
α-Gal 抗原是异种移植的主要异种抗原之一,表达于除人和旧大陆猴外的所有哺乳动物体内。本研究发现,脆弱杆菌来源的α-半乳糖苷酶酶解清除动物红细胞表面异种抗原α-Gal 的活性远高于咖啡豆来源的α-半乳糖苷酶。以酶解猪红细胞为例,咖啡豆α-半乳糖苷酶的使用剂量为2~3 mg/mL[8],而脆弱杆菌来源的α-半乳糖苷酶的使用剂量仅为0.002 mg/mL,并且酶解环境也从偏酸性变为中性。因此,该新型α-半乳糖苷酶是在异种移植中清除α-Gal 抗原,降低移植引起的HAR的理想工具酶。
虽然酶解法能够去除主要异种抗原,但移植后存活的异种组织或异种器官仍能继续分泌α-Gal 抗原,因此这种方法更适于终末期细胞或代谢率较低的组织或器官,如红细胞、皮肤、关节、韧带等,已有这些组织异种移植的相关报道和专利[9-11]。本研究证实,我们获得的来源于脆弱杆菌的α-半乳糖苷酶可用于清除不同类型猪体细胞表面的α-Gal 抗原,提示该酶可用于克服异种移植的HAR,是研制异种皮肤、关节、韧带的关键物质。
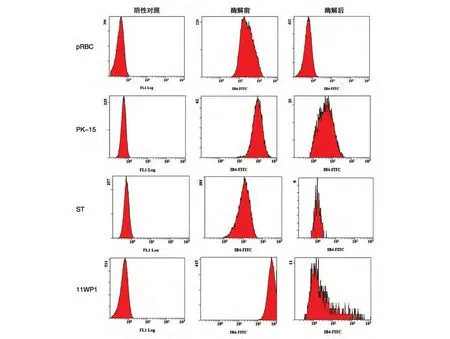
图1 流式细胞术检测α-半乳糖苷酶处理前后的细胞
[1]Galili U,Shohet S B,Kobrin E,et al.Man,apes,and old World monkeys differ from other mammals in the expression of α-galactosyl epitopes on nucleated cells[J].J Biol Chem,1988,263(33):17755-17762.
[2]Eckermann J M,Buhler L H,Zhu A,et al.Initial investigation of the potential of modified porcine erythrocytes for transfusion in primates[J].Xenotransplantation,2004,11(1):18-26.
[3]La Vecchio J A,Dunne A D,Edge A S.Enzymatic removal of alphα-galactosyl epitopes from poricine endothelial cells diminishes the cytotoxic effect of natural antibodies[J].Transplantation,1995,60(8):841-847.
[4]Luo Y,Wen J,Luo C,et al.Pig xenogeneic antigen modification with green coffee bean α-galactosidase[J].Xenotransplantation,1999,6(4):238-248.
[5]高红伟,李素波,鲍国强,等.一种来源于脆弱类杆菌的α-半乳糖苷酶的理化性质及其酶解B 型红细胞的工艺研究[J].中国科学:生命科学,2011,41(10):1030-1036.
[6]高红伟,张雪,李素波,等.新型α-半乳糖苷酶清除动物红细胞表面α-Gal抗原的研究[J].中国实验血液学杂志,2012,20(5):1231-1234.
[7]Liu Q P,Yuan H,Bennett E P,et al.Identification of a GH110 subfamily of α-1,3-galactosidases--novel enzymes for removal of the α3Gal xenotransplantation antigen[J].J Biol Chem,2008,283(13):8545-8554.
[8]Tan Yingxia,Gong Feng,Li Subo,et al.Brief report:a new profile of terminal N-acetyllactosamines glycans on pig red blood cells and different expression of α-galactose on Sika deer red blood cells and nucleated cells[J].Glycoconjugate J,2010,27(4):427-433.
[9]Doucet J,Gao Z H,McLaren L A,et al.Modification of xenoantigens on porcine erythrocytes for xenotransfusion[J].Surgery,2004,135:178-186.
[10]Stone K R,Valley M.Bone xenografts[P].US 6,972,041 B1.
[11]Liu Q P,Clausen H.Method of preparing non-human tissues for xenotransplantation using α-Galactosidases[P].US 7,951,552 B2.

