卡那霉素对萝卜种子发芽及幼苗生长的影响
张静,李海萍
(1.山西农业大学 园艺学院,山西 太谷 030801; 2.西北农林科技大学 园艺学院, 陕西 杨凌 712100)
卡那霉素对萝卜种子发芽及幼苗生长的影响
张静1,李海萍2
(1.山西农业大学 园艺学院,山西 太谷 030801; 2.西北农林科技大学 园艺学院, 陕西 杨凌 712100)
[目的]为了筛选萝卜种子卡那霉素最佳致死浓度。[方法]以2个萝卜自交系为试材,研究了不同浓度卡那霉素对萝卜种子发芽和幼苗生长发育的影响。[结果]卡那霉素对不同萝卜自交系种子的萌发影响不同,但对萝卜幼苗的生长发育都有明显的抑制作用,随着卡那霉素浓度的升高,致死率升高、主根和下胚轴长度变短。不同萝卜品种对卡那霉素的敏感性不同,各自的致死浓度也不一样。[结论]在经卡那霉素溶液浸泡后播种时,07Lb36-9和07Lb39的卡那霉素致死浓度分别为150 mg·L-1和300 mg·L-1,这2个浓度可以作为萝卜自交系07Lb36-9和07Lb39的转基因种子的筛选浓度。
萝卜; 卡那霉素; 敏感性
萝卜(RaphnussativusL.)属于十字花科萝卜属一年或两年生草本植物[1],是油菜的近缘物种[2]。萝卜在世界范围内均有种植,且有着十分悠久的历史,在人们日常生活中日益重要,逐渐成为科学研究的重要对象。随着测序技术的飞速发展,许多物种基因组测序工作已经完成。2014年日本学者公布了萝卜全基因组序列[3],为深入分析萝卜基因功能,进而改良萝卜种质资源提供了极大便利。
国内外对于萝卜的遗传转化研究起步较晚。Kim等[4]首次利用农杆菌介导的组织培养方法对萝卜进行遗传转化研究并且获得了成功。李海萍等[5]初步建立了基于组织培养的萝卜遗传转化体系。但是农杆菌介导的组织培养遗传转化过程比较复杂,影响其转化效率的因素较多。因此,不依赖于组织培养的转化方法一直是相关领域的研究重点以及热点。植株原位真空渗入法避开了组织培养的过程,具有很多优点,目前已在萝卜[2]、油菜[6, 7]、甘蓝型油菜[8]、拟南芥[9]、芥菜[10]、不结球白菜[11]和大白菜[12]上进行了尝试,并获得了成功。
植物原位真空渗入法转化的假阳性率也很高,收获的种子不可能全部进行分子检测,所以对种子抗性筛选尤为重要。利用标记基因对大量转基因后代进行鉴定和筛选是一种经济简便的方法[13]。本研究以2个萝卜自交系为试材,研究不同浓度卡那霉素对其发芽和幼苗生长发育的影响,确定卡那霉素最佳致死浓度,以期为后续真空渗入法转化萝卜得到的种子进行抗生素筛选提供理论依据。
1 材料与方法
1.1 试验材料
供试材料为2份萝卜(RaphanussativusL.)材料,分别是自交系07Lb36-9和07Lb39,由西北农林科技大学园艺学院大白菜研究室提供。
1.2 试验方法
分别制备含0、50、100、150、200、250和300 mg·L-1共7个梯度的卡那霉素MS选择培养基(含蔗糖20 g·L-1、琼脂7.5 g·L-1)。挑选颗粒饱满的萝卜种子,在超净工作台上首先用70%乙醇消毒1 min,其次用0.8%次氯酸钠溶液消毒15 min,无菌水冲洗4~5次。然后将消毒的种子进行以下2种处理:(1)直接播种于含有相应浓度卡那霉素的MS选择培养基上,对照为种子消毒后直接播种于不含卡那霉素的MS选择培养基上,每个处理100粒,重复3次;(2)将消毒好的种子在含有相应浓度卡那霉素的水溶液中4 ℃浸泡36 h,然后播种于含相应浓度卡那霉素的MS选择培养基上,对照为种子消毒后在无菌水中4 ℃浸泡36 h,然后播种于不含卡那霉素的MS选择培养基上,每个处理100粒,重复3次。置于室温25 ℃、光照时间为16 h·d-1、光照强度为2000 lux条件下培养。
1.3 项目测定

1.4 数据分析
数据测定结果用SAS软件和Excel软件进行分析。
2 结果与分析
2.1 卡那霉素对萝卜种子发芽率的影响
由表1可见,直接播种时,低浓度的卡那霉素对07Lb36-9萝卜种子的萌发有明显促进作用,卡那霉素浓度在50 mg·L-1时,07Lb36-9的发芽率达到了87.26%,其它浓度范围内对07Lb36-9萝卜种子的萌发影响不显著,各处理的发芽率均在65%以上;卡那霉素在0~150 mg·L-1浓度范围内对07Lb39萝卜种子的萌发影响不显著,各处理的发芽率均在80%以上,卡那霉素在200~300 mg·L-1浓度范围内对07Lb39萝卜种子的萌发有显著的抑制作用,且随着卡那霉素浓度的升高,发芽率逐渐降低。
经卡那霉素溶液浸泡后播种时,卡那霉素在50~300 mg·L-1浓度范围内对07Lb36-9萝卜种子的萌发有促进作用,各处理的发芽率均在75%以上,且150~300 mg·L-1浓度范围的卡那霉素对07Lb36-9萝卜种子的萌发有显著促进作用,随着卡那霉素浓度的升高,发芽率逐渐升高;50~100 mg·L-1浓度范围的卡那霉素对07Lb39萝卜种子的萌发有显著促进作用,而300 mg·L-1的卡那霉素对07Lb39萝卜种子的萌发有显著的抑制作用,其发芽率仅为69.38%,卡那霉素在150~250 mg·L-1浓度范围内对07Lb39萝卜种子的萌发影响不显著。
2.2 卡那霉素对萝卜幼苗下胚轴和主根生长的影响
2种播种方式下,卡那霉素在50~300 mg·L-1浓度范围内对2种萝卜材料的主根生长有显著的抑制作用,且随着卡那霉素浓度的升高,主根长度逐渐降低(图1A)。
直接播种时,卡那霉素在50~300 mg·L-1浓度范围内对2个萝卜材料的下胚轴生长有抑制作用。卡那霉素浓度为150~300 mg·L-1时对07Lb36-9的下胚轴生长有显著抑制作用,而卡那霉素浓度在100~300 mg·L-1时对07Lb39的下胚轴生长有显著的抑制作用(图1B)。
经卡那霉素溶液浸泡后播种时,卡那霉素在50~300 mg·L-1浓度范围内对2个萝卜材料的下胚轴生长有抑制作用。卡那霉素浓度为100~300 mg·L-1浓度时对07Lb36-9的下胚轴生长有显著抑制作用,卡那霉素浓度在50~300 mg·L-1时对07Lb39的下胚轴生长有显著的抑制作用(图1B)。

表1 卡那霉素对萝卜种子发芽率的影响
注:同列不同小写字母表示差异显著(P<0.05)
Note:Different lowercase letters in a column mean significant difference (P<0.05)

图1 卡那霉素对萝卜子叶苗主根 (A)和下胚轴(B)生长的影响Fig.1 The effect of kanamycin on the growth of root (A) and hypocotyls (B) of radish seedling 注:Z:直接播种于培养基;P:经卡那霉素溶液浸泡后播种于培养基。下同Note:Z: Seeds were sown in the medium directly without soaking in the kanamycin solution; P: Seeds were sown in the medium after soaking in the kanamycin solution. The same below
2.3 卡那霉素对萝卜幼苗子叶颜色的影响
不同萝卜品种的卡那霉素致死浓度不同。直接播种时,当卡那霉素浓度达到300 mg·L-1时对2个萝卜品种的致死率虽然达到了90%以上,但是未达到100%(表1,图2)。浸泡后播种时,07Lb36-9在卡那霉素筛选浓度为150 mg·L-1以上时幼苗子叶全部黄化,卡那霉素浓度在50 mg·L-1时的萝卜幼苗生长状况基本正常,部分子叶出现黄化(图2);因此,可以确定07Lb36-9在浸泡后播种的最低卡那霉素致死浓度为150 mg·L-1。而07Lb39对卡那霉素有较强的耐受性,卡那霉素浓度为300 mg·L-1时幼苗子叶全部变黄(图2)。
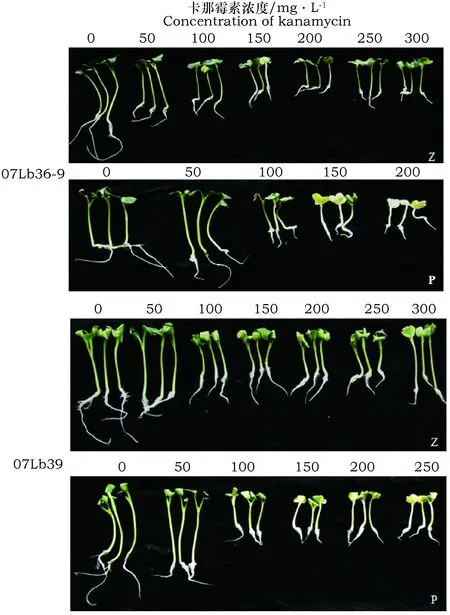
图2 不同萝卜材料对卡那霉素的敏感性分析Fig.2 Analysis of the resistance to kanamycin of different radish inbred-line
3 讨论与结论
近年来,科研工作者对萝卜的遗传转化进行了研究,方法有组织培养法[4,5]和蘸花法[2,14],说明应用真空渗入法进行萝卜遗传转化是可以实现的。
卡那霉素对不同萝卜自交系种子的萌发影响
不同。直接播种时,卡那霉素在50~150 mg·L-1浓度范围内对07Lb36-9和07Lb39萝卜种子的萌发影响不显著,低浓度的卡那霉素对07Lb36-9萝卜种子的萌发有促进作用,卡那霉素在200~300 mg·L-1浓度范围内对07Lb39萝卜种子的萌发有显著的抑制作用;浸泡后接种时,150~300 mg·L-1浓度范围的卡那霉素对07Lb36-9萝卜种子的萌发有显著促进作用,各处理的发芽率均在80%以上,50~100 mg·L-1浓度范围的卡那霉素对07Lb39萝卜种子的萌发促进作用显著,而300 mg·L-1的卡那霉素对07Lb39萝卜种子的萌发有显著的抑制作用。这与油菜上[7]的研究结果有所差异。另外,2个萝卜自交系均表现出随着卡那霉素浓度的提高,致死率升高、主根和下胚轴长度变短的趋势。这与油菜[7]、大白菜、小白菜和菜心的研究结果[13]一致。
本试验研究了不同浓度卡那霉素对萝卜种子发芽和幼苗生长发育的影响,初步确立了2个萝卜自交系的卡那霉素致死浓度。不同萝卜品种对卡那霉素的敏感性不同,各自的致死浓度也不一样。在经卡那霉素溶液浸泡后播种的情况下,07Lb36-9和07Lb39的卡那霉素致死浓度分别为150和300 mg·L-1,这个浓度可以作为萝卜转基因种子的筛选浓度。
[1]孔秋生. 萝卜种质资源遗传多样性和亲缘关系研究 [D]. 武汉:华中农业大学, 2003.
[2]喻晓敏, 吴雷, 王魁, 等. 根癌农杆菌介导的萝卜遗传转化方法研究[J]. 北方园艺, 2016(6): 99-102.
[3]Kitashiba H, Li F, Hirakawa H,etal. Draft sequences of the radish (RaphanussativusL.) genome [J].DNAResearch, 2014, 21(5): 481-490.
[4]Kim N R,An G, Park M C. High -Frequency regeneration and transformation ofRaphanussativus[J].JournalofPlantBiology, 2001, 44(4): 231-235.
[5]李海萍, 张鲁刚, 胥宇建, 等. 萝卜遗传转化体系的建立[J]. 中国瓜菜, 2011, 24(4): 18-21.
[6]张广辉, 巩振辉, 薛万新, 等. 大白菜和油菜真空渗入遗传转化法初报[J].西北农业大学学报, 1998,26(4):1-4.
[7]王道杰, 杨翠玲, 陆鸣. 真空渗透法转化油菜及转化种子的筛选[J]. 植物学报, 2009, 44 (2): 216-222.
[8]Wang W C, Menon G, Hansen G. Development of a novel Agrobacterium-mediated transformation method to recover transgenicBrassicanapusplants [J].PlantCellReports, 2003,22(4):274-281.
[9]巩振辉, 何玉科. 拟南芥基因转移新方法一真空渗入法的研究[J].西北植物学报, 1996,16(3):277-283.
[10]Chhikara S, Chaudhary D, Yadav M,etal. A non-tissue culture approach for developing transgenicBrassicajunceaL. plants with Agrobacterium tumefaciens [J].InVitroCellularandDevelopmentalBiology-Plant, 2012,48(1):7-14.
[11]Qing C M, Fan L, Lei Y,etal. Transformation of Pakchoi (BrassicarapaL.sspchinensis) by Agrobacterium infiltration [J].MolecularBreeding, 2000,6(1):67-72.
[12]赵静. 大白菜遗传转化体系的优化[D].杨凌:西北农林科技大学,2016.
[13]王峰, 卢永恩, 李汉霞. 几种白菜类蔬菜卡那霉素抗性的研究[J].武汉植物学研究, 2006,24(4):377-380.
[14]Curtis I S, Nam H G. Transgenic radish (RaphanussativusL. longipinnatus Bailey) by floral-dip method—plant development and surfactant are important in optimizing transformation efficiency [J]. Transgenic Research, 2001,10(4):363-371.
(编辑:马荣博)
Effect of Kanamycin on the seed germination and seedling growth of radish (RaphnussativusL.)
Zhang Jing1, Li Haiping2
(1.CollegeofHorticulture,ShanxiAgriculturalUniversity,Taigu030801,China; 2.CollegeofHorticulture,NorthwestAgricultureandForestryUniversity,Yangling712100,China)
[Objective]The best lethal concentration of kanamycin in radish seeds was screened.[Methods]The two radish inbred lines including 07Lb36-9 and07Lb39 were used as materials, the effect of different concentration of kanamycin on the seed germination and seedling growth of radish were studied.[Result]The result showed that the effect of kanamycin on the seed germination of different radish inbred lines were different. But the seedling growth was inhibited. The lethal rate became higher and the lengths of root and hypocotyl became shorter with the increase of the concentration of kanamycin. There was different kanamycin sensitivity of the two radish inbred lines. Therefore, the lethal concentration of kanamycin differed between the two radish inbred lines.[Conclusion]When the seeds were sowed on MS select medium after soaking by kanamycin solution, the lethal concentrations of 07Lb36-9 and 07Lb39 were 150 and 300 mg·L-1, respectively. These concentrations can be used as the screening concentration of the radish transgenic seeds.
Radish, Kanamycin, Sensitivity
2016-12-30
2017-06-13
张静(1982-),女(汉),宁夏中卫人,讲师,博士,研究方向:蔬菜育种与生物技术
山西农业大学科技创新基金(2014019)
S631
A
1671-8151(2017)09-0640-04

