ABC细胞膜转运蛋白及其介导的细胞多药耐药研究进展
张久聪,王彪猛,常宗宏,张方信
兰州军区兰州总医院 消化科,甘肃 兰州 730050
ABC细胞膜转运蛋白是一个能转运多种底物的蛋白质家族,目前认为其中的许多成员在宿主对异物的防御机制和肿瘤细胞对抗癌药物的耐药性中起重要作用。由于ABC 细胞膜转运蛋白能将已进人细胞的外源性物质从胞内泵出胞外,所以是肿瘤细胞多药耐药的主要原因,其基因表达水平与细胞内药物浓度和耐药程度密切相关。近年来,肿瘤细胞多药耐药性的研究炙手可热,国内外学者对ABC 细胞膜转运蛋白基因在不同恶性肿瘤中的表达及其在恶性肿瘤原发性多药耐药中发挥的作用进行了大量实验研究。在此,我们就ABC 细胞膜转运蛋白及其介导的细胞多药耐药方面的研究进展做简要综述。
1 药物转运体概述
药物在体内的转运过程,包括药物吸收、分布、代谢及排泄过程,都涉及药物对生物膜(包括细胞膜和细胞的内膜系统)的通透[1]。细胞膜上主要有3 种功能蛋白,即离子通道、膜受体和转运体。转运体是细胞内外物质交换的分子基础,包括离子转运体、神经递质转运体、营养物质(如葡萄糖和氨基酸)转运体和外来物质转运体。人体组织生物膜存在的由特殊转运蛋白介导的药物跨膜转运,称之为药物转运体。药物转运体在本质上属于外来物质转运体,是机体内物质转运系统的重要组成部分。药物转运体在药物在体内的代谢过程中发挥重要作用,是影响药物效应以及产生药物相互作用的重要因素[2]。
药物转运体按照其转运方向的不同可分为2类。一类将底物等转运进入细胞,从而增加细胞内的底物浓度,称为摄取性转运体(uptake transporters),如有机阴离子转运体(organic anion transporter,OAT)、有机阳离子转运体(organic cation transporter,OCT)、多肽转运体(peptide transporter,PEPT)和核苷转运体(nucleoside transporter,NT)等,分别转运弱酸性、弱碱性、多肽类及核苷类药物进入细胞[3]。摄取性转运体将底物摄取至靶位以发挥药效,亦称为可溶性载体(solute carrier,SLC)[4]。另一类药物转运体为外排性转运体(efflux transporters),该转运体的主要功能是依赖ATP 分解释放的能量,将药物从细胞内排出,限制药物的摄取和吸收,从而达到降低药物在细胞内浓度的目的[5-6]。外排性转运体有P 糖蛋白(P glycoprotein,P-gp)、乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)、多药耐药相关蛋白(multidrug resistance-related protein,MRP)、肺耐药蛋白(lung resistance-related protein,LRP)及胆酸盐外排转运蛋白(bile salt export pump,BSEP)等[7-8]。外排性转运体能将已进入细胞的治疗性药物从细胞内排出,所以是细胞多药耐药(multidrug resistance,MDR)的主要元凶,其蛋白表达水平与细胞内的药物浓度紧密相关[9]。
2 ABC细胞膜转运蛋白家族成员
2.1 ABCB1
ABCB1 是相对分子质量为170×103、由1280 个氨基酸残基组成的ATP 依赖性膜蛋白,可分成4 个结构域,即2 个跨膜结构域(transmembrane domain,TMD)、2 个核苷结合结构域(nucleotide binding domain,NBD),糖基化与磷酸化均与该蛋白药物排出转运无关[10]。最初在秋水仙碱抵抗性仓鼠卵巢细胞上被发现可改变细胞膜对异生素(xenobiotics)的通透性,后来相继在肠道、血液细胞中发现存在该蛋白的表达,是机体抵抗有毒化合物、保护机体重要器官如脑等的重要蛋白[11]。来自不同种属的ABCB1有达70%的同源性,由一紧密相关基因家族编码,在人类为MDR基因家族,在啮齿类为mdr基因,人类有2个异构体,啮齿类为3 个。ABCB1 转运底物大多数为弱的两性嗜性,相对疏水性,许多底物包含芳香环和带电荷的季氨氮[12-13]。
ABCB1 是多药耐药基因MDR1的表达产物,为ATP 依赖型的外排性转运体,可以将外源性药物外排至细胞外,从而影响药物的治疗效果。当治疗药物进入靶细胞,ABCB1 与化学结构和作用机制不同的药物结合,形成一个磷酸化和糖基化的ATP 结合盒蛋白的药物大分子。ATP 水解后释放的能量可以将已进入细胞的药物从胞内排出胞外,以保护宿主细胞免受药物攻击和减少凋亡数量,是细胞产生原发性耐药的主要原因。ABCB1 的表达水平与细胞内药物浓度及细胞的耐药程度紧密相关[14]。
2.1.1 ABCB1 的分布与表达 ABCB1 主要分布在有分泌和排泄功能的上皮细胞膜上,人类正常组织中均有不同程度ABCB1 的表达,其中肺、胃、肠、胰腺、肾上腺等组织中的表达量相对较高,而在卵巢、胸腺、骨髓中低表达甚至不表达。ABCB1 是血脑屏障、血睾屏障和胎盘屏障的重要组成部分,对正常细胞和组织防护外来物质的干扰发挥重要作用[15-16]。
ABCB1 在肿瘤中广泛表达,可作为肿瘤患者预后的评价指标之一。如正常卵巢组织中无ABCB1表达,良性卵巢癌中ABCB1表达率为33.3%,而在恶性卵巢癌中达到100%。宫颈癌组织ABCB1 的表达也显著高于正常宫颈组织。ABCB1 高表达的卵巢癌或宫颈癌组织细胞可对蒽环类、长春碱类、紫杉醇类、鬼臼毒素类化疗药物和阿霉素等产生交叉性多药耐药。ABCB1 在其他组织器官如肺、肝脏、肾上腺和直肠所发生的肿瘤中均为高表达,并且对化疗药物不敏感或疗效差。研究表明,ABCB1 高表达与肿瘤化疗耐药、复发和预后紧密相关[17]。
2.1.2 ABCB1 在肿瘤中的耐药机制 肿瘤患者体内ABCB1高表达与肿瘤细胞的多药耐药相关[18]。外源性药物如蒽环类、长春碱类、鬼臼毒素类、紫杉醇及放线菌素D 等天然抗肿瘤药较易被ABCB1 排出胞外,降低细胞内药物浓度,从而出现多药耐药。研究发现,肿瘤细胞内药物浓度、细胞耐药程度均与细胞膜表面ABCB1 的表达紧密相关。阻断ABCB1 后可显著抑制药物的外排,增加药物的胞内浓度,逆转细胞耐药,提高肿瘤细胞对化疗药物的敏感性[19-20]。
促使ABCB1 产生多药耐药的化疗药物主要包括:①烷化剂类,如环磷酰胺;②抗生素类抗肿瘤药,如柔红霉素;③植物碱类抗肿瘤药,如长春新碱、紫杉醇等;④蒽环类化疗药,如阿霉素;⑤激素类,如孕激素、三苯氧胺等(表1)。研究表明,外周血细胞中也存在ABCB1 的表达,特别是淋巴细胞,在应用了抗病毒药物、免疫抑制剂和治疗白血病药物的患者中,ABCB1 的高表达造成了胞内药物浓度的降低和治疗效果的下降[16]。
2.1.3 ABCB1 多药耐药的逆转 肿瘤细胞的多药耐药性与ABCB1 表达密切相关,如果抑制基因MDR1的表达,就可能逆转肿瘤的多药耐药,从而提高肿瘤细胞对化疗的敏感性。
ABCB1 高表达的恶性肿瘤患者,治疗可选择不诱导ABCB1 的化疗药物或使用ABCB1 逆转剂。目前ABCB1 逆转剂主要有维拉帕米、环孢菌、奎尼丁、粉防己碱、蝙蝠葛碱、人参皂甙等。如汉防己甲素可以提高耐药白血病细胞内的柔红霉素浓度,增强柔红霉素对耐药细胞的药理作用;川芎嗪可以增强环孢素对细胞耐药的逆转作用;榄香烯不但对耐药细胞有较强的杀伤作用,而且不诱导细胞内MDR1mRNA 的表达,说明榄香烯不易产生耐药性;大黄素能增强肿瘤药物的细胞毒作用,逆转多药耐药,降低ABCB1 的表达;人参皂甙可以逆转白血病细胞的多药耐药,并且该效应呈剂量依赖性。
目前,大多数逆转剂通过抑制ABCB1 外排功能,提高肿瘤细胞内化疗药物的浓度而对抗多药耐药。针对ABCB1 的多药耐药的逆转方式主要有:①研制不具多药耐药的新型抗肿瘤药物;②发现新的多药耐药逆转剂,并与抗肿瘤药物合用,恢复多药耐药细胞对抗肿瘤药物的敏感性;③通过脂质载体运送抗肿瘤药物,改变药物进入细胞的途径;④运用单克隆抗体、反义寡核苷酸、核酶和小干扰RNA 等技术,在DNA 或RNA 水平抑制MDR1基因的表达;⑤运用一些细胞因子逆转剂等。
2.2 ABCG2
1998 年Doyle 等首先在乳腺癌细胞株MCF-7/AdrVp 中检测到一个跨膜转运蛋白,称为乳腺癌耐药蛋白[21]。系统发育分析发现此蛋白是ABC 超家族亚族G 的第2 个成员,命名为ABCG2。作为一个新的ABC 超家族膜转运蛋白成员,ABCG2 日益成为临床肿瘤化学治疗的靶点之一[22]。
2.2.1 ABCG2 的分布与结构 ABCG2 广泛分布于正常组织中,主要存在于具有分泌和排泄功能的组织,如胎盘合体滋养层、小肠和结肠上皮、肝脏小管膜、胆小管膜、乳腺小叶及血管内皮细胞中[23]。人类ABCG2基因位于染色体4q22-23,编码655个氨基酸残基。鼠类BCRP基因又称为Bcrpl,位于染色体6、28-29,编码657 个氨基酸残基,与人类ABCG2 有81%的同源性[24]。ABCG2全长66 kb,由16个外显子和15 个内含子组成,外显子为60~332 bp 不等。ABCG2的mRNA 为2.4 kb,相对分子质量约为72.6×103[22]。与ABCB1和ABCC 一样,ABCG2 存在ABC 结构,具有ATP依赖性药物外排功能。
2.2.2 ABCG2 与肿瘤耐药性 研究发现,ABCG2 在人体多种肿瘤细胞内都高表达[25]。ABCG2能转运多种化疗药物,将药物从细胞内转运至细胞外。故ABCG2 表达特征与恶性肿瘤化疗效果有密切关系,高表达者化疗效果不佳,而低表达则疗效较好[26]。研究发现,ABCG2 主要通过结合和水解ATP 并利用能量将细胞内的药物泵出,降低胞内药物浓度和减轻细胞毒作用,从而可使机体对肿瘤药物产生耐药。
2.3 ABCC1(MRP1)
1992 年Cole 等发现阿霉素选育的人小细胞肺癌H69AR 耐药细胞系可对多种化疗药物产生耐药,却无ABCB1 的高表达,而是多药耐药相关蛋白表达升高[27]。MRP 是第一个被发现的ABCC 亚族转运蛋白,现称为MRP1 或ABCC1,其编码基因位于人染色体16p13.1。MRP 由1531 个氨基酸残基组成,相对分子质量为190×103。目前己在人类中发现9 种ABCC 转运蛋白(表2)。ABCC 家族的分子结构有2类:第一类与ABCB1 结构相似,如MRP4、MRP5、MRP8、MRP9;另一类除具有与ABCB1 相似的结构外,N 端还有一个由5 个疏水性跨膜α螺旋组成的跨膜区,如MRP1、MRP2、MRP3、MRP6、MRP7。
ABCC1是目前研究较多的转运体[28]。正常细胞中ABCC1 主要分布在胞内膜系统上,如内质网、高尔基体,通过运输囊泡膜行使正常的生理功能,包括排出进入细胞或胞内产生的有害物质,转运内源性激素等。在肿瘤细胞中,ABCC1 主要分布在细胞膜上,少数分布在细胞质内,且靠近细胞核。ABCC1在细胞中的空间特殊分布,决定了ABCC1 在肿瘤与正常细胞间的功能差异。

表1 ABCB1底物、诱导剂和抑制剂
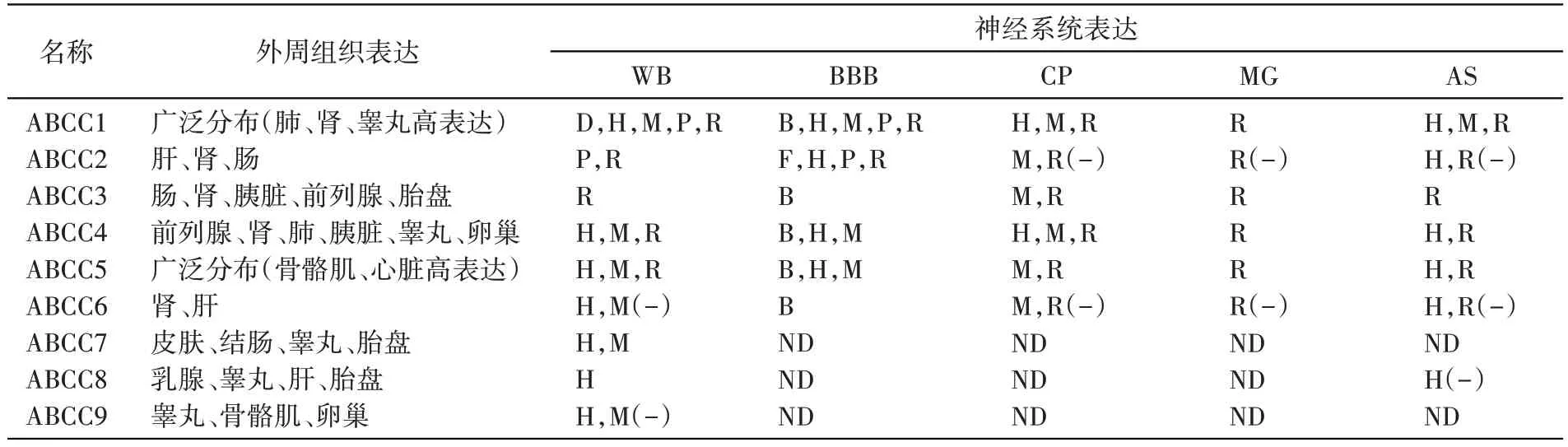
表2 ABCC转运蛋白家族的分布[29]
ABCC1转运谱类似于ABCB1,但ABCC1转运蛋白优先结合的底物为有机阴离子,如药物和谷胱甘肽(GSH)、葡萄糖醛酸或硫酸基团结合。目前认为ABCC1和GSH 共同介导细胞耐药的发生,药物通过谷胱苷肽S 转移酶和GSH 结合,然后由ABCC1 转运出细胞。这个假设的提出主要基于以下几点:①细胞内GSH 的耗竭将会终止ABCC1 介导的对长春碱和蒽环类的药物耐药;②在囊泡转运实验中,长春碱和柔红霉素的外排转运只发生在囊泡内GSH 减少的情况下;③长春新碱外排的增加是和GSH 量相关的。因此,由ABCC1介导的药物耐药需要GSH 的持续供应,以使未结合的药物排出。
2.4 ABCB1、ABCC1及ABCG2三者的关系
ABCB1、ABCC1及ABCG2均属于ABC药物转运蛋白家族,它们不但在结构上有一定的同源性,而且功能上也极其相似,即作为药物排出转运体,依赖ATP 提供能量将外源性治疗药物排出,导致细胞内药物浓度降低,从而产生耐药。
ABCB1、ABCC1 及ABCG2 三者也存在不同点:①三者介导耐药机制不完全相同;②能有效逆转三者介导的耐药药物不同;③三者的耐药谱不同。
对ABCB1、ABCC1及ABCG2三者作用机制过程的深入研究,必将有利于化疗疗效的提高。细胞发生多药耐药存在多种机制。通过检测多个ABC 药物转运蛋白基因,并依据耐药机制和基因表达结果,选择适合的药物或使用耐药逆转剂,能够避免药物治疗无效而引起的严重不良反应,从而达到增强药物疗效,改善预后的目的。目前对ABC 药物转运蛋白体内的全面生理功能和作用机理、环节尚不完全清楚,特异性逆转多药耐药的药物也未发现,膜转运蛋白之间的关系尚有待进一步研究。
[1]栾家杰,宋建国.药物转运体与药物体内过程[J].安徽医药,2005,9(10):721-723.
[2]Kusuhara H,Sugiyama Y.Role of transporters in the tissueselective distribution and elimination of drugs:transporters in the liver,small intestine,brain and kidney[J].J Control Release,2002,78(1-3):43-54.
[3]Fletcher J I,Haber M,Henderson M J,et al.ABC transporters in cancer:more than just drug efflux pumps[J].Nat Rev Cancer,2010,10(2):147-156.
[4]Varatharajan L,Thomas S A.The transport of anti-HIV drugs across blood-CNS interfaces:summary of current knowledge and recommendations for further research[J].Antiviral Res,2009,82(2):A99-109.
[5]Higgins C F.ABC transporters:physiology,structure and mechanisman overview[J].Res Microbiol,2001,152(3-4):205-210.
[6]Schmitt L,Tampe R.Structure and mechanism of ABC transporters[J].Curr Opin Struct Biol,2002,12(6):754-760.
[7]Lee C A,Cook J A,Reyner E L,et al.P-glycoprotein related drug interactions:clinical importance and a consideration of disease states[J].Expert Opin Drug Metab Toxicol,2010,6(5):603-619.
[8]Fromm M F.Importance of P-glycoprotein at blood-tissue barriers[J].Trends Pharmacol Sci,2004,25(8):423-429.
[9]Hollenstein K,Dawson R J,Locher K P.Structure and mechanism of ABC transporter proteins[J].Curr Opin Struct Biol,2007,17(4):412-418.
[10]Locher K P.Review.Structure and mechanism of ATP-binding cassette transporters[J].Philos Trans R Soc Lond B Biol Sci,2009,364(1514):239-245.
[11]Locher K P.Structure and mechanism of ABC transporters[J].Curr Opin Struct Biol,2004,14(4):426-431.
[12]Glaeser,H.Importance of P-glycoprotein for drug-drug interactions[J].Handb Exp Pharmacol,2011,(201):285-297.
[13]Sarkadi B,Ozvegy-Laczka C,Nemet K,et al.ABCG2 -a transporter for all seasons[J].FEBS Lett,2004,567(1):116-120.
[14]Rees D C,Johnson E,Lewinson O.ABC transporters:the power to change[J].Nat Rev Mol Cell Biol,2009,10(3):218-227.
[15]Ishikawa T.Emerging trends in human ABC transporters[J].Pharm Res,2009,26(2):445-448.
[16]Giraud C,Manceau S,Treluyer J M.ABC transporters in human lymphocytes:expression,activity and role,modulating factors and consequences for antiretroviral therapies[J].Expert Opin Drug Metab Toxicol,2010,6(5):571-589.
[17]Fletcher J I,Haber M,Henderson M J,et al.ABC transporters in cancer:more than just drug efflux pumps[J].Nat Rev Cancer,2010,10(2):147-156.
[18]Lockhart A C,Tirona R C,Kim R B.Pharmacogenetics of ATP-binding cassette transporters in cancer and chemotherapy[J].Mol Cancer Ther,2003,2(7):685-698.
[19]Cascorbi I.Role of pharmacogenetics of ATP-binding cassette transporters in the pharmacokinetics of drugs[J].Pharmacol Ther,2006,112(2):457-473.
[20]Cascorbi I,Haenisch S.Pharmacogenetics of ATP-binding cassette transporters and clinical implications[J].Methods Mol Biol,2010,596:95-121.
[21]Doyle L A,Yang W,Abruzzo L V,et al.A multidrug resistance transporter from human MCF-7 breast cancer cells[J].Proc Natl Acad Sci USA,1998,95(26):15665-15670.
[22]Meyer zu Schwabedissen H E,Kroemer H K.In vitro and in vivo evidence for the importance of breast cancer resistance protein transporters(BCRP/MXR/ABCP/ABCG2)[J].Handb Exp Pharmacol,2011,(201):325-371.
[23]Krishnamurthy P,Schuetz J D.Role of ABCG2/BCRP in biolo-gy and medicine[J].Annu Rev Pharmacol Toxicol,2006,46:381-410.
[24]Ni Z,Bikadi Z,Rosenberg M F,et al.Structure and function of the human breast cancer resistance protein(BCRP/ABCG2)[J].Curr Drug Metab,2010,11(7):603-617.
[25]Sauerbrey A,Sell W,Steinbach D,et al.Expression of the BCRP gene(ABCG2/MXR/ABCP) in childhood acute lymphoblastic leukaemia[J].Br J Haematol,2002,118(1):147-150.
[26]Coley H M.Mechanisms and strategies to overcome chemotherapy resistance in metastatic breast cancer[J].Cancer Treat Rev,2008,34(4):378-390.
[27]Cole S P,Bhardwaj G,Gerlach J H,et al.Overexpression of a transporter gene in a multidrug-resistant human lung cancer cell line[J].Science,1992,258(5088):1650-1654.
[28]Haimeur A,Conseil G,Deeley R G,et al.The MRP-related and BCRP/ABCG2 multidrug resistance proteins:biology,substrate specificity and regulation[J].Curr Drug Metab,2004,5(1):21-53.
[29]Dallas S,Miller D S,Bendayan R.Multidrug resistance-associated proteins:expression and function in the central nervous system[J].Pharmacol Rev,2006,58(2):140-161.

