微囊藻毒素-LR超灵敏均相免疫分析方法的建立与优化
张 艺,黄 飚,钮伟民,赵灿培,金 坚
(1.江南大学药学院药物设计与分子药理室,江苏无锡 214122;2.江苏省原子医学研究所卫生部核医学重点实验室,江苏省分子核医学重点实验室,江苏无锡 241063;3.无锡市疾病预防控制中心检验部,江苏无锡 214023)
微囊藻毒素(microcystin,MC)是在蓝藻水华污染中出现的最广泛、毒性最大的一类毒素,由7个氨基酸组成,并且有多种异构体形式,其中含量高、毒性大、研究最深入、报道最多的异构体是MC-LR,它对人体有很强的肝毒性,影响机体免疫功能,明显抑制吞噬细胞、T细胞和B细胞功能和肿瘤坏死因子α的基因转录与表达,严重时可诱发肝癌[1-2]。然而,随着淡水水体的富营养化加剧,各地蓝藻水华时有爆发[3]。因此,1998年世界卫生组织制定了饮用水中 MC-LR 含量低于 1.0 μg·L-1的指导标准;我国也于2006年制定了相应的标准《生活饮用水卫生标准》[4-5]。为了更好地监测水体中藻毒素的含量,许多检测技术已经投入应用。目前,检测方法主要有物理化学法(如:高效液相色谱法、液质联用分析法)、生物化学方法(常见的有蛋白磷酸酶分析法)、分子生物学方法(PCR法)以及免疫分析法(放免、酶免、时间分辨荧光免疫分析法等)[7-13]。免疫检测技术,基于抗原抗体之间的特异性反应,相对简便、快速,适用于定量检测,因仪器价格合理,操作方便,近年来广受关注,使用率也越来越高。鉴于此,建立一种快捷灵敏的免疫检测MC-LR的方法,先将毒素含量超标的水体采样筛选出来,再采用精确繁复的物理仪器确定,将利于对水环境实施快速监测,对人民健康具有积极作用。本研究基于光激化学发光均相免疫检测方法(AlphaLISA),利用抗体-抗原间的特异性反应,实现高灵敏和快速检测样本中MC-LR的含量。
1 材料与方法
1.1 试剂和仪器
MC-LR、氰基硼氢化钠、2-(N-)吗啉-乙磺酸(2-[N-morpholino]ethanesulfonic acid,MES)和羧甲氧基半盐酸盐(carboxymethlamine hemihydrochloride,CMO),美国 Sigma-Aldrich公司;MC-LR-BSA、MC-RR、MC-LR和抗MC-LR多克隆抗体,无锡市疾病预防控制中心提供;生物素-羊抗兔IgG抗体,华美生物工程公司;AlphaLISA发光球和包被链霉亲和素的感光微球,美国PE公司;其他试剂均为国药分析纯。AlphaLISA免疫检测仪(Lica HT),由上海博阳生物科技公司生产。
1.2 MC-LR-BSA发光微球的制备
首先将1 mg发光微球、0.05 mg MC-LR-BSA和 12.5 μL 的 1% 吐温-20 溶液,以及 10 μL 的25 g·L-1的氰基硼氢化钠混合在离心管中,然后用0.01 mol·L-1的 MES 溶液(pH 6.0)补充至200 μL体积,令上述溶液充分混合后37℃反应过夜。次日,加入10 μL CMO 0.3 mol·L-1(pH 5.0)终止连接反应,37℃孵育1 h。之后,连有MC-LR-BSA的发光微球离心浓缩,再超声混匀以提纯,重复上述步骤2次。最后,将微球溶于含有0.1%Proclin-300的 PBS(pH 7.4),2 ~8℃保存。
1.3 标准品工作液的制备
将MC-LR原液溶于甲醇,再用PBS(pH 7.4)稀释至0.1,0.2,0.5,1.0 和 5.0 μg·L-1,0 浓度点即为对应的PBS溶液。
1.4 抗体稀释度的选择
将一抗分别稀释1∶100到1∶8000,测定对应的零浓度点结合率(Bound 0,B0),再通过稀释度曲线,选取斜率最大即ED50时的稀释度,获得本研究最佳一抗稀释比。
在一抗浓度选取的基础上,再调整二抗生物素-羊抗兔的稀释倍数,测定其从1∶100至1∶10 000时 B0和非特异性结合(non-specific bounding,NSB)的荧光值,以获得高结合率和较低的NSB。
1.5 反应缓冲液的选择
分别制备 pH 7.4 PBS 0.05 mol·L-1、Tris-HCl和 HEPES 缓冲液,均加入 0.2%BSA、0.1%吐温-20,2~8℃保存备用。在AlphaLISA反应时用上述溶液稀释试剂,按照反应步骤操作,分别测定标准品工作液。根据各浓度点荧光值,确定最佳反应缓冲液。
1.6 样品的制备
因 MC 在0 ~200 μg·L-1时溶于水[6],澄清水样可直接检测;若样本混浊,则取2 mL混匀水样置于离心管中,3188×g离心20 min,转移上清待测。
样本中MC-LR的提取:含藻水样的MC-LR存在于胞外和胞内,通过20 MHz超声波间歇振荡2 h,破碎藻细胞,释放胞内MC;再按照上述步骤离心取澄清部分,获得总MC-LR。
所有水样均由无锡市疾控中心提供,取自太湖沿岸水厂。
1.7 检测步骤
取包被有MC-LR的发光微粒、标准品或处理好的样品、一定浓度的抗MC-LR抗体和生物素化二抗共4种试剂各20 μL加至白色不透明微孔板,37℃孵育;加入包被有链霉亲和素的感光微粒,37℃孵育。在Lica HT检测仪上检测光信号,从标准曲线测算出样品中的MC-LR含量。
1.8 统计学分析
实验数据用Origin8.0软件进行处理,显著性分析采用t检验,P<0.05认为有统计学差异。
2 结果
2.1 抗体工作浓度的选择
结合仪器荧光计数效率,兼顾计数误差,分析抗体稀释度曲线的二次导函数为0的最大和最小值之间的斜率最大部分,定位ED50为最适抗体工作浓度,结果见图1。即抗体稀释度为1∶1000时,以此作为本研究合适的工作浓度。
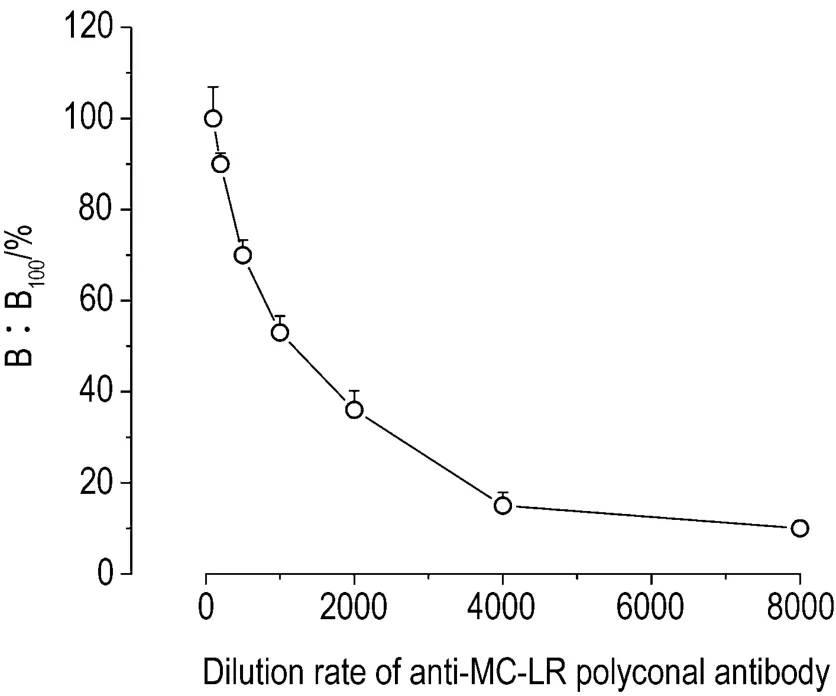
Fig.1 Dilution curve of polyclonal antibody by microcystin(MC)-LR AlphaLISA.Series diluted polyclonal antibodies were added to wells with blank sample by MC-LR AlphaLISA.Each dilution was tested twice.B100:bound 100;standing for counts per second(cps)of zero concentration,when dilution rate was 1∶100.n=2.
2.2 二抗反应浓度的确定
在兔多抗浓度为1∶1000时,对生物素-羊抗兔的浓度进行了选择,并比较了对应的NSB的干扰荧光值,结果见图2。当二抗浓度在1∶200时,有最高的荧光值(B0最大)和相对较低的NSB,即最佳信噪比B0/NSB。因此,选择此浓度为生物素二抗反应浓度。
2.3 反应体系的选择
为考察反应缓冲液对本研究反应体系的影响,分别采用HEPES,PBS和Tris-HCl稀释各试剂进行检测,结果见图3。当采用PBS和Tris-HCl缓冲液时,对竞争反应的影响差异不大;而用HEPES时,发光效率较低。因PBS缓冲体系在免疫反应中较为常用,所以本研究选用PBS缓冲液。
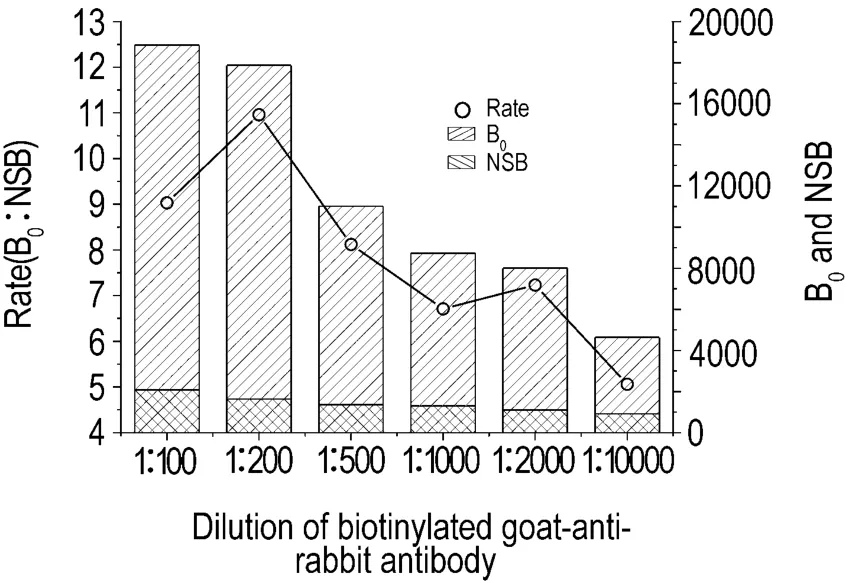
Fig.2 Bound 0(B0)/non-specific bounding(NSB)change in different dilutions of biotinylated second antibody.Biotinylated second antibody was diluted from 1∶100 -1∶10 000 to get higher bounding with lower NSB in competitive MC-LR system.n=2.
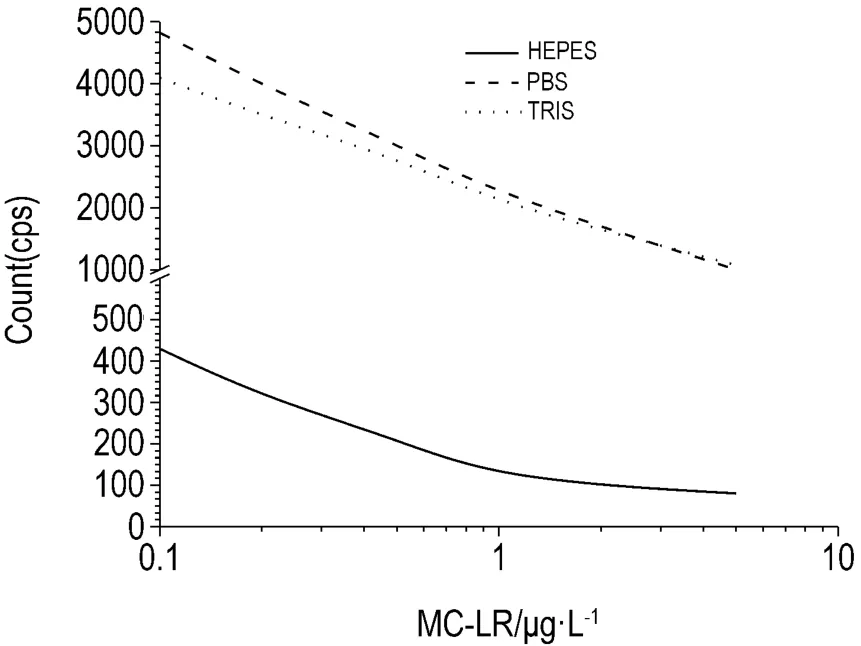
Fig.3 Standard curves of MC-LR with HEPES,PBS and Tris-HCl buffer by AlphaLISA.MC-LR AlphaLISA was optimized in different reaction buffer,which was HEPES,PBS and Tris-HCl,respectively.
2.4 反应时间的优化
免疫反应的时间对于抗原抗体的结合速度影响较大,一般随着时间的延长,结合率会升高,相应零浓度点的荧光值越高。而获得又快又准的荧光计数也是方法建立时的目标,由图4可知,在37℃反应,MC-LR AlphaLISA第一步时间延长结合率更高,30 min后结合率升高不明显(图4A);第二步反应速度相当较快,10 min后达到稳定(图4B)。因此,选用第一步反应30 min,第二步10 min作为本方法的反应时间。
2.5 MC-LR的AlphaLISA均相免疫分析法
经2.1~2.4反应条件的优化,得到竞争法MC-LR AlphaLISA的对数拟合标准曲线和精确性分析如图5所示。
2.6 方法学考核
2.6.1 灵敏度和稳定性
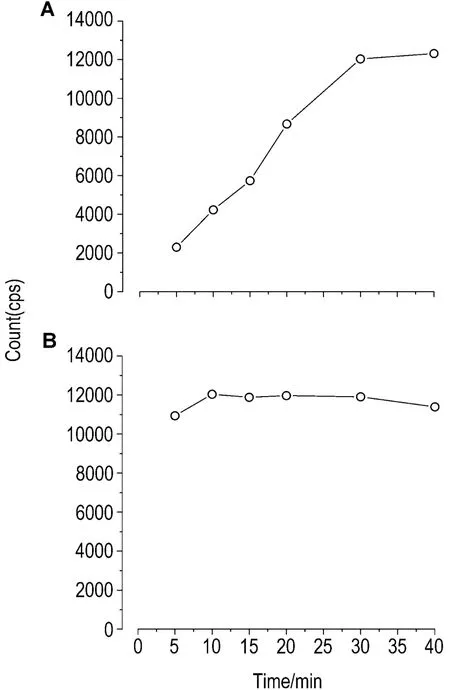
Fig.4 Effect of different time on first reaction(A)and second reaction(B).At 37℃,B0of different reaction times,5-40 min,was compared by MC-LR AlphaLISA method in the first step and second step.n=2.
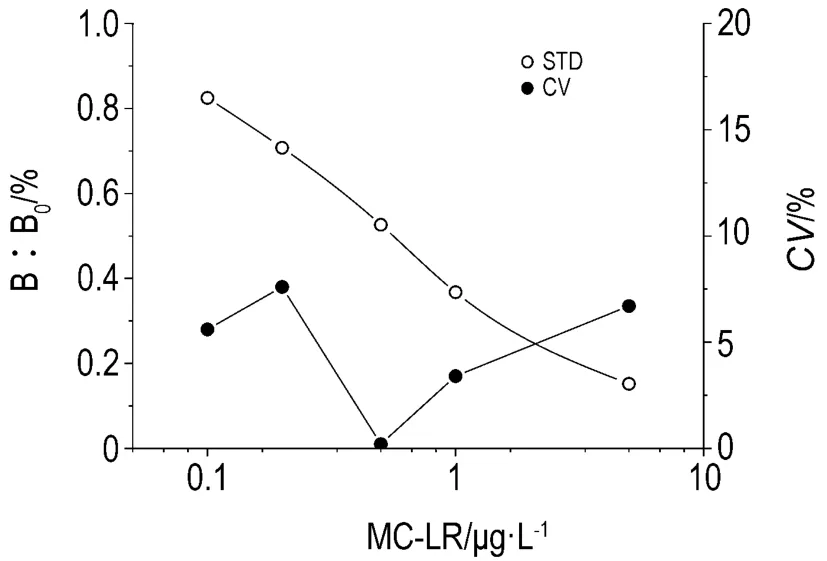
Fig.5 Standard curves and coefficient variation of MC-LR AlphaLISA.The best reaction condition confirmed in this research was that the dilution rate of poly antibody and biotinylated goat anti rabbit was 1∶1000 and 1∶200,respectively,PBS was used as the reaction buffer,the reaction time of first and second step was 30 min and 10 min,respectively.MC-LR standards were determinated twice under the condition mentioned above.n=2.
2.6.2 准确性与精密度
根据标准曲线的线性范围和有效剂量值,在每份空白样品中分别添加低中高浓度的MC-LR标准品,每份样品重复测定3次MC-LR含量,取平均,计算实测值与添加值之比,可得到样品的添加回收率,即竞争型MC-LR准确性。相同实验重复3次后,考核其变异系数,由此表征本方法的精密度。结果见表1。
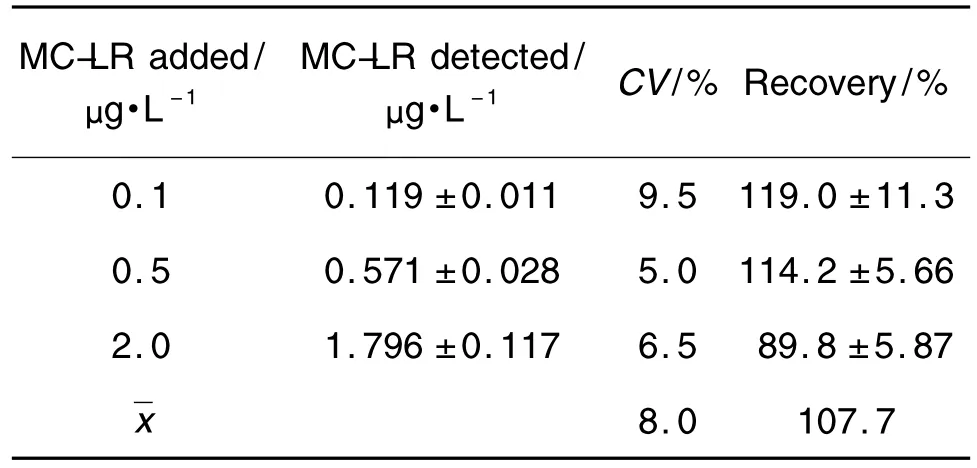
Tab.1 Accuracy and precision of MC-LR AlphaLISA
2.6.3 健全性
取高浓度样本经离心得上清液,稀释2,5和20 倍后分别添加到 0.1 ~5.0 μg·L-15 个参考标准品中,按检测程序测定,各稀释浓度测定值分别做曲线与标准品曲线比较。图6显示,以3种稀释液为基质,测定结果呈线性,与标准曲线重合或平行,本研究建立的检测方法健全性良好。
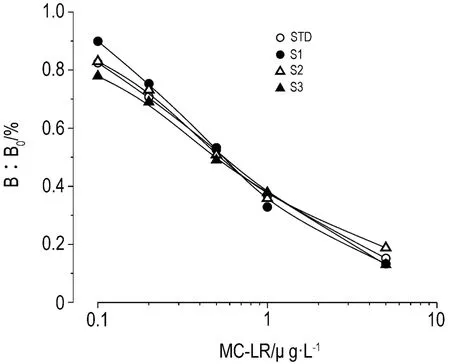
Fig.6 Validity curves of MC-LR AlphaLISA.The validity was estimated by the comparison of calibration curves constructed both before and after dilution of a series of positive samples with high amounts of MC-LR.The dilution rate was 2-fold,5-fold,and 20-fold,respectively.STD:standard curve without spiked;S1,S2 and S3:spiked with 2-fold,5-fold,and 20-fold dilution of high concentration samples,respectively.n=2.
2.6.4 特异性
MC-RR和MC-RY是MC-LR的结构类似物,分别将其稀释至 5 μg·L-1后复孔检测 MC-LR AlphaLISA,交叉反应率分别为13.2%和0.91%。
2.7 水样检测
随机选取水样检测时,经离心取澄清检测,发现含蓝藻的水体仅1 例超出1.0 μg·L-1的国家标准,其余15例均符合国家标准。经过超声波破壁处理后,MC-LR释出,浑浊样本组的超标率增加至7例,产生了显著差异(P<0.05)。而一般澄清水体超声前后,MC-LR含量变化不大 ,且没有超标样本出现。可见,与相关报道一致[15],MC-LR的含量与蓝藻密度、藻体是否分解有关。
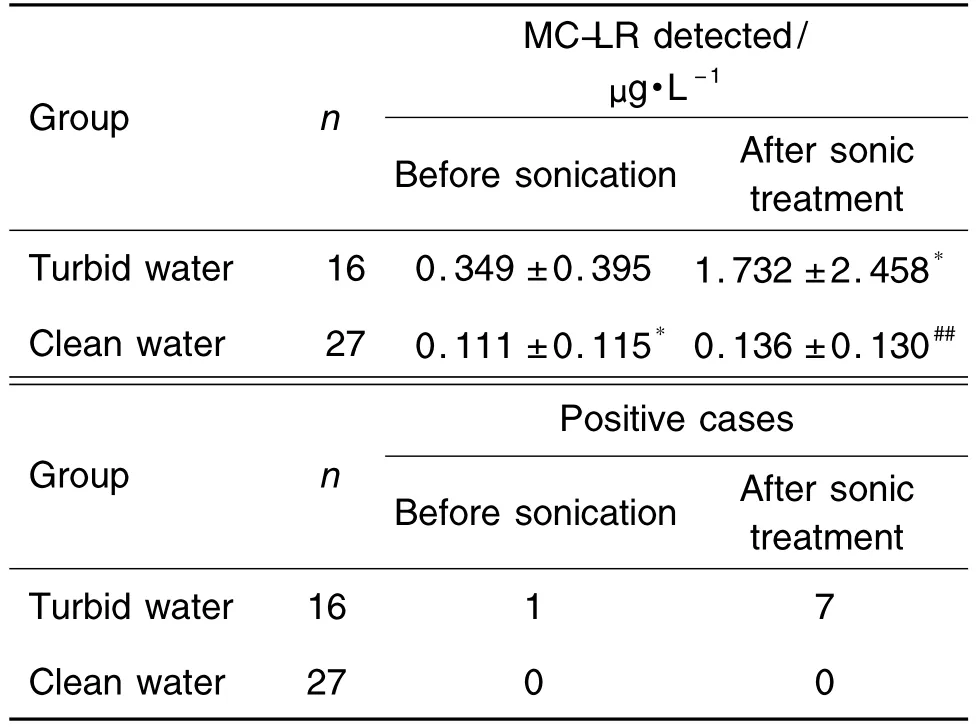
Tab.2 MC-LR detection of water samples
3 讨论
随着工业发展和农药滥用,很多污染物未经处理直接排放入江湖之中,造成水体蓝藻暴发事件时有发生[14-15]。
本实验采用的AlphaLISA被誉为免洗的ELISA方法,于2008年问世,有快速、稳定、高灵敏、无放射污染和操作简单的特点,技术核心是单线态氧的产生和传递,基于直径200 nm的微球实现,即本方法运用的发光微球和感光微球[16-17]。因此,该方法不同于传统的酶免、放免,避免了异相的洗涤过程,从而减少了操作误差,进而得到较好的精密度,本方法的CV<10%。由于采用微粒技术,使得反应的比表面积增加,抗体抗原之间的免疫应答更易进行,小分子的MC-LR更容易被抗体所捕获,从而缩短了反应时间,提高了反应的灵敏度。与传统的免疫反应至少需要1 h,且不包括显色时间,相对地,AlphaLISA从第一步加样到完成检测本方法耗时40 min,较其他异相免疫方法节约时间。本方法上样量每孔 20 μL,灵敏度达到0.006 μg·L-1,较时间分辨荧光免疫分析法的每孔50 μL和灵敏度0.01 μg·L-1[13]相比,试剂消耗少,反应灵敏。
在水样检测部分,通过超声波破碎,将蓝藻胞内MC-LR释放,与未破膜的结果产生显著差异,说明:胞外藻毒素只是蓝藻在代谢中产生的一部分毒素,而大量的毒素在藻体死亡后仍可能释放溶出,造成环境污染,对人类造成健康威胁。
通过考察抗体的反应浓度、反应体系、反应时间,本文建立了一种MC-LR的高灵敏AlphaLISA均相检测方法,其检测范围0.006 ~5 μg·L-1,能够满足国家对于饮用水MC-LR的限量标准。其变异系数小于10%,回收率介于80~120%,平均回收率107.7%,表明方法稳定,准确。因本方法免疫反应时间<1 h,是目前相对快速的免疫检测手段,上样量小,适于国内多水域以及水源水的大样本监测。
[1]Zhang WH,Xu XQ.Determination of trace level microcystins in water using solid-phase extraction and high performance liquid chromatography[J].Chin J Anal Chem(分析化学),2001,29(5):522-525.
[2]Sun L,Shen PP,Zhou Y,Hua ZC.Effects of Tai lake bloom microcystins on immune function of mice[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2002,16(3):226-230.
[3]Yu T,Xie P,Dai M,Liang GD.Isolation and identification of microcystins[J].Environ Sci Technol(环境科学与技术),2010,33(1):19-22.
[4]World Health Organization.Guidelines for drinkingwater quality,fourth edition[R].Switzerland,Geneva,WHO,2011:344.
[5]Republic of China,Standardization Administration of the People's Republic of China.GB5749-2006,Standards for drinking water quality(GB5749-2006,生活饮用水卫生标准)[S].Beijing:China Standards Press,2006.
[6]Xia SZ,Yang ZH.Research advances of detection and hazard of microcystins[J].Sichuan Environ(四川环境),2012,31(3):90-93.
[7]Poon KF,Lam MH,Lam PK,Wong BS.Determination of microcystins in cyanobacterial blooms by solid-phase microextraction-high-performance liquid chromatography[J].Environ Toxicol Chem,2001,20(8):1648-1655.
[8]Antoniou MG,Shoemaker JA,de la Cruz AA,Dionysiou DD.LC/MS/MS structure elucidation of reaction intermediates formed during the TiO2photocatalysis of microcystin-LR[J].Toxicon,2008,51(6):1103-1118.
[9]Wang Y,Yin LH,Pu YP,Zhang LJ,Zhu GC.A fluorescent protein phosphatase inhibition assay for the detection of microcytins in water[J].Mod Prev Med(现代预防医学),2006,33(5):681-683.
[10]Pan H,Song LR,Liu YD,Zhu YZ,Shen Q.Characterization of toxic water bloom-forming cyanobacteria by modified PCR[J].Acta Hydrobiol Sin(水生生物学报),2001,25(2):159-166.
[11]McDermott CM,Feola R,Plude J.Detection of cyanobacterial toxins(microcystins)in waters of northeastern Wisconsin by a new immunoassay technique[J].Toxicon,1995,33(11):1433-1442.
[12]Tsutsumia T,Nagataa S,Yoshidaa F,Uenoa F,Harada KI.Development and application of highly sensitive anti-immune complex ELISAs for microcystins in tap water[J].Food and Agricultural Immunology,2000,12(3):231-241.
[13]Niu WM,He EQ,Wu QG,Zhou WJ,Zhang Y,Huang B,et al.Use of fluorescent europium chelates as labels for detection of microcystin-LR in Taihu Lake,China[J].J Rare Earth,2012,30(9):941-946.
[14]Zhang JP,XIiao FG,Zhao XL,SUN XL,WU QG,HE EQ,et al.Analysis and detection technology of microcystin(微囊藻毒素分析检测技术)[M].Beijing:Chemical Industry Press,2010:10-11.
[15]Zhu MJ.Preliminary survey on water eutrophication and microcystins level in Fuzhou Shanzai Reservoir[J].Fujian Analy Testing(福建分析测试),2013,22(2):58-62.
[16]Szekeres PG,Leong K,Day TA,Kingston AE,Karran EH.Development of homogeneous 384-well high-throughput screening assays for Abeta1-40and Abeta1-42using AlphaScreen technology[J].J Biomol Screen,2008,13(2):101-111.
[17]Cauchon E,Liu S,Percival MD,Rowland SE,Xu D,Binkert C,et al.Development of a homogeneous immunoassay for the detection of angiotensinⅠin plasma using AlphaLISA acceptor beads technology[J].Anal Biochem,2009,388(1):134-139.

