蝙蝠蛾拟青霉菌丝体抗小鼠力竭疲劳作用
许宇辉,梁慧春,杨 征
(军事医学科学院基础医学研究所认知与心理卫生研究中心,北京 100850)
疲劳是一种普遍的生理现象,主要包括精神疲劳和躯体疲劳两种,在我国因过度疲劳致病甚至死亡的人数逐年增加,全球调查显示,35%以上的人群处于疲劳状态[1]。疲劳不仅伴随着各种疾病的发生如艾滋病、肝炎及肿瘤等[2-3],而且也会导致机体免疫力下降,内分泌失调,从而引起多种疾病,如感染、糖尿病等[1,4]。自 1880 年 Mosso 开始研究人类疲劳至今,大量研究者对疲劳进行了探讨,并对疲劳发生的机制提出了各种假说,如能量耗竭学说,代谢产物累积学说以及中枢递质失衡学说等[5]。在疲劳的研究中,我国具有丰富的中药资源与基础,很多中药已被广泛用于改善疲劳,并显示出优越的抗疲劳作用[6]。
虫草是我国稀有的传统药材,目前已发现的虫草种类至少有400多种[7],而其中的冬虫夏草〔Cordyceps sinensis(Berk.)Sacc〕特指产于青海、西藏及云南地区的虫草,其虫体为蝙蝠蛾科的虫草蝙蝠蛾幼虫。研究发现,冬虫夏草具有抗肿瘤、抗衰老、耐缺氧和调节机体免疫功能等多种药理学活性[8-9]。在抗疲劳领域的研究中,大量的研究结果也显示了冬虫夏草及其提取物具有改善人体运动耐力,缓解机体疲劳,延长啮齿类动物强迫游泳时间等多种抗疲劳作用[10-13]。
然而,由于野生冬虫夏草通常只能生长在3500~5000 m的青藏等地区,且必须寄生于蝙蝠蛾科的虫草蝙蝠蛾幼虫中才能生存,人们对其药用价值的研究与运用也受到了限制,近年来由于野生冬虫夏草资源的过度开采,使其成为濒危物种[14]。为解决这些问题,越来越多的研究者开始致力于冬虫夏草及其人工替代品的研发。1982年,中国中医研究院中药研究所在云南迪庆藏族自治州采集到新鲜冬虫夏草,并从中分离出10多种真菌菌株,其虫体经鉴定并确认为蝙蝠蛾科的虫草蝙蝠蛾。1989年,戴如琴等[15]对其中的4个菌株进行了培养和形态学观察,并将其命名为蝙蝠蛾拟青霉[15]。随着发酵培育技术的发展与运用,冬虫夏草中提取的蝙蝠蛾拟青霉菌株可通过人工发酵培育的方式进行大规模的无性繁殖与生产。由此获得的蝙蝠蛾拟青霉菌丝体(Paecilomyces hepiali mycelium,PHM)已被成功开发为滋补、保健的功能性食品或药物,如国内已上市的“金水宝胶囊”和国外已上市的“Cordy-MaxTM”。大量的研究表明,人工发酵培育的PHM具有与野生冬虫夏草相似的成分及药理学活性[16-19]。本研究的目的是采用轮式疲劳仪建立小鼠力竭疲劳模型,并通过检测疲劳相关的能源物质与代谢产物来评价人工培育的PHM对小鼠力竭疲劳的作用,并探讨其潜在的作用机制。
莫达非尼是一种中枢兴奋性药物,于1994年在法国上市,主要用于抗疲劳,调节睡眠,改善认知以及维持高危操作人员清醒状态[20-22]。研究发现,该药能够激动脑内 α1肾上腺素受体[23-24],并抑制多巴胺转运体,增加大脑皮质和尾状核多巴胺浓度[25-27],其抗疲劳作用与调节中枢的兴奋性神经递质水平有关。本研究选用莫达非尼作为阳性对照药物,以检测实验中所建立的力竭疲劳模型,并对比评价PHM的抗力竭疲劳作用。
1 材料与方法
1.1 药品、试剂及仪器
人工发酵培育的PHM干燥粉末(兰州科林生物医药有限公司,腺苷含量为0.74 mg·g-1)溶于灭菌注射用水中,配制成浓度为14,28和56 g·L-1的混悬溶液供小鼠ig给药。莫达非尼(山东齐鲁制药,生产批号:110619-1,纯度99.57%)溶于1%的CMC-Na 中,配制成浓度为 1.3 g·L-1的混悬溶液供小鼠 ig给药用。给药体积均为每 0.1 mL(10 g)。科研用试剂盒,包括糖原试剂盒、血清尿素氮试剂盒、乳酸试剂盒以及血清肌酸激酶试剂盒均购于南京建成生物工程研究所。
YLS-10B型8通道小鼠轮式疲劳仪(济南益延科技发展有限公司,中国),每个轮式跑道的宽为5 cm,直径为20 cm。UV-1200型紫外分光光度仪(上海美谱达仪器有限公司,中国)。D2012小型高速离心机(Scilogex,美国)。
1.2 动物、模型制备[24]与分组
72只雄性昆明小鼠,体质量为18~22 g,由军事医学科学院实验动物中心提供,动物合格证号:SCXK-(军)2012-0004。动物饲养环境温度为20~22℃,湿度为50% ~60%。动物自由摄食、饮水,并保持12 h的黑暗交替。饲养2 d后,随机分为6组,每组12只,分别为正常对照组,模型组,莫达非尼13 mg·kg-1组,PHM 140,280 和560 mg·kg-1组。除正常对照组外,其余小鼠采用轮式疲劳仪使小鼠接受每日30 min且连续18 d的强迫攀跑训练,第1 天(d 1)攀跑速度为 10.2 m·min-1,并在随后的d 5,d 9,d 13和d 17分别将速度增加至10.8,11.4,12.0 和12.6 m·min-1;d 19 小鼠进行速度为12.6 m·min-1,时间为60 min的力竭训练。除正常对照组小鼠仅给予溶媒而不参与攀跑训练外,其他所有小鼠均于给药后40 min进行强迫攀跑训练。
1.3 电击次数及体质量的测定
1.2项处理的各组小鼠,分别于d5,d9,d13,d17和d19记录小鼠在训练中所受的电击次数,并记录小鼠每天的体质量。
1.4 组织样本的准备与生化指标的检测
在d19力竭训练结束后,将小鼠置于安静环境中休息40 min,休息过程中自由摄食、饮水。休息结束后,通过眼眶取血,并立即经颈椎脱断处死小鼠,在冰板上迅速取出动物的肝和后肢肌肉组织,用冰冷生理盐水冲洗,滤纸吸干,称重后冻存于-20℃冰箱内。血液样品于45°斜面静置30 min后,以4000×g离心 15 min,取上清液,冻存于-20℃冰箱内。按照试剂盒要求检测以上组织样品中肌糖原,肝糖原,血清尿素氮、血清乳酸以及血清肌酸激酶的含量。
1.5 统计学分析
2 结果
2.1 PHM对力竭小鼠体质量的影响
表1结果显示,未参与攀跑训练的正常对照组小鼠的体质量略高于其他组动物,但无统计学差异。给予PHM和莫达非尼组的体质量与模型组相比,也无统计学差异,说明PHM和莫达非尼对小鼠的体质量无影响。
2.2 PHM对力竭小鼠电击次数的影响
表2结果显示,与模型组相比,莫达非尼组小鼠在首次给药后便能明显降低小鼠的电击次数,且d9,d13和d17所记录的电击次数仍显著低于模型组(P <0.01)。PHM 280和560 mg·kg-1组在连续给药17 d后,其电击次数才开始显著低于模型组(P<0.01)。在d19的力竭训练中,莫达非尼组和PHM 280和560 mg·kg-1组的电击次数显著下降(P <0.01)。此外,PHM 140 mg·kg-1虽然在一定程度上减少了小鼠的电击次数,但与模型组相比并无显著性差异。
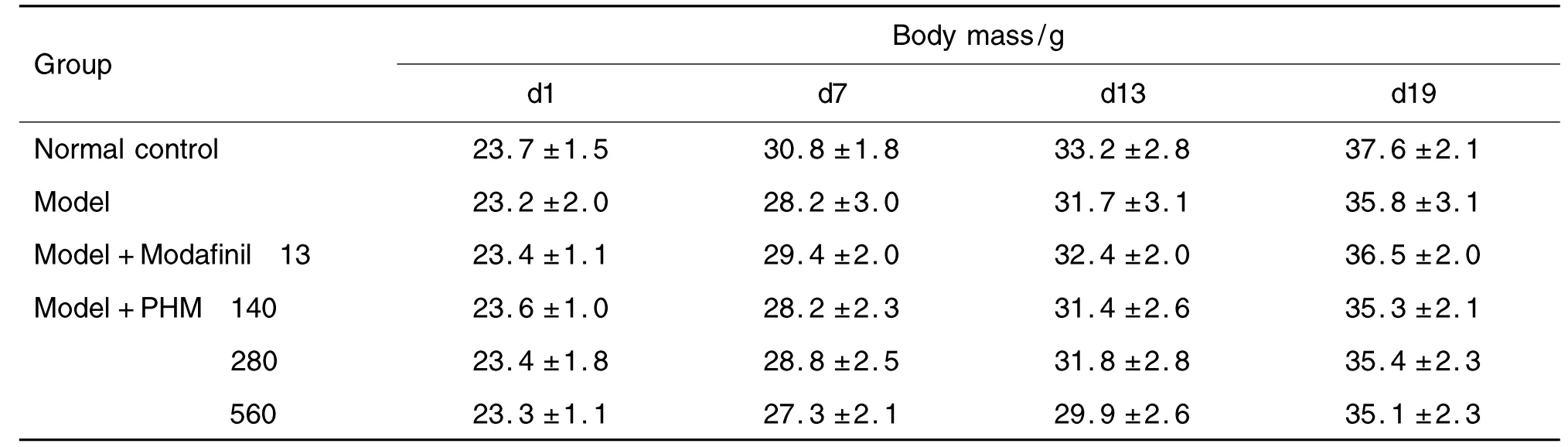
Tab.1 Effect of Paecilomyces hepiali mycelium(PHM)on body mass of exhausted mice
2.3 PHM对小鼠肌糖原、肝糖原、血清尿素氮、血清乳酸以及血清肌酸激酶水平的影响
表3结果显示,与未参与攀跑训练的正常对照组相比,模型组小鼠的肌糖原和肝糖原水平显著降低(P<0.01),而血清尿素氮和血清肌酸激酶水平则显著升高(P<0.05),说明小鼠在接受长期高强度的运动训练后,其体内能源供给不足,代谢产物累积过度。然而,这种致疲劳的改变可以通过连续使用PHM而得到改善或恢复,尤其是PHM 560 mg·kg-1不仅能有效升高由高强度运动所致低水平的肌糖原和肝糖原(P<0.01),还能显著降低由高强度运动所致高水平的血清尿素氮,血清乳酸和血清肌酸激酶(P<0.05)。阳性对照药物为莫达非尼对于长期高强度运动所致的疲劳相关能源物质含量的下降及代谢产物的累积并无明显的改善作用。
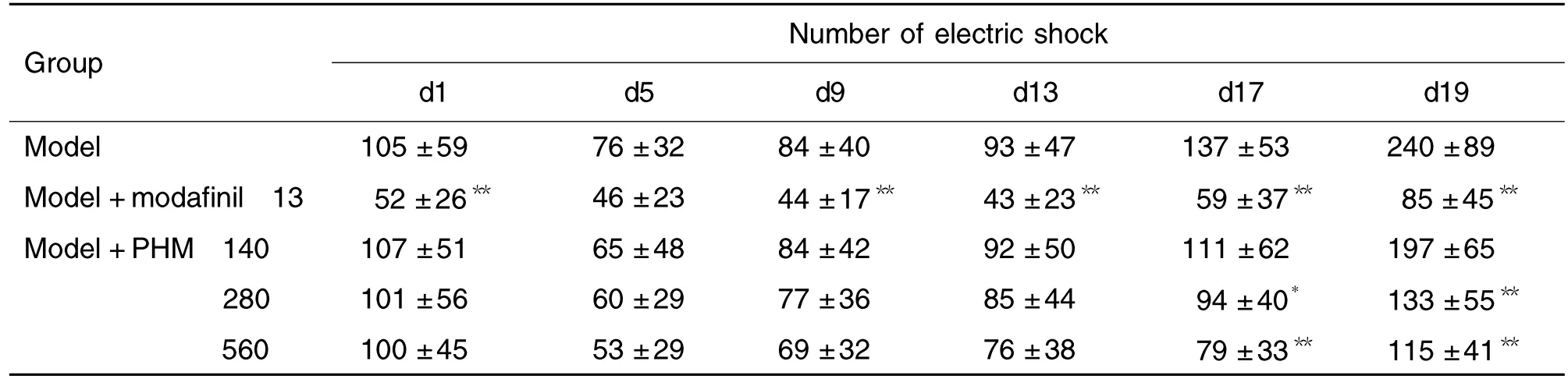
Tab.2 Effect of PHM on number of electric shocks of exhausted mice
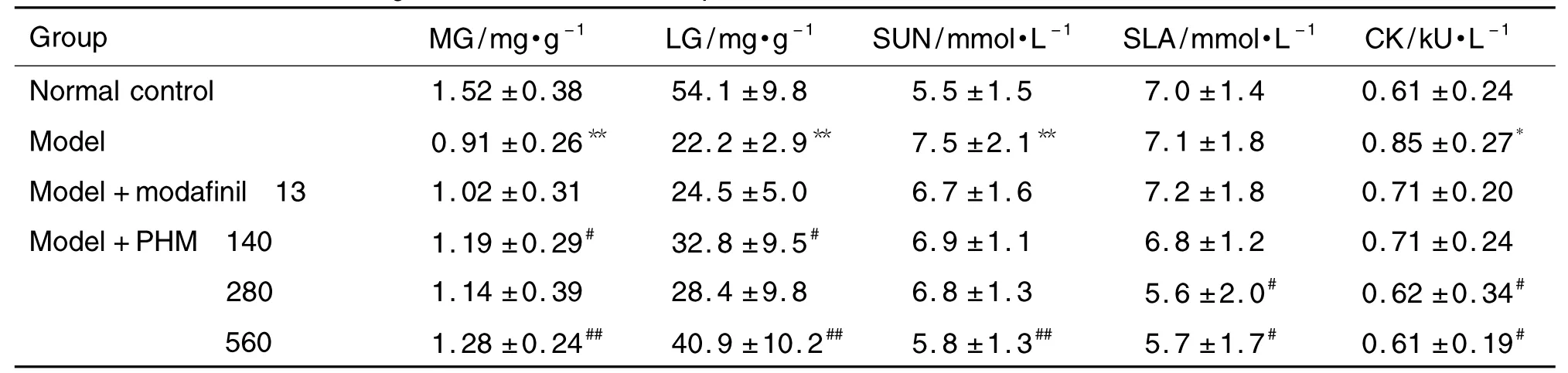
Tab.3 Effect of PHM on fatigue-related biochemical parameters of exhausted mice
3 讨论
本研究结果显示,PHM连续给药17 d后能够显著降低小鼠的电击次数,并能显著增加小鼠体内肌糖原和肝糖原水平,降低致疲劳代谢产物血清尿素氮、血清乳酸以及血清肌酸激酶的水平。PHM抗疲劳机制与莫达非尼并不相同,PHM可能通过增加机体糖原的储备,增强有氧代谢,并减少运动后体内致疲劳代谢产物的积累而起到抗疲劳的作用。
一直以来,许多研究中均采用强迫游泳模型来进行力竭疲劳实验,但存在易致动物呛水,造成动物恐惧等缺点。目前,一些研究也开始关注并利用啮齿类动物善于攀跑的特性,通过采用轮式疲劳仪来强迫动物接受长期的攀跑训练,以此来模拟动物的力竭疲劳[28-29]。与强迫游泳模型相比,轮式疲劳仪能够避免人为计时误差、动物呛水、恐惧等因素对实验造成的干扰,同时实验人员可以根据实验情况来调整和设置动物攀跑训练的各种条件和参数,如运动速度、运动强度以及运动时间等。在训练过程中,仪器通过电击来强迫小鼠进行力竭运动并自动记录动物的被电击次数,从而更客观地反映动物的运动耐力与疲劳的发展。
本研究发现,阳性对照药莫达非尼在首次给药后便能显著减少动物的电击次数,增强动物的运动耐力,但其对高强度运动所致体内肌糖原,肝糖原,血清尿素氮、血清乳酸以及血清肌酸激酶改变并无影响,该结果与文献报道相似[24,30]。许多研究显示,莫达非尼能够激动脑内 α1肾上腺素受体[23-24],抑制多巴胺转运体,增加大脑皮质和尾状核多巴胺浓度[25-27]的作用,并能增加动物的自发活动。因此,其抗疲劳作用可能与调节中枢兴奋性神经递质水平有关。PHM首次给药并不能马上起效,但其在连续给药17 d后开始显示出抗疲劳作用,在显著降低小鼠电击次数的同时,还能显著增加小鼠体内肌糖原和肝糖原含量,并降低血清尿素氮、血清乳酸以及血清肌酸激酶水平。此外,文献报道显示,PHM 具有镇静、催眠作用[31],由此说明,PHM抗力竭疲劳的机制与莫达非尼不同,与调节中枢兴奋性神经递质水平无关。
目前对于运动性疲劳的形成机制有多种理论学说,如“能源耗竭理论”,“代谢产物累积理论”及“内环境稳定性失衡理论”等[5,32]。这些理论学说认为,疲劳是由机体运动后能源物质储备下降,致疲劳的代谢产物累积以及由此引发的细胞内环境失衡等多种因素引起[5,32-33]。研究表明,运动所致的体能耗竭总是与糖原的耗竭同时发生。当机体进行高强度运动时,肌糖原可迅速被动用,从而为肌肉的收缩提供能量,随着运动时间的延长和运动强度的增加,肌糖原逐渐耗竭。此时,为维持正常的血糖水平,机体开始动用肝糖原,进而导致肝糖原减少[34]。糖原的耗竭将会严重影响机体的运动能力,尤其是运动耐力。因此,体内肌糖原和肝糖原的含量是反映躯体运动耐力和疲劳发生快慢或程度的敏感指标[35-37]。通常情况下,糖原等物质的有氧代谢是机体的主要供能方式,1 mol葡萄糖可净生成32或34 mol ATP。但是在长时间、高强度的运动中,机体处于相对缺氧的状态,由于有氧代谢的速度较慢,无法及时满足能量需要,因此机体通过无氧糖酵解方式迅速生成ATP供能。然而,1 mol葡萄糖经糖酵解方式只能净生成2 mol ATP,其供能效率远远低于有氧代谢,不仅增加了糖原消耗的速度和程度,同时还导致机体生成大量的乳酸。研究表明,乳酸作为无氧糖酵解的产物会引起骨骼肌细胞内H+和无机磷(Pi)的堆积,从而抑制横桥活性和肌浆网中Ca2+释放,并降低肌纤维对Ca2+的敏感性,最终使肌细胞收缩功能下降而出现疲劳[38-41]。因此,乳酸水平也是反映机体有氧代谢能力和疲劳程度的重要指标。此外当糖原代谢所提供的能量无法满足机体运动所需的能量时,机体会动员脂肪的分解,甚至蛋白质的分解来提供能量,从而使蛋白代谢产物血清尿素氮的含量升高,因而通过检测机体血清尿素氮的含量也可以反映出机体的运动供能和代谢情况,从而间接提示机体的运动耐力与疲劳程度[42]。当机体功能不足时,体内血清肌酸肌酶能够代偿性的增加,从而促进磷酸基团转换为肌酸,并进一步促使肌酸转变为高能磷酸肌酸分子,以作为细胞快速获取能量的来源。但是,血清肌酸肌酶含量的增加会对肌肉造成物理或化学形式的损伤,从而降低机体的运动耐力,加重机体的疲劳状况[43-44]。因此,体内血清肌酸激酶含量的升高可以反映出机体供能不足和运动能力下降。
综上,PHM可能通过增加能源物质的储备,增强机体有氧代谢能力,并减少机体致疲劳代谢产物的积累,以维持机体内环境稳定及正常代谢功能,从而起到抗力竭疲劳的作用。PHM作为冬虫夏草替代品用于缓解疲劳可能具有一定的潜力和良好的前景。
[1]He JL.Review on the evaluateion standard of body fatigue[J].Tibetan Med J(西藏医药杂志),2013,34(2):29-32.
[2]Posadzki P,Moon TW,Choi TY,Park TY,Lee MS,Ernst E.Acupuncture for cancer-related fatigue:a systematic review of randomized clinical trials[J].Support Care Cancer,2013,21(7):2067-2073.
[3]Tavakkoli M,Ferrando SJ,Rabkin J,Marks K,Talal AH.Depression and fatigue in chronic hepatitis C patients with and without HIV co-infection[J].Psychosomatics,2013,54(5):466-471.
[4]Li X,Huang WX,Lu JM,Yang G,Ma FL,Lan YT,et al.Study of the neuroendocrine and immunologic mechanism of fatigue caused by military operations[J].Med J Chin PLA(解放军医学杂志),2012,37(1):62-65.
[5]Yu G.Review on the research of sports fatigue mechanism[J].Sci Technol Inf(科技信息),2013,(19):272-273.
[6]Zheng W,Yang HB.Review of progress made in researches on kinetic fatigue resistance by using traditional Chinese medicines[J].J Phys Educ(体育学刊),2010,17(6):107-112.
[7]Paterson RR. Cordyceps:a traditional Chinese medicine and another fungal therapeutic biofactory?[J].Phytochemistry,2008,69(7):1469-1495.
[8]Ng TB, Wang HX. Pharmacologicalactions of Cordyceps,a prized folk medicine[J].J Pharm Pharmacol,2005,57(12):1509-1519.
[9]Yue K,Ye M,Zhou Z,Sun W,Lin X.The genus Cordyceps:a chemical and pharmacological review[J].J Pharm Pharmacol,2013,65(4):474-493.
[10]Koh JH,Kim KM,Kim JM,Song JC,Suh HJ.Antifatigue and antistress effect of the hot-water fraction from mycelia of Cordyceps sinensis[J].Biol Pharm Bull,2003,26(5):691-694.
[11]Nagata A, Tajima T, Uchida M. Supplemental anti-fatigue effect of Cordyceps sinensis(tochukaso)extract powder during three stepwise exercise of human[J].Jpn J Phys Fitness Sports Med,2006,5(Suppl):S145-S152.
[12]Li T, Li W. Impactof polysaccharides from Cordyceps on antifatigue in mice[J].Scic Res Essay,2009,4(7):705-709.
[13]Kumar R, Negi PS, Singh B, Ilavazhagan G,Bhargava K,Sethy NK.Cordyceps sinensis promotes exercise endurance capacity of rats by activating skeletal muscle metabolic regulators[J].J Ethnopharmacol,2011,136(1):260-266.
[14]Leung PH,Zhang QX,Wu JY.Mycelium cultivation,chemical composition and antitumour activity of a Tolypocladium sp.fungus isolated from wild Cordyceps sinensis[J].J Appl Microbiol,2006,101(2):275-283.
[15]Dai RQ,Lan JL,Chen QT,Chen WH,Li XM,Shen CY.Research on Paecilomyces hepiali Chen et Dai,sp.nov.[J].Acta Agr Univ Pekinensis(北京农业大学学报),1989,15(2):221-224.
[16]Wang F,Zhu PX,Liang YX,Zhao SM,Yan NF.Effects of polysaccharides of the mycelium of Cordyceps sinensis on ability of anti-fatigue and anti-anoxia in mice[J].Food Sci Technol(食品科技),2012,37(10):164-167.
[17]Wei L,Zhao YH,Guo S.The content of active components of Cordyceps sinensis[J].West China J Pharm Sci(华西药学杂志),2003,18(5):359-360.
[18]Xiang M,Tang J,Zou XL,Zhao ZY,Wang YY,Xie SN.Beta cell protecting and immunomodulatory activities of Paecilomyces Hepiali Chen mycelium in STZ induced T1DM mice[J].Am J Chin Med,2009,37(2):361-372.
[19]Yu HF.Optimization of parameters affecting the enzymatic extraction of mannitol and adenosine from Paecilomyces hepiali mycelium[J].Acta Edulis Fungi(食用菌学报),2010,17(4):44-47.
[20]Turner DC, Clark L, Dowson J, Robbins TW,Sahakian BJ.Modafinil improves cognition and response inhibition in adult attention-deficit/hyperactivity disorder[J].Biol Psychiatry,2004,55(10):1031-1040.
[21]Ballon JS, Feifel D. A systematic review of modafinil:Potential clinical uses and mechanisms of action[J].J Clin Psychiatry,2006,67(4):554-566.
[22]Wisor JP,Dement WC,Aimone L,Williams M,Bozyczko-Coyne D.Armodafinil,the R-enantiomer of modafinil:wake-promoting effects and pharmacokinetic profile in the rat[J].Pharmacol Biochem Behav,2006,85(3):492-499.
[23]Siegel JM.REM sleep[M]∥Kryger MK,Toth T,Dement WC,eds.Principles and Practice of Sleep Medicine.4th ed.New York:Saunders.2005:120-135.
[24]Cao Y,Hu Y,Liu P,Zhao HX,Zhou XJ,Wei YM.Effects of a Chinese traditional formula Kai Xin San(KXS)on chronic fatigue syndrome mice induced by forced wheel running[J].J Ethnopharmacol,2012,139(1):19-25.
[25]Mignot E,Nishino S,Guilleminault C,Dement WC.Modafinil binds to the dopamine uptake carrier site with low affinity[J].Sleep,1994,17(5):436-437.
[26]de Saint Hilaire Z,Python A,Blanc G,Charnay Y,Gaillard JM.Effects of WIN 35,428 a potent antagonist of dopamine transporter on sleep and locomotor activity in rats[J].Neuroreport,1995,6(16):2182-2186.
[27]Wisor JP,Nishino S,Sora I,Uhl GH,Mignot E,Edgar DM.Dopaminergic role in stimulant-induced wakefulness[J].J Neurosci,2001,21(5):1787-1794.
[28]Ottenweller JE,Natelson BH,Gause WC,Carroll KK,Beldowicz D,Zhou XD,et al.Mouse running activity is lowered by Brucella abortus treatment:a potential model to study chronic fatigue[J].Physiol Behav,1998,63(5):795-801.
[29]Ferreira A,Lamarque S,Boyer P,Perez-Diaz F,Jouvent R,Cohen-Salmon C.Spontaneous appetence for wheel-running:a model of dependency on physical activity in rat[J].Eur Psychiatry,2006,21(8):580-588.
[30]Hu Y,Cao Y,Liu M,Liu P,Cui H,Guo DH.Behavioral and biochemical effects of a formulation of the traditional Chinese medicine,Kai-Xin-San,in fatigued rats[J].Exp Ther Med,2013,6(4):973-976.
[31]Ding T,Shao Y,Fan MZ.Isolation and identification of sedative and hypnotic compound from the fermentation broth of Hirsutella sinensis[J].Mycosystema(菌物学报),2008,27(6):956-963.
[32]Huang CC,Hsu MC,Huang WC,Yang HR,Hou CC.Triterpenoid-rich extract from Antrodia camphorata improves physical fatigue and exercise performance in mice[J].Evid Based Complement Alternat Med,2012,2012:364741.
[33]You LJ,Zhao MM,Regenstein JM,Ren JY.In vitro antioxidant activity and in vivo anti-fatigue effect of loach(Misgurnus anguillicaudatus)peptides prepared by papain digestion[J].Food Chem,2011,124(1):188-194.
[34]Qu S.Glucose metabolism[M]∥Cha XL,Zhou CY.Biochemistry(生物化学).7th ed.Beijing:People's Medical Publishing House,2010:105-108.
[35]Wang L,Zhang HL,Lu R,Zhou YJ,Ma R,Lv JQ,et al.The decapeptide CMS001 enhances swimming endurance in mice[J].Peptides,2008,29(7):1176-1182.
[36]Jin HM,Wei P.Anti-fatigue properties of tartary buckwheat extracts in mice[J].Int J Mol Sci,2011,12(8):4770-4780.
[37]Hang YJ,Du WH.Domestic and foreign research progress on anti-fatigue[J].Pract Prev Med(实用预防医学),2012,19(7):1112-1116.
[38]Brooks GA.Ctate doesn't necessarily cause fatigue:why are we surprised?[J].J Physiol,2001,536(Pt 1):1.
[39]Phillips SK,Wiseman RW,Woledge RC,Kushmerick MJ.The effect of metabolic fuel on force production and resting inorganic phosphate levels in mouse skeletal muscle[J].J Physiol,1993,462:135-146.
[40]Mainwood GW,Renaud JM.The effect of acidbase balance on fatigue of skeletal muscle[J].Can J Physiol Pharmacol,1985,63(5):403-416.
[41]Mainwood GW,Worsley-Brown P.The effects of extracellular pH and buffer concentration on the efflux of lactate from frog sartorius muscle[J].J Physiol,1975,250(1):1-22.
[42]Shang H,Cao S,Wang J,Zheng H,Putheti R.Glabridin from Chinese herb licorice inhibits fatigue in mice[J].Afr J Tradit Complement Altern Med,2009,7(1):17-23.
[43]Coombes JS,McNaughton LR.Effects of branchedchain amino acid supplementation on serum creatine kinase and lactate dehydrogenase after prolonged exercise[J].J Sports Med Phys Fitness,2000,40(3):240-246.
[44]Warren GL,Ingalls CP,Lowe DA,Armstrong RB.Excitation-contraction uncoupling:major role in contraction-induced muscle injury[J].Exerc Sport Sci Rev,2001,29(2):82-87.

