缰核在中枢奖赏调控的机制及其在精神疾病中的作用研究进展
杨澍均,张 茵,张富强
(1.宁波大学医学院,浙江宁波 315211;2.宁波卫生职业技术学院,浙江宁波 315010;3.宁波市微循环与莨菪类药研究所,浙江宁波 315010)
缰核(habenala,HB)是一个在生物进化过程中古老且保守的中枢核团,近年来发现它在中脑边缘多巴胺奖赏系统中发挥重要作用,成为研究热点之一。中枢神经系统中有两个连接边缘前脑和中脑与后脑的并行通路:背侧间脑传导系统[1]及内侧前脑束。其中背侧间脑传导系统由缰核,髓纹和后屈束3部分组成。缰核作为背侧间脑传导系统的中心环节参与了多种行为调控,如母性行为、疼痛、睡眠、应激、学习和奖赏[2]。缰核由形态结构和功能完全不同的2部分组成:即内侧部(medial Hb,MHb)和外侧部(lateral Hb,LHb)[3],Hb的大部分生物学功能与LHb有关。LHb主要通过影响中脑多巴胺和5-羟色胺系统发挥作用。僵核的病变会引起认知功能的异常,还与多种精神性疾病如抑郁、精神分裂症及药物成瘾等有关。
1 缰核的解剖结构及生物学功能
僵核是连接前脑和中脑的一个负反馈核团,在发育过程中结构保守,存在于所有的脊椎动物。从鸟类开始僵核缩小后位于丘脑后部背侧,分化为LHb和MHb,与松果体共同组成上丘[4]。
僵核解剖学位置很重要,广泛联络边缘系统诸结构,并将神经冲动传至脑干及低位躯体、内脏活动中枢,使边缘系统对躯体内脏功能的调节得以实现。僵核的主要传入纤维是髓纹,传出纤维是后屈束。前脑的诸多核团,通过γ-氨基丁酸能轴突沿髓纹投向僵核,换元后经后屈束投向中脑奖赏系统多巴胺、5-羟色胺胞体。虽然还存在沿内侧前脑束的更直接的反馈通路,然而经髓纹-僵核-后屈束的回路是所有高等脊椎动物前脑下行控制中脑多巴胺、5-羟色胺能神经元的主要通路,是缝际核和多巴胺神经元胞体的主要传入纤维(图1)。
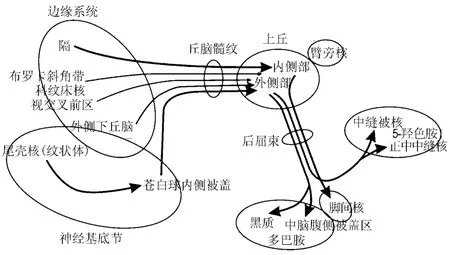
图1 缰核的传入和传出投射[5].
从组织化学和功能角度又可以把LHB和MHb分为15个亚区。LHb又可以分为 LHb内侧部(LHbm)和 LHb 外侧部(LHbl)[6]。事实上,MHb和LHb是形态、功能完全迥异的结构,两者之间几乎没有投射通路。
MHb的传入纤维主要是胆碱能的,来自隔核(几乎所有隔核神经元都投射到MHb),也有来自伏隔核(nucleus accumbens,NAc)和斜角带的。LHb的传入纤维主要是γ-氨基丁酸能的,来自内侧苍白球(灵长类)(大鼠的同源区是脚内核),也有部分来自边缘前脑如:外侧下丘脑、斜角带、无名质、伏隔核、前额皮质以及视上交叉核。MHb和LHb还接收少量来自中央灰质和内侧缝际核的上行纤维,LHb还接收来自黑质和中脑腹侧被盖(ventral tegmental area,VTA)的多巴胺能神经投射。MHb的主要传出纤维为胆碱能、谷氨酸能和P物质能,通过后屈束的内核部投射到脚间核、VTA、缝际核和黑质。LHb的传出投射相对广泛,主要传到中脑的核团,如缝际核的背侧和内侧部(也是缝际核的主要传入之一)、VTA和黑质致密区,以及中央灰质;LHb的轴突主要沿后屈束的外周或鞘部走向,投射到丘脑(背内侧、腹内侧)、下丘脑(外侧、视前区)[5]。LHb参与许多重要的生物学功能,如通过丘脑的感觉门控、通过中央灰质的痛觉门控、运动的定势行为、通过下丘脑、黑质和VTA的奖赏机制,应激反应、学习、认知、性和母性行为、睡眠周期和营养等。
2 中枢奖赏网络及功能新学说
近年来,对中枢奖赏机制的多巴胺学说有了新的认识,揭示了一个超越中脑边缘多巴胺系统的复杂奖赏网络[7]。大量的研究提示,不存在单一的奖赏部位,奖赏通路也不是串行的,而是存在一个并行的复杂网络。除了VTA到腹侧纹状体(ventral striatum,VS)(主要是NAc)多巴胺投射系统外,γ-氨基丁酸能系统、谷氨酸能系统同样也可以激活脑内奖赏网络。图2是脑内奖赏网络的假设图,图中所列的众多核团都可以建立脑内自我电刺激或脑内自我给药行为或二者兼有。Ikemoto[7]根据各核团的神经投射归纳出5个主要的奖赏激活位点:后腹侧被盖区、内侧嗅结节 /内侧伏核壳、乳头上核(后腹侧被盖区的前部延伸)[8],正中中缝核/中缝背核[9]以及嘴内侧被盖核(后腹侧被盖区的向后延伸)[10-12],以此为核心组成奖赏网络结构,提出靠近协调模块(approach coordinator module)学说,对多巴胺奖赏网络的功能进行了新的阐释,认为奖赏网络的功能是通过与其他过程(包括知觉、强化等过程)的协调形成一个总体的功能-靠近行为,即生命进化过程中最主要的生物功能-趋利(approach)避害(withdrawal),也可以说是涵盖广义的动机/驱动过程。该网络的激活取决于机体所处的内外环境,在奖赏网络的激活过程中可以形成条件性位置偏爱行为、自发活动的增加、非条件性刺激(如视觉刺激)奖赏效应、与靠近行为相关的生理指标的改变(如交感兴奋自主效应,也包括与靠近行为相关的海马 θ波放电等)、弱的类应激效应(mild stress-like effect)等。
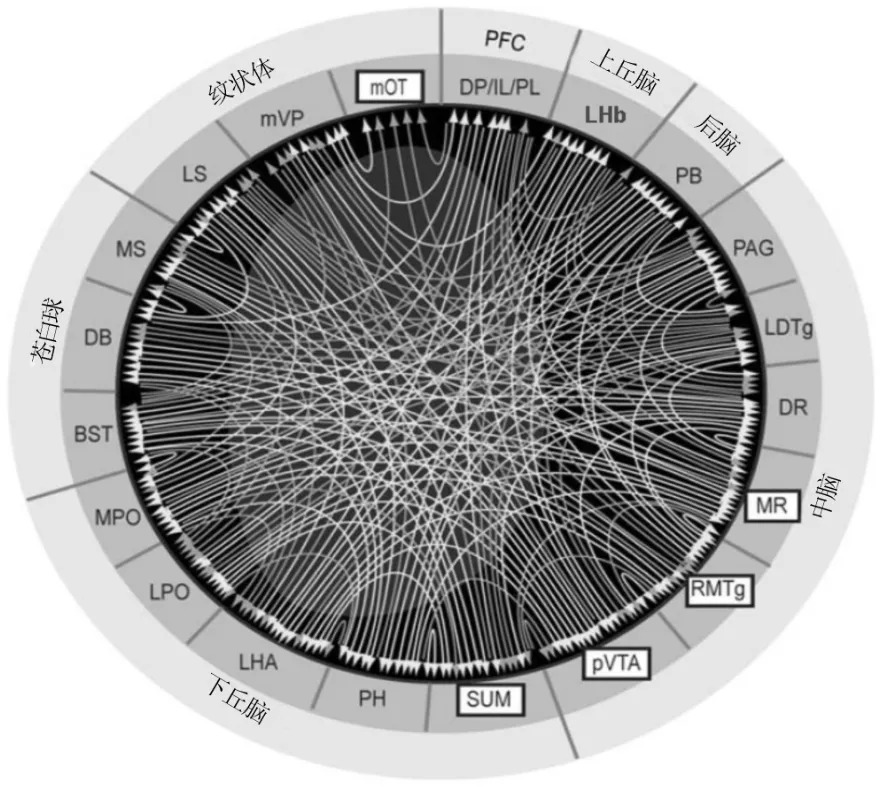
图2 脑内奖赏网络假设图[13].BST:终纹床核;DB:布罗卡斜角带;DP:脚背侧皮质;DR:中缝背核;IL:缘下回;LDTg:被盖背外侧核;LHA:外侧下丘脑区;LHb:外侧缰核;LPO:视前外侧区;LS:外侧隔核;MPO:视前内侧区;MR:正中中缝核;MS:内侧隔核;mOT:内侧嗅结节(包括伏核内侧壳部);mVP:腹内侧苍白球;PAG:导水管周围灰质;PB:臂旁核;PH:下丘脑后区;PL:缘前皮质;pVTA:后腹侧被盖区;RMTg:嘴内侧被盖核;SUM:乳头上核;PFC:大脑前额叶皮质.
3 僵核是脑奖赏网络的重要节点
在上述的奖赏网络中,与其他部位相比,僵核解剖部位和生物学功能具有显著的特殊性和重要性。在奖赏网络5个主要激活位点中,僵核与VTA,嘴内侧被盖核,正中中缝核/中缝背核在解剖和功能上具有最直接的联系,这是该网络中其他部位所不具备的。LHb的兴奋导致VTA/黑质多巴胺神经元被抑制[14];正中中缝核/中缝背核的主要兴奋性传入来自LHb/MHb;而LHb的主要传出通路通过嘴内侧被盖核来中转[10]。僵核被认为通过作为前脑到中脑的负反馈驿站参与情绪动机行为的调控[2],采用实验手段损毁其功能可以导致一系列与疼痛、应激、焦虑、睡眠、奖赏、认知与运动等相关的行为改变。多巴胺、5-羟色胺是已知的参与正常运动和精神活动控制的最重要的两大神经递质系统,而僵核是中枢为数不多的几个能同时直接参与多巴胺、5-羟色胺控制的核团之一。僵核的生物学功能主要依赖与对多巴胺、5-羟色胺的调节控制。有学者提出僵核的主要生物学功能是运动抑制[13],而这恰好与奖赏网络中多巴胺的主要功能趋利相反,抑制多巴胺功能就是避害反应。趋利/避害是一个生命过程的两个方面,结合这两个学说,提示僵核在奖赏过程中发挥独特作用。
僵核的解剖结构和神经投射为多巴胺的抑制控制提供了基础,如电刺激LHb可以抑制>95%的VTA/SNc多巴胺神经元放电[14],损毁僵核可以引起皮质和纹状体多巴胺细胞外释放[15],损毁的行为结果是运动增加。虽然多巴胺是运动控制的主要神经递质,但真正发生躯体运动时多巴胺神经元的活动却没有改变。因此,多巴胺发挥其运动控制的机制被认为是通过错误信号来实现:即预期的奖赏和实际得到的奖赏差值的大小。突发的奖赏或实际奖赏大于预期奖赏时可以增加多巴胺神经元兴奋性,而当预期的奖赏没有到来或实际奖赏比预期小时多巴胺神经元活动被抑制,抑制信号的主要来源是LHb[16-17],而进一步研究明确了这种运动抑制信号通过苍白球内侧-僵核-嘴内侧被盖核最终达到VTA/SNc[10,18-19]。僵核的运动抑制功能具有进化上的基础:即睡眠控制。诸多实验依据支持僵核的睡眠控制作用:切断僵核的传出通路后屈束可以显著减少快速动眼睡眠;与睡眠可能具有共同机制的药物诱导麻醉条件下僵核活动显著增加;冬眠松鼠LHb/MHb褪黑素合成酶增加;MHb可以合成白细胞介素(IL)18(IL-18)[20],后者是促进睡眠的的重要细胞因子。僵核的运动抑制控制还表现在惩罚逃避和应激反应机制上。惩罚是比没有到来的奖赏预期更强的负性刺激,痛刺激条件下僵核活动增加,反过来,电刺激僵核或注射吗啡具有镇痛作用,提示僵核参与厌恶刺激(包括疼痛)的控制,这一假设也得到了有力的实验证明,厌恶刺激(包括条件性厌恶信号)可以显著增加僵核的放电活动。对厌恶刺激的前期反应是通过应激机制来处理的,主要是运动的抑制,该机制主要通过僵核抑制多巴胺机制来实现。
4 僵核与精神疾病的关系
4.1 抑郁
长期暴露在应激状态下的神经适应可以导致抑郁,这与LHb过度兴奋有关。实验研究表明,抑郁模型大鼠绝大多数脑区神经元活性(评估2-脱氧葡萄糖和细胞色素氧化酶染色)降低,但是LHb,MHb和IPN的神经元活性增加,而损毁大鼠的僵核能减少抑郁样行为。运动减少是抑郁的主要行为表现。重度抑郁患者基底神经核的血流和代谢减少[21],这与多巴胺 神经元活性减少有关[22],而这很可能是由于LHb对于多巴胺神经元的抑制效应的结果。
研究表明,重度抑郁还累及5-羟色胺系统,临床治疗抑郁药物都作用于5-羟色胺系统(如5-羟色胺重吸收抑制剂),而僵核直接参与调节5-羟色胺功能。基于这些理论支持[20,23],临床已报道,LHb作为DBS治疗靶点可以成功的治疗重度抑郁症[25]。
抑郁还与昼夜节律异常和睡眠障碍有关[25]。因为5-羟色胺对睡眠调节至关重要,所以这些症状常用5-羟色胺系统的功能失常来解释。然而由于僵核在睡眠中起作用,僵核的功能异常很有可能引起这些睡眠相关症状。
僵核的过度活性还可能通过调节神经免疫系统引起抑郁症。细胞活素类作为促进因子参与了包括抑郁等情绪障碍[26]。促炎症反应因子IL-18在大脑MHb中呈高特异性表达。而且当MHb对细菌感染和情绪应激作出反应时,IL-18水平升高,引起睡眠障碍,还可能导致疲劳[27]。
4.2 精神分裂症
僵核功能紊乱与精神分裂症的认知障碍有关,这与大量使用中枢神经兴奋剂诱发的类精神分裂症状态类似。研究表明,与对照组相比,慢性精神分裂症患者的上丘脑(包括僵核)的钙化(可能损伤僵核的功能)更加常见[28]。而且,功能磁共振成像研究显示,精神分裂症患者的僵核活性也发生改变。受试者完成高难度的匹配任务(matching-to-sample task)发生错误后,对照组的僵核被激活,而精神分裂症患者的僵核没有激活。有理由认为精神分裂症患者VTA和SNc中的多巴胺神经元可能不能获取来自僵核的抑制信号,这导致患者从错误中学习产生缺陷[29]。
除了学习缺陷,精神分裂症患者还表现为工作记忆、注意力和执行功能损伤。皮质-海马信息处理受多种神经递质如多巴胺、5-羟色胺、去甲肾上腺素和乙酰胆碱的调控,而这些神经递质又都受僵核的调控。动物实验表明,损毁僵核可以导致一系列认知功能障碍。
4.3 药物成瘾
僵核是滥用药物造成中枢神经系统损伤的最薄弱的一个环节[30],各种滥用药物如中枢神经兴奋剂(可卡因,苯丙胺)、尼古丁和乙醇等对中枢神经核团造成的损伤在形态学上可以观察到的最显著的是LHb,MHb及其传出投射后屈束的退化;最新研究发现可卡因暴露引起LHb突触强化[31],僵核信号传递在尼古丁强化中起重要作用[32-33]。
可以推测,滥用药物长期暴露导致的成瘾可能与僵核神经适应有关。笔者实验室研究发现,尽管损毁僵核对大鼠FR1程序下海洛因静脉自身给药行为的建立和维持都没有影响,而且累进比率程序下“break point”也没有改变[34],但在线索诱导的海洛因觅药过程中LHb的c-fos具有非常显著的表达[35]。有研究采用深部脑电刺激技术发现高低频交替刺激LHb可以减弱大鼠的可卡因觅药行为[36],而单独的低频或高频都没有影响。可以这样来理解这一现象,LHb传入主要来自基底神经核、VTA和正中中缝核,负的奖赏预期诱导基底神经核高频放电(频率110~150 Hz),正的奖赏预期诱导VTA多巴胺神经元和正中中缝核/中缝背核5-羟色胺神经元低频放电(频率8~12 Hz)。在预期奖赏没有到来时僵核兴奋性最强,交替使用高、低频刺激分别模拟来自基底神经核和VTA、正中中缝核/中缝背核的兴奋性传入可以最大化地兴奋LHb。
5 展望
僵核作为多巴胺奖赏网络中的一个重要的节点,以及它在奖赏(也包括维持个体生存的趋利避害)过程中的功能和作用机制,近年来已引起学术界的广泛关注并成为研究中枢核团的一个热点。同时由于僵核功能紊乱与许多精神疾病如抑郁、精神分裂症和成瘾等密切相关[15],也可能成为这些精神疾病临床治疗的潜在靶点。如本实验室采用深部脑电技术刺激缰核对大鼠海洛因觅药行为影响进行的基础研究,力求阐明缰核介导药物奖赏调控的神经生物学机制。可见,阐明缰核在奖赏和觅药动机中的作用和神经生物学机制具有重要的理论意义和临床应用价值。
[1]Sutherland RJ.The dorsal diencephalic conduction system:a review of the anatomy and functions of the habenular complex[J].Neurosci Biobehav Rev,1982,6(1):1-13.
[2]Lecourtier L,Kelly PH.A conductor hidden in the orchestra?Role of the habenular complex in monoamine transmission and cognition[J].Neurosci Biobehav Rev,2007,31(5):658-672.
[3]Andres KH,von Düring M,Veh RW.Subnuclear organization of the rat habenular complexes[J].J Comp Neurol,1999,407(1):130-150.
[4]Beretta CA, Dross N, Guiterrez-Triana JA,Ryu S,Carl M.Habenula circuit development:past,present,and future[J].Front Neurosci,2012,6:51.
[5]Hikosakac O.Habenula[J].Scholarpedia,2007,2(6):2703.
[6]Aizawa H, Kobayashi M, Tanaka S, Fukai T,Okamoto H.Molecular characterization of the subnuclei in rat habenula[J].J Comp Neurol,2012,520(18):4051-4066.
[7]Ikemoto S.Brain reward circuitry beyond the mesolimbic dopamine system:a neurobiological theory[J].Neurosci Biobehav Rev,2010,35(2):129-150.
[8]Ikemoto S. The supramammillarynucleus mediates primary reinforcement via GABAAreceptors[J].Neuropsychopharmacology,2005,30(6):1088-1095.
[9]Bromberg-Martin ES,Hikosaka O,Nakamura K.Coding of task reward value in the dorsal raphe nucleus[J].J Neurosci,2010,30(18):6262-6272.
[10]Jhou TC,Fields HL,Baxter MG,Saper CB,Holland PC.Therostromedialtegmentalnucleus(RMTg),a GABAergic afferent to midbrain dopamine neurons,encodes aversive stimuli and inhibits motor responses[J].Neuron,2009,61(5):786-800.
[11]Jhou TC, Geisler S, Marinelli M,Degarmo BA,Zahm DS.The mesopontine rostromedial tegmental nucleus:a structure targeted by the lateral habenula that projects to the ventral tegmental area of Tsai and substantia nigra compacta[J].J Comp Neurol,2009,513(6):566-596.
[12]Holstege G. Themesopontinerostromedial tegmental nucleus and the emotional motor system:role in basic survival behavior[J].J Comp Neurol,2009,513(6):559-565.
[13]Hikosaka O.The habenula:from stress evasion to value-based decision-making[J].Nat Rev Neurosci,2010,11(7):503-513.
[14]Ji H,Shepard PD.Lateral habenula stimulation inhibits rat midbrain dopamine neurons through a GABAAreceptor-mediated mechanism[J].J Neurosci,2007,27(26):6923-6930.
[15]Lecourtier L,Defrancesco A,Moghaddam B.Differential tonic influence of lateral habenula on pre-frontal cortex and nucleus accumbens dopamine release[J].Eur J Neurosci,2008,27(7):1755-1762.
[16]Matsumoto M,Hikosaka O.Lateral habenula as a source of negative reward signals in dopamine neurons[J].Nature,2007,447(7148):1111-1115.
[17]Kimura M,Satoh T,Matsumoto N.What does the habenula tell dopamine neurons?[J].Nat Neurosci,2007,10(6):677-678.
[18]Hong S,Hikosaka O.The globus pallidus sends reward-related signals to the lateral habenula[J].Neuron,2008,60(4):720-729.
[19]Lavezzi HN,Zahm DS.The mesopontine rostromedial tegmental nucleus:an integrative modulator of the reward system[J].Basal Ganglia,2011,1(4):191-200.
[20]Winter C,Vollmayr B,Djodari-Irani A,Klein J,Sartorius A.Pharmacological inhibition of the lateral habenula improves depressive-like behavior in an animal model of treatment resistant depression[J].Behav Brain Res,2011,216(1):463-465.
[21]Soares JC,Mann JJ.The functional neuroanatomy of mood disorders[J].J Psychiatr Res,1997,31(4):393-432.
[22]Kapur S,Mann JJ.Role of the dopaminergic system in depression[J].Biol Psychiatry,1992,32(1):1-17.
[23]Sartorius A,Henn FA.Deep brain stimulation of the lateral habenula in treatment resistant major depression[J].Med Hypotheses,2007,69(6):1305-1308.
[24]Sartorius A,Kiening KL,Kirsch P,von Gall CC,Haberkorn U,Unterberg AW,et al.Remission of major depression under deep brain stimulation of the lateral habenula in a therapy-refractory patient[J].Biol Psychiatry,2010,67(2):e9-e11.
[25]Imeri L,Opp MR.SarHow(and why)the immune system makes us sleep[J].Nat Rev Neurosci,2009,10(3):199-210.
[26]Dantzer R,O'Connor JC,Freund GG,Johnson RW,Kelley KW.From inflammation to sickness and depression:when the immune system subjugates the brain[J].Nat Rev Neurosci,2008,9(1):46-56.
[27]Sugama S,Conti B.Interleukin-18 and stress[J].Brain Res Rev,2008,58(1):85-95.
[28]Sandyk R. Pinealand habenula calcification in schizophrenia[J].Int J Neurosci,1992,67(1-4):19-30.
[29]Shepard PD,Holcomb HH,Gold JM.Schizophrenia in translation:the presence of absence:habenular regulation of dopamine neurons and the encoding of negative outcomes[J].Schizophr Bull,2006,32(3):417-421.
[30]Ellison G. Neuraldegeneration following chronic stimulant abuse reveals a weak link in brain,fasciculus retroflexus,implying the loss of forebrain control circuitry[J].Eur Neuropsychopharmacol,2002,12(4):287-297.
[31]Maroteaux M,Mameli M.Cocaine evokes projection-specific synaptic plasticity of lateral habenula neurons[J].J Neurosci,2012,32(36):12641-12646.
[32]Fowler CD,Kenny PJ.Habenular signaling in nicotine reinforcement[J].Neuropsychopharmacology,2012,37(1):306-307.
[33]Baldwin PR,Alanis R,Salas R.The role of the habenula in nicotine addiction[J].J Addict Res Ther,2011,S1(2).pii:002.
[34]Wang Y, Zhang F, Tang S, Lai M, Hao W,Zhang Y,et al.Lack of effect of habenula lesion on heroin self-administration in rats[J].Neurosci Lett,2009,461(2):167-171.
[35]Zhang F,Zhou W,Liu H,Zhu H,Tang S,Lai M,et al.Increased c-Fos expression in the medial part of the lateral habenula during cue-evoked heroin-seeking in rats[J].Neurosci Lett,2005,386(2):133-137.
[36]Friedman A, Lax E, Dikshtein Y, Abraham L,Flaumenhaft Y,Sudai E,et al.Electrical stimulation of the lateral habenula produces enduring inhibitory effect on cocaine seeking behavior[J].Neuropharmacology,2010,59(6):452-459.

