厄洛替尼在荷瘤小鼠的时辰药代动力学特点
刘 姣,李明春,王培培,张 彬
(1.青岛大学药学院药理学系,山东青岛 266071;2.解放军第401医院药剂科,山东青岛 266071)
时辰治疗学是根据机体生理、病理节律以及治疗方法本身节律的特点,制定最合理时间的治疗方案,以达到最佳治疗目的[1]。目前有多种抗肿瘤药物如5-氟尿嘧啶、甲氨蝶呤、长春瑞滨等单独或联合时辰化疗方案已得到证实并应用于临床[2-4]。
盐酸厄洛替尼(erlotinib)是一种选择性地作用于表皮生长因子受体酪氨酸激酶的小分子靶向药物。适用于既往接受过至少一个化疗方案失败后的局部晚期或转移的非小细胞肺癌的二、三线治疗。自问世以来,厄洛替尼以其高效低毒的优势赢得了广泛的市场应用前景,但是目前国内外关于厄洛替尼时辰药理学方面的研究还未见报道。本文主要通过HPLC测定荷瘤小鼠按时辰给予厄洛替尼血药浓度,探讨其时辰药动学特点。本实验借鉴了之前的昼夜节律的研究方法,包括人工昼夜的设置条件及荷瘤小鼠明暗期适应性饲养等,实验方法基本遵循国际认可的时辰药理学研究原则[5-7]。此前有文献应用液质联用测定体内样品中厄洛替尼的浓度[8],而我们在预实验的基础上在安全范围内采用了高剂量,最终血药浓度完全能够满足定量要求,且方法简便、灵敏、可靠。
1 材料与方法
1.1 药品、试剂及仪器
盐酸厄洛替尼片〔瑞士罗氏有限公司,批号:国药准字 J20090116,每片150 mg(以厄洛替尼计)〕;刮去包衣,研磨至粉末状后溶于0.5%CMCNa溶液中,使其浓度为15 g·L-1。给药前超声0.5 h。盐酸厄洛替尼对照品、索拉非尼对照品均购自加拿大TRC公司;乙腈(色谱纯);三氟乙酸、正己烷、乙酸乙酯等其他试剂均为分析纯。
Agilent 1260高效液相色谱仪(美国安捷伦公司);DV215CD型电子天平(美国 OHAUS);TCL16离心机(长沙英泰仪器有限公司);DC-24型氮吹仪(上海安谱科学仪器有限公司);WH-1微型旋涡混合仪(上海沪西分析仪器厂);STARTER 3C实验室pH计(上海奥豪斯仪器有限公司)。
1.2 动物
550只雌性C57BL小鼠,体质量9~13 g,购于北京维通利华实验动物技术有限公司,SPF级 ,许可证号:SCXK(京)2012-0001。将小鼠置于恒温(24±2)℃,恒湿(70±10)%,严格控制12 h光照(7:00~19:00),12 h黑暗的安静的环境中,明期照度(500±10)lx,暗期照度(20±5)lx,自由饮水、摄食,适应性饲养3周后用于实验。
1.3 肿瘤模型建立
Lewis肺癌细胞(来源ATCC)购于北京北纳创联生物技术研究院,密度为1×107L-1的细胞悬液,每只小鼠右腹股沟皮下注射0.2 mL。
接种肿瘤10 d后,选择种瘤成功的小鼠504只,随机分为6组,每组84只,分别于8:00,12:00,16:00,20:00,24:00和4:00单次单剂量ig给予盐酸厄洛替尼150 mg·kg-1(每只小鼠ig给予0.2 mL)。各组给药前12 h禁食。各组分别于给药后5,10,20,30,45 min,1.5,3,5,8,12,16和24 h时间点每组取7只,摘眼球取血0.5 mL,4000×g离心10 min分离血浆,-80℃冻存备用。
1.4 血药浓度测定
1.4.1 溶液配制
精密称取盐酸厄洛替尼标准品4.56 mg,用流动相溶解配制成浓度为0.456 g·L-1储备液;精密称取索拉非尼标准品2.13 mg,用流动相溶解配制成浓度为0.0852 g·L-1内标液。均于4℃存放备用。
1.4.2 样品预处理
准确吸取血浆样品100 μL于1.5 mL EP管中,依次加入 20 μL 内标(0.0852 g·L-1),50 μL NaOH(0.1 mol·L-1),1 mL 正己烷-乙酸乙酯30∶70(V/V),涡旋振荡 5 min,12 000 ×g 离心10 min。取上清液,45℃氮气吹干,用100 μL流动相复溶,涡旋5 s,12 000×g离心5 min后进样,进样量 20 μL。
1.4.3 色谱条件
色谱柱:Agilent ZORBAX SB-C18(4.6 mm ×250 mm,5 μm);保护柱:Agilent ZORBAX SB-C18(4.6 mm ×12.5 mm,5 μm);柱温:25℃;流动相:乙腈-水(三氟乙酸调节 pH 2.0)(55∶45 V/V);流速:1.00 mL·min-1;检测波长:250 nm。流动相条件及血样处理方法参考文献[9-10]。
1.4.4 专属性考察
取空白血浆、空白血浆+盐酸厄洛替尼+内标、血浆样品按1.4.3项下方法操作,按1.4.1项下色谱条件进样分析。结果发现,盐酸厄洛替尼和内标索拉非尼的出峰时间分别为2.99和11.6 min。血浆中内源性物质对检测无干扰(图1)。

Fig.1 Chromatograms of erlotinib and sorafenib(internal standard).A:blank mouse plasma;B:blank plasma containing erlotinib 14 896 μg·L -1and sorafenib 17 040 μg·L -1;C:the detection limit(the concentration of erlotinb was 465.5 μg·L -1and that of sorafenib was 17 040 μg·L -1);D:plasma sample after administration(the concentration of erlotinb was 22 500 μg·L -1and that of sorafenib was 17 040 μg·L -1).
1.4.5 标准曲线测定
将厄洛替尼储备液用流动相逐级稀释配制系列标准溶液,各取10 μL,加入 90 μL 空白血浆配成终浓度分别为 44 688,22 344,14 896,11 172,7448,2793,1396.5和465.5 μg·L-1,然后按1.4.3项下血浆处理方法处理。将测得的厄洛替尼与内标面积比(R)对药物浓度(c)进行线性回归计算(加权系数1·c-2),回归方程为:R=4 ×10-5c+0.0193(r=0.9996)。血浆中厄洛替尼浓度在465.5~44688 μg·L-1范围内与峰面积成良好的线性关系。
1.4.6 最低检测浓度
取90 μL空白血浆,加入10 μL厄洛替尼标准溶液 4655 μg·L-1,使其终浓度为 465.5 μg·L-1。在方法确证的第2天对浓度样品进行5样本分析,并根据当日标准曲线计算每个样本浓度,计算得到该浓度下的精密度RSD为6.29%,准确度RE为10.74%,满足定量要求。
1.4.7 精密度和准确度
按1.4.5标准曲线测定项下方法配制厄洛替尼浓度分别为35 750.4,4468.8 和558.6 μg·L-1的质控溶液各5份,连续测定3次,计算日内精密度和准确度,日内精密度分别为 6.7%,9.1%和15.7%,准确度分别为 12.9%,8.8%和 -14.1%(表1)。连续测定3 d,随行标准曲线,根据当日标准曲线计算质控样品浓度,计算日间精密度和准确度,日间精密度分别为4.7%,6.7%和14.1%,准确度分别为14.3%,4.6%和 -16.4%(表1)。

Tab.1 Precision,accuracy and recovery of erlotinib in mouse plasma
1.4.8 回收率
配制35 750.4,4468.8 和558.6 μg·L-1质控溶液各5份,按1.4.3血浆处理和1.4.1色谱条件进行HPLC分析,得血浆中厄洛替尼峰面积。配制同浓度厄洛替尼标准溶液,同样方法处理并进样分析得厄洛替尼标准液峰面积。以厄洛替尼血浆样品峰面积与标准液峰面积的比值求算提取回收率。回收率分别为(92.4 ±7.2)%,(96.5 ±4.7)%以及(88.0 ±4.7)%(表1)。
1.4.9 样品稳定性
厄洛替尼血浆样品在室温避光放置24 h,-20℃~37℃反复冻融3次以及-80℃存放1个月之后的稳定性结果见表2,表明厄洛替尼在上述条件下均稳定。
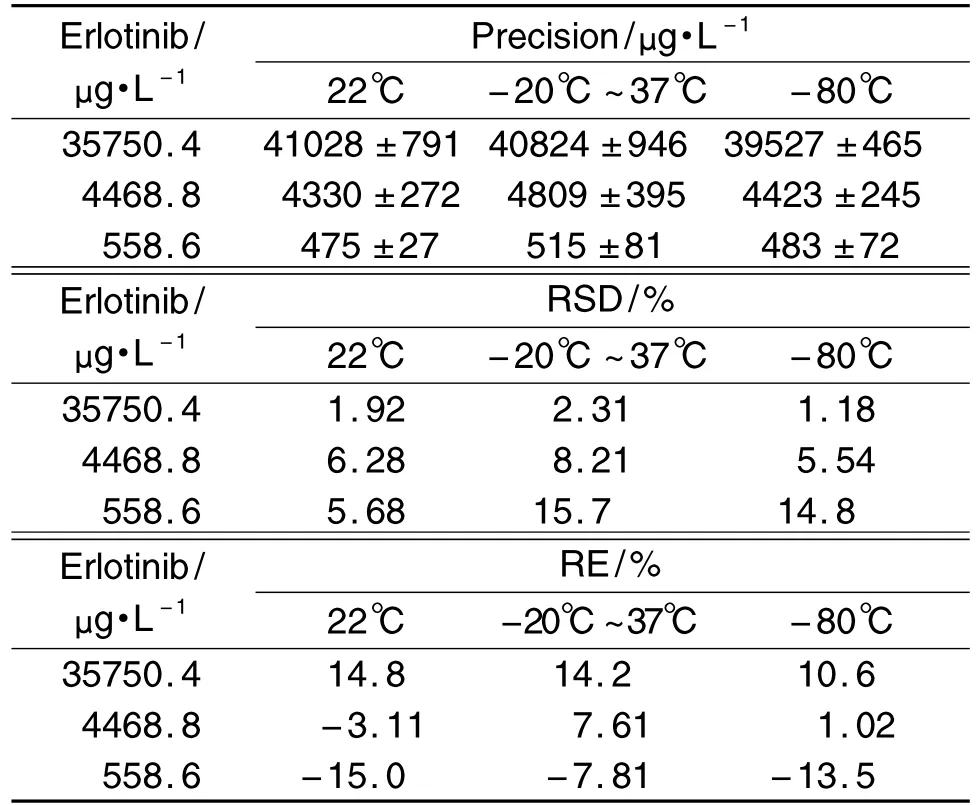
Tab.2 Precision and accuracy of erlotinib in mouse plasma under different storage conditions
2 结果
厄洛替尼ig给药后在荷瘤小鼠体内不同时辰点的平均药-时曲线见图2。根据血药浓度采用WinNonlin软件计算(表 3)。20:00给药组和24:00给药组的曲线下面积(AUC)明显比8:00,12:00,16:00和4:00给药组低,而8:00和12:00给药组的 AUC0~24h较高(分别为 440 083 μg·L-1·h,450 289 μg·L-1·h),差别有统计学意(P <0.01)。平均滞留时间(mean residence time,MRT)变化趋势与AUC基本一致,12:00给药组MRT0~24h最高(10.277 h,P <0.01)。4:00,8:00,12:00 给药组的MRT cmax相较其他3组为高,差异有显著性(P<0.01)。6个组给药时间点Tmax总体有显著性差异(P<0.01),其中8:00给药组最大(12.8 h)。6个给药时间点之间清除率(Cl)差异有显著性(P<0.01),20:00给药组的 Cl明显高于其他组(Clz/F=0.568 L·h-1·kg-1,P <0.01)。

Fig.2 Plasma concentration-time profile of erlotinib after administration at six different time points of the day.
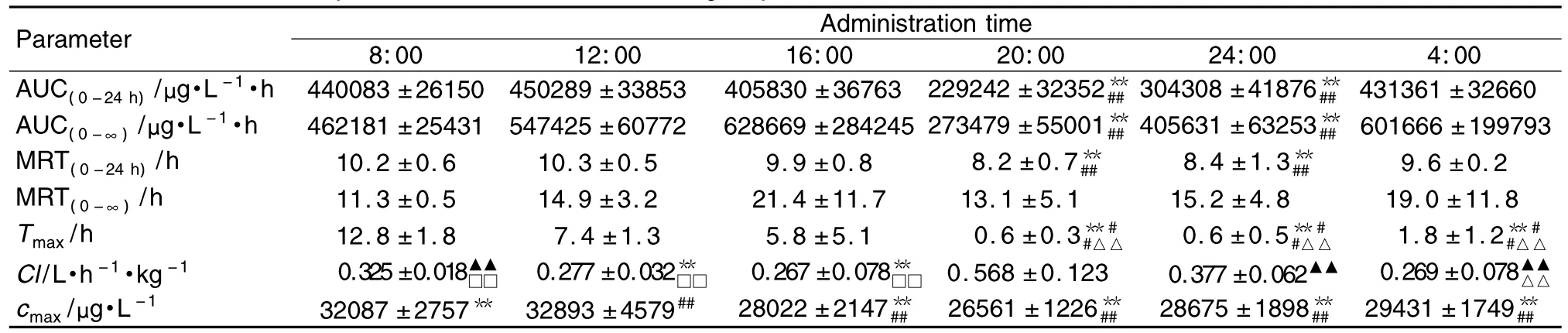
Tab.3 Pharmacokinetic parameters in blood of each group after erlotinib administration
3 讨论
厄洛替尼代谢的主要部位是在肝,而肝血流量、肝药酶的活性以及血浆蛋白水平均会影响其体内过程。研究表明,小鼠肝、肾部位血流量有昼夜节律变化,在活动期的血流量、白蛋白水平均较休息期增多,高峰出现在 21:00 ~3:00[11-12]。因而本研究中,20:00和24:00给药组的Cl明显高于其他给药组,且Tmax小,达到峰值浓度快,而8:00,12:00给药组的Tmax明显较其他组高,出现这种早晚差异的原因可能是暗期是小鼠活动期,血流量大,流速快,药物吸收代谢速度较快有关。此外,cmax的峰值出现在12:00组,且8:00和12:00给药组的AUC和MRT均明显高于其他各组,而20:00和24:00给药组峰值浓度最低,AUC和MRT小,清除率高,由此说明虽然早上8:00和12:00给药后吸收速度较慢,但药物吸收较完全,在体内作用时间长,反之,20:00~24:00用药可能作用效果较凌晨和上午(4:00~12:00)弱。
本研究表明,厄洛替尼在荷瘤小鼠药代动力学具有时辰节律性特点,可以为探索厄洛替尼时辰给药的药效学以及其临床时辰化疗的应用提供参考,但具体内在机制仍有待进一步研究。因此,下一步将对小鼠肝药酶是否具有时辰节律性进行研究,期望从药物代谢角度解释厄洛替尼在小鼠体内过程的昼夜节律。
[1]He SX.Chronopharmacology and Chronotherapy(时间药理学与时间治疗学)[M].Tianjin:Tianjin Science and Technology Press,1994:8-15.
[2]Falcone A,Allegrini G,Antonuzzo A,Brunetti I,Pfanner E,Lencioni M,et al.Infusions of fluorouracil and leucovorin:effects of the timing and semi-intermittency of drug delivery[J].Oncology,1999,57(3):195-201.
[3]Zhang Q,Jia ZP,Jiang NX,Wang R.The chronophamacokinetics ofmethotrexate[J]. Chin Hosp Pharm J(中国医院药学杂志),2004,24(3):147-148.
[4]Filipski E,Amat S,Lemaigre G,Vincenti M,Breillout F,Lévi FA.Relationship between circadian rhythm of vinorelbine toxicity and efficacy in P388-bearing mice[J].J Pharmacol Exp Ther,1999,289(1):231-235.
[5]Hrushesky WJ,Langevin T,Kim YJ,Wood PA.Circadian dynamics of tumor necrosis factor alpha(cachectin)lethality[J].J Exp Med,1994,180(3):1059-1065.
[6]Bruguerolle B,Prat M.Circadian phase dependent acute toxicity and pharmacokinetics of etidocaine in serum and brain of mice[J].J Pharm Pharmacol,1990,42(3):201-202.
[7]Portaluppi F,Smolensky MH,Touitou Y.Ethics and methods for biological rhythm research on animals and human beings[J]. Chronobiol Int,2010,27(9-10):1911-1929.
[8]Huang YS,Zhou ZL,Lei LC,Zhao JH,Huang CQ,Deng HM,et al.Determination of erlotinib in human plasma by HPLC-MS/MS[J].Cent South Pharm(中南药学),2011,9(11):801-804.
[9]Lepper ER,Swain SM,Tan AR,Figg WD,Sparreboom A.Liquid-chromatographic determination of erlotinib(OSI-774),an epidermal growth factor receptor tyrosine kinase inhibitor[J].J Chromatogr B Analyt Technol Biomed Life Sci,2003,796(1):181-188.
[10]Faivre L,Gomo C,Mir O,Taieb F,Schoemann-Thomas A,Ropert S,et al.A simple HPLC-UV method for the simultaneous quantification of gefitinib and erlotinib in human plasma[J].J Chromatogr B Analyt Technol Biomed Life Sci,2011,879(23):2345-2350.
[11]Gandhi A,Moorthy B,Ghose R.Drug disposition in pathophysiological conditions[J].Curr Drug Metab,2012,13(9):1327-1344.
[12]Hecquet B,Meynadier J,Bonneterre J,Adenis L,Demaille A.Time dependency in plasmatic protein binding of cisplatin[J].Cancer Treat Rep,1985,69(1):79-83.

